- 766.50 KB
- 2022-08-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
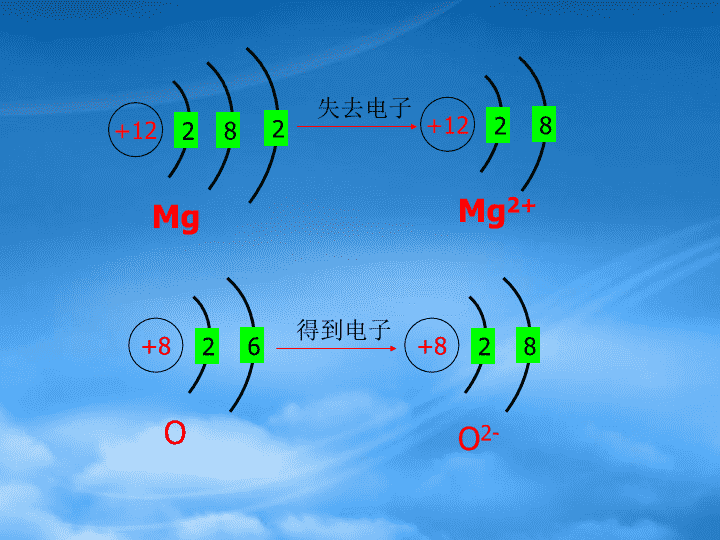
原子核外电子排布规律① 电子总是尽先排布在能量最低的电子层里,然后由往外,依次排在能量逐步升高的电子层里(能量最低原理)先排K层,排满K层后再排L层,排满L层后再排M层②每个电子层最多只能容纳2n2个电子。③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子\n原子结构与元素性质的关系(结构决定性质)(1)稳定结构:原子既不容易失去电子又不容易得到电子(如He、Ne、Ar等)(2)不稳定结构:原子容易失去电子转化或容易得到电子转化最外电子层上为8(有些为2)个电子的稳定结构。(如,失去:Na、Mg、Al得到:F、O、Cl)\n+12282失去电子+1228MgMg2++826+828得到电子OO2-\n结论1、活泼金属元素的原子容易失去最外层上的电子变为带正电荷的阳离子,阳离子所带正电荷的数目等于原子失去的电子的数目。MgMg2+失2e-(带2个单位正电荷)2、活泼非金属元素的原子容易得到电子变为带负电荷的阴离子,阴离子所带负电荷的数目等于原子得到的电子的数目。OO2-得2e-(带2个单位负电荷)\n问题解决:氧化镁的形成宏观:氧气和金属镁反应生成氧化镁,氧化镁是氧元素与镁元素相结合的产物。微观:每个Mg失去2个电子形成与Ne一样的稳定电子层结构的Mg2+,每个O得到2个电子形成与Ne一样的稳定电子层结构的O2-,带正电荷的Mg2+与带负电荷的O2-相互发生电性作用,形成稳定的MgO.如下图2Mg+O2==2MgO△\n+12Mg+8O+12+8Mg2+O2-结论:原子最外层的电子数小于8个时,在化学反应中总是得到或失去电子而达到最外层8电子的稳定结构。\n⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应生成氧化物和氯化物,请写出这些氧化物和氯化物的化学式。元素化合价原子最外层电子数目失去(或得到)电子的数目NaMg2O6Cl-1⒉根据Na、Mg、O、Cl原子在反应中失去或得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素的化合价,将结果填入下表:一些元素的原子得失电子的情况Na2O、MgO、NaCl、MgCl2\n问题解决①最外层电子数﹤4时,容易失去电子(化合价=+失去的电子数目)原子②最外层电子数≥4时,容易得到电子化合价=-(8-最外层电子数)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)\n⒈原子核外电子是排布的⒉金属元素的原子最外层一般个电子,在化学反应中易电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。⒊非金属元素的原子最外层一般个电子,在化学反应中易电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。⒋化学反应中,原子核不发生变化,但原子的发生变化,元素的化学性质主要决定于原子结构中的。练习:\n原子的构成\n1、原子是构成物质的一种微粒,原子是否可以再分?如果原子可以再分,它由哪些更小的微粒构成呢?2、相对原子量如何定义?原子核内有6个质子,6个中子的碳原子的质量是1.993×10-26kg,某种原子的质量是9.288×10-26kg,则该原子的相对原子质量是______________\n3、阅读表1-7,质子、中子、电子的电性和电量怎样?比较三种粒子的质量大小、带电荷情况。(1)填写下表:构成原子的微粒电子原子核质子中子电性和电量0质量/kg9.109×10-311.673×10-271.675×10-27相对质量1/18361.0071.008负电荷1.602×10-19正电荷1.602×10-19(2)质子、中子的相对质量如何计算?请列出有关计算式。\n1构成原子的微粒之间的数量关系\n原子质子数(Z)中子数(N)质子数+中子数(A)相对原子质量F1018.998(19)Na1222.989(23)Al1426.982(27)919112313274、什么是质量数?相对原子质量与质量数有何关系?\n如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数。质量数(A)=质子数(Z)+中子数(N)\nXAZ——元素符号质量数——核电荷数——(核内质子数)XAZ原子原子核核外电子(Z)质子(Z)中子(N=A-Z)关系式1:(电性关系)核电荷数=核内质子数=原子序数=核外电子数2含义:代表一个质量数为A、质子数为Z的原子。关系式2:(质量关系)质量数(A)=质子数(Z)+中子数(N)\nA、Z、c、d、e各代表什么?A——代表质量数;Z——代表核电荷数(质子数)c——代表离子所带的电荷数d——代表化合价e——代表原子个数AZXc+--+de\n原子:核电荷数(Z)=核内质子数=核外电子数阳离子:核电荷数(Z)=核内质子数>核外电子数核电荷数(Z)=核外电子数+电荷数阴离子:核电荷数(Z)=核内质子数<核外电子数核电荷数(Z)=核外电子数—电荷数构成原子的微粒之间的数量关系1、核电荷数=核内质子数=核外电子数=原子序数2、质量数(A)=质子数(Z)+中子数(N)注意:\n想一想:2、填表微粒核电荷数质子数中子数电子数质量数(1)(2)(3)(4)(5)\n元素:具有相同质子数的同一类原子的总称。同位素:质子数相同而中子数不同的核素互称为同位素。17Cl,3517Cl376C,136C,126C148O,168O,178O18核素:具有一定质子数和一定中子数的一种原子。1H,11H,21H3氕(pie),氘(dao),氚(chuan)HDT\n同位素的特点:①同种元素,可以有若干种不同的核素。(元素:112种,同位素:1800种)②同种元素是同一元素的不同核素之间的互相称谓,不指具体的原子。③同一种元素的不同同位素原子其质量数不同,核外电子层结构相同,其原子、单质及其构成的化合物化学性质几乎相同,只是某些物理性质略有差异。同位素构成的化合物是不同的化合物,H2O、D2O、T2O的物理性质不同,化学性质几乎相同。\n氢元素的三种核素氕氘氚HDT重氢超重氢\n5.构成原子的基本粒子的特点:①_____决定元素的种类;②_____决定同一元素的不同核素(同位素);③______决定核素(同位素)的种类;决定原子的质量;④_______决定元素的化学性质;⑤_______决定粒子的带电性。例:下列化学式共有几种元素?几种原子?代表几种分子?1H216O,2H218O,1H35Cl,1H37Cl,2H35Cl,12C18O2,12C16O2,14C16O24种元素,8种不同的原子,8种分子。\n【例】(2005年江苏高考题)我国的“神舟”五号载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是()A.42He原子核内含有4个质子B.32He和42He互为同位素C.32He原子核内含有3个中子D.42He的最外层电子数为2,所以42He具有较强的金属性B\n例题2据报道,上海某医院正在研究用放射性的一种碘治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是I12553A、72B、19C、53D、125B某二价阴离子,核外有18个电子,质量数为32,则其中子数为:A、12B、14C、16D、18C\nC-NMR(核磁共振)可以用于含碳化合物的结构分析,表示的碳原子.136C136A、核外有13个电子B、核内有6个质子,核外有7个电子C、质量数为13,质子数为6,核外有7个电子D、质量数为13,质子数为6,核内有7个中子00全国高考题D\n4.1999年新发现的114号元素的一种原子,其中子数为184,该原子的质量数为A、70B、114C、228D、29800广东高考题\n5.和Na+具有相同质子数和电子数的微粒是:A、NH4+B、F-C、H2OD、NH36.某粒子用表示,下列关于该粒子的叙述正确的是A、所含质子数=A-nB、所含中子数=A-ZC、所含电子数=Z+nD、质量数=Z+AAZRn+AB\n7.核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中所含质子的物质的量是nA+16(A-N+8)molnA+16(A-N+10)mol(A-N+2)molnA(A-N+8)molA、B、C、D、\n⒈原子的构成是本节重点,掌握的关系式:\n