- 882.50 KB
- 2022-08-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
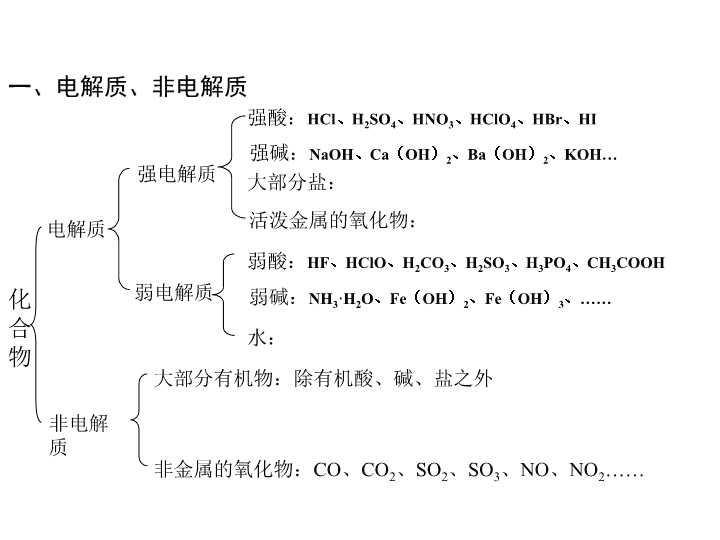
高中化学选修4第三章复习课件\n第三章重要知识点第一节1、强弱电解质的概念及其判断。2、会写常见电解质的电离方程式如:CH3COOH、H2S、Cu(OH)2H2CO3、KHCO3、KHSO4、NH3.H2O3、会分析导电性和强弱电解质的关系。4、影响电离平衡的因素。\n化合物电解质非电解质强电解质弱电解质强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI强碱:NaOH、Ca(OH)2、Ba(OH)2、KOH…大部分盐:活泼金属的氧化物:弱酸:HF、HClO、H2CO3、H2SO3、H3PO4、CH3COOH弱碱:NH3·H2O、Fe(OH)2、Fe(OH)3、……水:大部分有机物:除有机酸、碱、盐之外非金属的氧化物:CO、CO2、SO2、SO3、NO、NO2……一、电解质、非电解质\n\n\n\n二、影响电离平衡的因素1、温度:2、浓度:3、同离子效应:向HAc中加入NaAC4、加入能反应的物质:如HAc中活泼金属或氢氧化钠,\n第三章重要知识点第二节1、水的离子积常数Kw。2、影响水的电离平衡的因素。3、有关PH值的简单计算。4、中和滴定。\n第三章重要知识点第二节1、水的离子积常数Kw。2、影响水的电离平衡的因素。3、有关PH值的简单计算。4、中和滴定。\n一、水的电离和溶液的PH值1、水的电离水的离子积:影响因素温度:酸:碱:可水解的盐:2、溶液的酸碱性和PH值-lgc(H+)水是一种极弱的电解质,能微弱的电离。思考:公式中H+、OH-是水电离出来的吗?KW只与什么因素,与外加酸碱有关吗?\n(1)酸、碱溶液稀释后的pH变化强酸(pH=a)弱酸(pH=a)强碱(pH=b)弱碱(pH=b)稀释10n倍3、pH的简单计算pH=a+na<pH<a+npH=b-nb-n<pH<b\n(2).同强相混混合算a.强酸与强酸混合求pHb.强碱与强碱混合求pH\nc.酸过量:先求c(H+)余=再求pH=-lg[c(H+)余]。d.碱过量:先求c(OH-)余=再求c(H+)=,然后求pH。\n\n3、中和滴定实验\n1、滴定准备:查—洗—润—注—排—调—读—记中和滴定的操作:滴定管先用水洗,再用所盛溶液润洗锥形瓶只能用水洗,不能再用待测溶液润洗2、滴定①移液、加指示剂②滴定④读数、记录⑤重复2-3次左手控旋塞,右手摇锥瓶;眼睛观颜色③确定终点:待溶液颜色发生变化,且保持半分钟不变时,即到达滴定终点。3、数据处理先快后慢,接近终点时“一滴一摇”\n常用指示剂的变色范围甲基橙
石蕊
酚酞———3.1———4.4———红色橙色———5.0———8.0——————8.2———10.0———红色紫色蓝色粉红色无色红色黄色A、指示剂的PH变色范围尽可能接近中和时的PHB、颜色变化明显。(石蕊颜色变化不明显,一般不选用)。指示剂的选择原则:思考1盐酸滴定强氧化钠2盐酸滴定氨水3氢氧化钠滴定醋酸\n误差分析:(用标准盐酸滴定未知浓度的氢氧化钠溶液)关键:紧扣公式,分析V(标)的变化↓计算已知↑↓预先量取→滴定测得中和滴定指示剂误差分析\n一、酸式滴定管(酸滴碱)1、未用标准盐酸标准液润洗酸式滴定管()2、滴定管尖嘴处有气泡,滴定后气泡消失()3、滴定操作时,有少量盐酸滴于锥形瓶外()4、滴定前仰视刻度,滴定后俯视刻度()偏高偏高偏高偏低导致盐酸被稀释,V标偏大\n二、锥形瓶6、锥形瓶内用蒸馏水洗涤后,再用待测氢氧化钠润洗2-3次,将润洗液倒掉,再装NaOH溶液()7、锥形瓶用蒸馏水洗后未倒尽即装NaOH溶液()8、滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分。()偏高无影响偏低锥形瓶壁上残留NaOH,V标偏大导致NaOH的损失,V标偏小NaOH的物质的量不变,V标不变\n三、碱式滴定管10、碱式滴定管用水洗后,未用待测液润洗()11、取待测液时,为将盛待测液的碱式滴定管尖嘴的气泡排除。取液后滴定管尖嘴充满溶液()偏低偏低导致NaOH被稀释,V标偏小所取NaOH物质的量偏小,V标偏小\n第三章重要知识点第三节1、盐类水解的本质2、水解方程式书写3、影响水解平衡移动的因素4、溶液中粒子浓度大小的比较\n一、盐类水解1、实质:2、规律:3、影响因素有弱才水解,无弱不水解,越弱越水解;谁强显谁性,两弱相促进,两强不水解。盐电离出来的离子与水电离出来的H+或OH-结合,从而使水的电离平衡发生移动的过程。1.内在因素:2.外在因素:①温度:②冲稀:③加入酸或碱:\n4、溶液中粒子浓度大小的比较⑴.多元弱酸溶液,根据多步电离分析,如H3PO4溶液中,⑵.多元弱酸的正盐溶液根据弱酸根的分步水解分析,如在Na2CO3溶液中,⑶.不同溶液中同一离子浓度的比较,要看溶液中其他离子对它的影响。如在相同物质的量浓度的下列各溶液中①NH4Cl②CH3COONH4③NH4HSO4,c(NH4+)由大到小的顺序是⑷.混合溶液中各离子浓度的比较,要进行综合分析,如电离因素、水解因素等。\n5、溶液中的守恒关系⑴、电荷守恒规律:如NaHCO3溶液中存在着Na+、H+、HCO3-、CO32-、OH-,但存在如下关系:⑵、物料守恒规律:某些关键性的原子总是守恒的。如Na2S溶液中,S2-能水解,故S元素以S2-、HS-、H2S三种形式存在,它们之间有如下守恒关系:\n⑶质子守恒规律:如Na2S溶液中,\n第三章重要知识点第四节1、难溶电解质的溶解平衡2、沉淀反应的应用3、溶度积和溶度积规则\n1、沉淀溶解平衡:(1)概念:在一定条件下,当难溶电解质的溶解速率与溶液中的有关离子或分子重新生成沉淀的速率相等时,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡。溶解平衡时的溶液是饱和溶液。(2)特征:逆、等、动、定、变(3)影响因素:①内因:电解质本身的性质a、绝对不溶的电解质是没有的。b、同是难溶电解质,溶解度差别也很大。c、易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。②外因:a.浓度:加水,平衡向溶解方向移动。b.温度:升温,多数平衡向溶解方向移动。c.同离子效应:在电解质A的饱和溶液中,加入含有相同离子的强电解质时,A的溶解平衡会被抑制。2.溶度积和溶度积规则:(1)、溶度积(Ksp):在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之乘积为一常数.\n3、沉淀反应的应用:(2)、表达式:(MmAn的饱和溶液)Ksp=[c(Mn+)]m·[c(Am-)]n(3)、溶度积规则:离子积Qc=c(Mn+)m·c(Am-)nQc>Ksp,溶液处于过饱和溶液状态,生成沉淀.Qc=Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.Qc