- 1.19 MB
- 2022-08-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
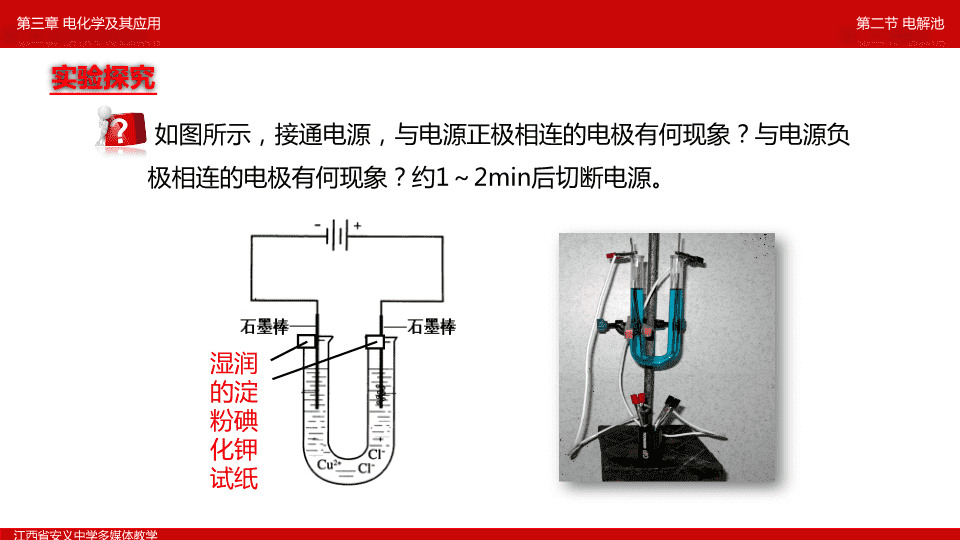
第二节电解池\n__________安义中学熊青平\n如图所示,接通电源,与电源正极相连的电极有何现象?与电源负极相连的电极有何现象?约1~2min后切断电源。湿润的淀粉碘化钾试纸实验探究第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n阴极(与电源负极相连)阳极(与电源正极相连)电极现象电极产物电极反应反应类型有红色物质析出。无气泡产生。有气泡产生,该气体可使润湿的淀粉碘化钾试纸变蓝。CuCu2++2e-=Cu还原反应Cl22Cl--2e-=Cl2↑氧化反应总反应CuCl2Cu+Cl2↑通电第二节电解池江西省安义中学多媒体教学第三章电化学及其应用实验探究\n1、通电前,CuCl2溶液中存在哪些离子?它们在溶液中如何运动?3、通电后,移向各区域的离子可能发生什么反应?谁先反应?为什么?2、通电后,这些离子在溶液中的运动是否会发生变化?如何变化?第二节电解池江西省安义中学多媒体教学第三章电化学及其应用科学猜想\nCu2+-+e-电子流出Cu2+运动Cl-运动Cl-oooooooooooooooooooooooooooooooooooooooooooCl2oooooooooooooooooooooooooooooooooooooooooooCl-Cl-运动电子流入Cu通电前:CuCl2=Cu2++2Cl-H2OH++OH-通电后:Cu2+、H+移向阴极:2Cl--2e-=Cl2↑Cu2++2e-=CuCl-、OH-移向阳极:总反应:阳极阴极H+H+OH-OH-氧化性:Cu2+>H+,故Cu2+优先于H+反应:还原性:Cl->OH-,因此Cl-优先于OH-反应:放电放电第二节电解池江西省安义中学多媒体教学第三章电化学及其应用e-\n一、电解原理1、电解:电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。2Cl--2e-=Cl2↑Cu2++2e-=Cu总反应式:CuCl2Cu+Cl2↑电解阳极:阴极:与电源负极相连与电源正极相连(氧化反应)(还原反应)2、电极及反应:把电能转变为化学能的装置。3、电解池:第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n-+e-阳极阴极构成电解池的条件是什么?(1)外接直流电源;(2)有两个电极;(3)有电解质溶液或熔融电解质;(4)形成回路。+Cu2+-+Cl-Cl-H+OH-(阴极、阳极)第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n一、电解原理1、电解:电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。把电能转变为化学能的装置。2、电解池:3、发生电解的条件:①电流②电解质溶液或熔融电解质③两个电极④形成闭合回路第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n电子流向负极阴极阳极正极经导线-+e-阳极阴极Cu2+-+e-e-电子流出Cl-Cl-电子流入H+OH-经导线电子从负极流向阴极,经溶液离子导电,再从阳极流回正极。电子流向第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n氯化铜的电解原理第二节电解池江西省安义中学多媒体教学第三章电化学及其应用电解质溶液导电的过程就是电解质溶液的电解过程。温馨提醒如此页flash动画不能正常播放,请用wps软件打开该ppt课件。\n电解硫酸钠溶液中会有怎样的结果?H2OH++OH-Na2SO4=2Na++SO42-离子放电的顺序阳离子阴离子H+>Na+OH->SO42-4OH--4e-=2H2O+O2↑4H++4e-=2H2↑总反应:2H2O=O2↑+2H2↑电解阳极:阴极:第二节电解池江西省安义中学多媒体教学第三章电化学及其应用氧化性:还原性:\n阴离子失去电子,阳离子得到电子的过程叫放电。影响离子放电的因素:离子得失电子的能力离子的浓度4、放电能力第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n阳离子的放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(浓度大,酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(浓度小,水)>Al3+>Mg2+>Na+>Ca2+>K+阴离子的放电顺序:S2->I->Br->Cl->OH->含氧酸根离子>F-放电顺序:金属越不活泼,对应阳离子氧化性越强,越容易得电子。阴极:氧化性强的阳离子先得电子阳极:还原性强的阴离子先失电子金属>(除Pt、Au,Ag前)第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n装置类别电解池电极名称极(与电源正极相连)极(与电源负极相连)电极反应类型能量转变能转变为能反应是否能自发进行原电池极(电子流出的电极)极(电子流入的电极)能转变为能电能阳阴氧化反应还原反应化学不能自发化学氧化反应还原反应电能能自发负正对比小结第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n写出下列装置的电极反应式通电前:CuSO4=Cu2++SO42-通电后:Cu2+、H+移向阴极:4OH--4e-=O2↑+2H2OCu2++2e-=CuSO42-、OH-移向阳极:总反应:2Cu2++4e-=2CuH2OH++OH-挑战自我第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n下图是以石墨为电极,电解NaCl溶液的装置图,请标出电源各电极的名称、电解池各电极的名称、电子流向、写出各电极反应式。电源各电极的名称电解池各电极的名称各电极反应式电子流向+-阴极阳极通电前:NaCl=Na++Cl-通电后:Na+、H+移向阴极:2Cl--2e-=Cl2↑2H++2e-=H2↑Cl-、OH-移向阳极:总反应:H2OH++OH-第二节电解池江西省安义中学多媒体教学第三章电化学及其应用挑战自我此处上面文字有超链接,请点击相应文字\n1、分析溶液中存在的所有离子(包括水的电离)、并分成阳离子组和阴离子组。2、根据放电规律,阳离子在阴极发生还原反应,而阴离子在阳极发生氧化反应,完成电极反应式。(注意得失电子守恒)3、由阴阳两电极反应式,合并得总反应式。弱电解质的须保持分子形式)二、电极反应式、电解方程式的书写:第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n三、电解规律(用惰性电极电解时)⑴、电解水型:电解含氧酸、强碱溶液、活泼金属的含氧酸盐溶液时,如电解H2SO4、HNO3、NaOH、Na2SO4等溶液。阳极:4OH--4e-=2H2O+O2↑阴极:4H++4e-=2H2↑总反应:2H2O=O2↑+2H2↑电解电解后溶液中溶质的质量分数,若要恢复原来的浓度,只需加入一定量的即可。实质:电解水例如:电解硫酸钠溶液增大水第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n⑵、电解电解质型:电解无氧酸溶液(氢氟酸除外)、不活泼金属的无氧酸盐溶液,如电解盐酸、CuCl2溶液等。电解后溶液中溶质的质量分数,若要恢复原来的组成和浓度,需加入一定量的(通入一定量的HCl气体)阳极:2Cl--2e-=Cl2↑阴极:2H++2e-=H2↑总反应:2HCl=Cl2↑+H2↑电解例如:电解盐酸:实质:电解质本身被电解减小溶质第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n⑶、放氧生酸型:电解不活泼金属的含氧酸盐时,电解质和水都有一部分被电解,如电解CuSO4溶液、AgNO3溶液等。阳极:4OH--4e-=2H2O+O2↑阴极:2Cu2++4e-=2Cu总反应:2CuSO4+2H2O=2Cu+O2↑+2H2SO4电解电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量金属氧化物。例如:电解CuSO4溶液第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n⑷、放氢生碱型:电解活泼金属的无氧酸盐溶液时,电解质和水都有一部分被电解,如电解NaCl溶液等。电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需通入一定量的HCl。阳极(C):2Cl--2e-=Cl2↑阴极(C):2H++2e-=H2↑总反应:2NaCl+2H2O=2NaOH+Cl2↑+H2↑电解第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n电解类型举例电极反应式物质类别实例含氧酸H2SO4可溶性强碱NaOH氢前金属含氧酸盐Na2SO4无氧酸HCl阳极:4OH--4e-=O2↑+2H2O阴极:4H++4e-=2H2↑阳极:2Cl--2e-=Cl2↑阴极:2H++2e-=H2↑氢后金属无氧酸盐CuCl2阳极:2Cl--2e-=Cl2↑阴极:Cu2++2e-=Cu氢前金属无氧酸盐NaCl阳极:2Cl--2e-=Cl2↑阴极:2H++2e-=H2↑氢后金属含氧酸盐CuSO4阳极:2Cu2++4e-=2Cu阴极:4OH--4e-=O2↑+2H2O惰性电极电解规律小结相当于电解水相当于电解溶质本身溶质和溶剂同时电解第二节电解池江西省安义中学多媒体教学第三章电化学及其应用\n●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●●同学们再见