- 558.00 KB
- 2022-08-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
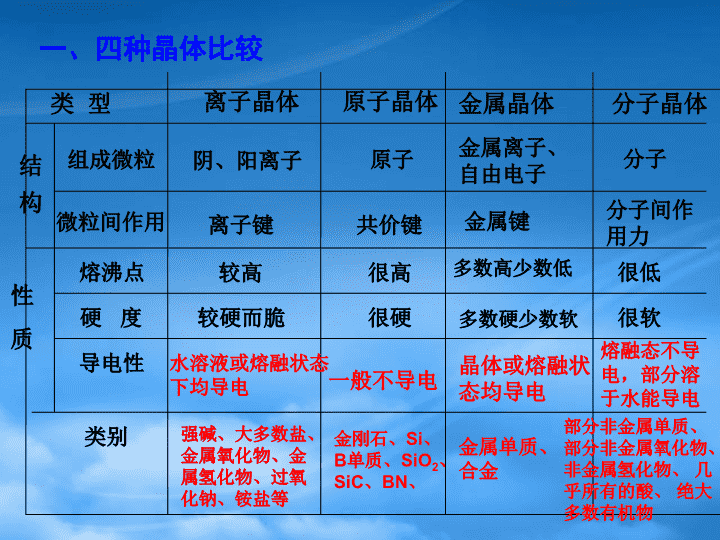
四大晶体微粒间作用力与物质性质复习离子晶体、原子晶体、金属晶体\n复习重点:1.比较离子晶体、原子晶体和金属晶体组成微粒,微粒间作用力、熔沸点、硬度、导电性;2.影响晶体熔点和沸点的因素;3.熟悉三类晶体的代表物结构;学会计算晶体中微粒的个数之比。\n一、四种晶体比较类型金属晶体离子晶体原子晶体原子金属离子、自由电子金属单质、合金微粒间作用组成微粒结构性质熔沸点硬度导电性类别阴、阳离子离子键共价键金属键较高很高多数高少数低较硬而脆很硬多数硬少数软水溶液或熔融状态下均导电一般不导电晶体或熔融状态均导电强碱、大多数盐、金属氧化物、金属氢化物、过氧化钠、铵盐等金刚石、Si、B单质、SiO2、SiC、BN、分子晶体分子分子间作用力很低很软熔融态不导电,部分溶于水能导电部分非金属单质、部分非金属氧化物、非金属氢化物、几乎所有的酸、绝大多数有机物\n【跟踪练习】1.下列式子中,真实表示分子组成的是AH2SO4BNH4ClCSiO2DNa2.在下列有关晶体的叙述中错误的是A离子晶体中,一定存在离子键B原子晶体中,只存在共价键C原子晶体的熔点一定比金属晶体的高D晶体中有阴离子就一定有阳离子AC\n3.实现下列变化时,需克服相同类型作用力的是A.水晶和干冰的熔化B.食盐和冰醋酸熔化C.液溴和液汞的气化D.纯碱和烧碱的熔化D原子晶体4.分析下列物质的物理性质,判断其晶体类型:A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;________________B、物质A,无色晶体,固体不导电,熔融时或溶于水中都能导电_____________C、固体或熔融后易导电,熔点在1000℃左右________________D、溴化铝,无色晶体,熔点98℃,熔融态不导电;_______________离子晶体金属晶体分子晶体\n5、下列物质⑴NaOH⑵Mg⑶金刚石⑷冰⑸干冰⑹NH4Cl⑺石英⑻白磷⑼铁⑽铝合金⑾金刚砂⑿玻璃⒀晶体硼⒁无定形碳⒂H2SO4中属于离子晶体的有:属于原子晶体的有:属于金属晶体的有:属于分子晶体的有:⑴⑹⑶⑺⑾⒀⑵⑼⑽⑷⑸⑻⒂\n6、下列八种晶体:A水晶B冰醋酸C氧化镁D白磷E氩晶体F硫酸铵G铝H金刚石⑴属于原子晶体的化合物是,直接由原子构成的分子晶体是。⑵含有共价键的离子晶体是属于分子晶体的单质是。⑶在一定条件下,能导电而不发生化学变化的是,受热熔化后不发生化学键断裂的是,受热熔化需克服共价键的是。AEFDEGBDEAH\n【例题】比较下列物质的熔沸点高低,并说明理由。1.C(金刚石)、NaCl、Na2.NaCl、KCl、CsCl3.C(金刚石)、Si、SiC4.Na、Mg、Al二、物质熔沸点高低的判断C(金刚石)﹥NaCl﹥NaNaCl﹥KCl﹥CsClC(金刚石)﹥SiC﹥SiAl﹥Mg﹥Na\n1.不同晶体类型的物质:原子晶体>离子晶体>(金属晶体)>分子晶体2.同种晶体类型的物质:⑴离子晶体晶体内微粒间作用力越大,熔沸点越高⑵原子晶体⑶金属晶体离子所带电荷越、离子半越,晶格能越大,离子键越强,晶体熔沸点越、硬度越。原子半径越、键长越、键能越大,共价键越强,晶体熔沸点越、硬度越。金属原子半径越、单位体积内自由电子数目越,金属键越强,晶体熔沸点越、硬度越。多小高大小短高大小多高大\n比较下列几组晶体熔沸点高低的顺序(由高到低)1、金刚石、氯化钠、晶体硅、干冰金刚石、晶体硅、氯化钠、干冰2、石英、铝硅合金、晶体硅、冰石英、晶体硅、铝硅合金、冰3、氧化钙、氯化钾、氯化钙、碘化钾氧化钙、氯化钙、氯化钾、碘化钾4、氧化镁、氧气、水、氮气氧化镁、水、氧气、氮气【跟踪练习】\n三、典型晶体的结构特征1.离子晶体NaCl(1)每个Na+周围吸引着个Cl-每个Cl-周围吸引着个Na+Na+、Cl-个数比为。(2)每个Na+周围与其距离最近且相等的Na+有个(3)1个NaCl晶胞中含有个Na+,个Cl-6611:1244\n二、典型晶体的结构特征CsCl(1)每个Cs+周围吸引着个Cl-每个Cl-周围吸引着个Cs+Cs+、Cl-个数比为。(2)每个Cs+周围与其距离最近且相等的Cs+有个(3)1个CsCl晶胞中含有个Cs+,个Cl-8811:611\n(1)每个C原子和个C原子形成个共价键,形成结构;(2)C原子与碳碳键个数比为;(3)最小环有个C原子组成;(4)金刚石晶胞中含有个碳原子44正四面体61︰22.原子晶体——空间网状结构金刚石金刚石晶胞8\n(1)每个Si原子周围吸引着个O原子;每个O原子周围吸引着个Si原子;Si、O原子个数比为(3)最小环有个原子组成(2)Si原子与Si—O键个数比为;O原子与Si—O键个数比为。421:2121:41:2SiO2\n金属原子堆积方式原子周围距离相等的原子数目晶胞内的原子数常见金属简单立方堆积体心立方堆积六方堆积面心立方堆积6182126124Po(钋)Na、K、Cr、Mo(钼)、W等Mg、Zn、Ti等Au、Ag、Cu、Al等3.金属晶体\n4、分子晶体:B、与CO2分子距离最近且相等的CO2分子共有多少个?A、平均每个晶胞中CO2分子的个数:\n在石墨晶体中,层与层之间是以结合,同一层内C原子与C原子以结合成平面网状结构,故石墨为混合型晶体或过渡型晶体。在同一层中,每个C原子与个C原子形成C-C键,键角为,其中最小的环为元环,每个C原子被个六元环共有,每个C-C键被个六元环共有;每个六元环拥有的C原子数为_,拥有的C-C键数为__,则C原子数与C-C键数之比为_____。2:323范德华力共价键120°3六325、过渡型晶体\n【跟踪练习】1.下列各项所述的数字不是6的是A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数B.在金刚石晶体中,最小的环上的碳原子个数C.在二氧化硅晶体中,最小的环上的原子个数D.在NaCl晶体中,与一个Cl-最近的且距离相等的Na+的个数2.某物质由A、B、C三种元素组成,其晶体中微粒的排列方式如图所示:该晶体的化学式是AAB3C3BAB3CCA2B3CDA2B2CCB\n3.食盐晶体如右图所示。在晶体中,表示Na+,表示Cl。已知食盐的密度为g/cm3,NaCl摩尔质量Mg/mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl的间距大约是AcmBcmCcmDcmBC4.下列说法正确的是(NA为阿伏加德罗常数)A.124gP4含有P—P键的个数为4NAB.12g金刚石中含有C—C键的个数为4NAC.12g金刚石中含有C—C键的个数为2NAD.60gSi02中含Si—O键的个数为2NA\n【课堂检测】1.氮化硼是一种新合成的结构材料,它是超硬、耐磨、耐高温的物质,下列各组物质熔化时所克服的粒子间的作用与氮化硼熔化时所克服的粒子间作用相同的是()A.硝酸钠和金刚石B.晶体硅和水晶C.冰和干冰D.苯和酒精2.在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小环上有个碳原子,每个碳原子的任意两个C—C键的夹角都是(填角度)。如果C—C键的键能是WkJ·mol-1,则将12g金刚石碳碳键完全破坏掉需要的能量是kJ。62W109。28′【自主小结】B\n