- 215.50 KB
- 2022-08-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
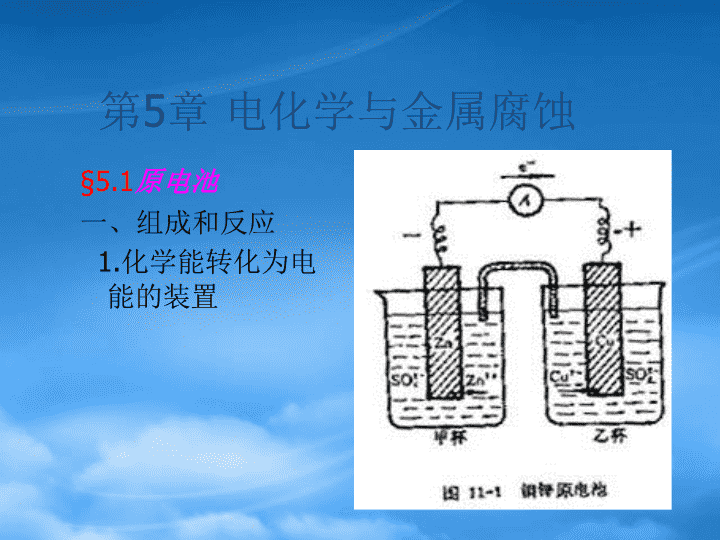
第5章电化学与金属腐蚀§5.1原电池一、组成和反应1.化学能转化为电能的装置\n能自发进行的反应才具有能量,即ΔG<0的反应;可利用的最大化学能等于ΔG的数值:电功(非体积功)Wmax=-ΔG.电池反应一般是一氧化还原反应:Zn+Cu2+(aq)←→Zn2+(aq)+Cu标态下,298K时ΔrGø=ΔfGøZn2+-ΔfGøCu2+=-147.06-65.249=-212.31kJ.mol-1\n2.电池反应和电极反应电池反应一般是一氧化还原反应Zn+Cu2+(aq)←→Zn2+(aq)+Cu分为两个半反应:氧化半反应Zn→Zn2+(aq)+2e还原半反应Cu2+(aq)+2e→Cu电池负极(-)输出电子,即失电子的反应(-)Zn→Zn2+(aq)+2e电池正极(+)得到电子的反应(+)Cu2+(aq)+2e→Cu两个电极反应相加就是电池反应\n注意电极反应就是半反应,有关某个元素的得或失电子的反应;同样需要配平。MnO4-→Mn2+?MnO4-+5e→Mn2+MnO4-+8H++5e=Mn2++4H2O配平要注意:酸性介质H+-H2O,碱性介质用OH--H2O\n3、电池符号-图式表示电极表示铜电极:Cu|Cu2+锌电极:Zn|Zn2+图式表示:(-)Zn|Zn2+(c1)‖Cu2+(c2)|Cu(+)\n氧化态还原态均为溶液:Fe3++e-=Fe2+要加惰性电极,如Pt,C等:Pt|Fe2+,Fe3+有气体参与反应:2H++2e=H2也要加惰性电极:(Pt)H2|H+(c)几种不同电极的表示有沉淀参与反应:AgCl+e=Ag+Cl-Ag|AgCl,Cl-(c)\n整反应→两个半反应→图式表示←(电极反应)←Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O(+)Cr2O72-+14H++6e=2Cr3++7H2O(-)Fe2+-e=Fe3+(-)Pt|Fe2+,Fe3+‖Cr3+,Cr2O72-|Pt(+)(-)(C)I2|I-(c1)‖Fe2+(c2),Fe3+(c3)|C(+)+)Fe3++e=Fe2+-)2I-=I2+2e总反应:2Fe3++2I-=2Fe2++I2\n二、反应ΔrG与电池电动势关系Zn+Cu2+(aq)←→Zn2+(aq)+Cu标态下,ΔrGø=ΔfGøZn2+-ΔfGøCu2+298K时=-147.06-65.249=-212.31kJ.mol-1电功(非体积功)Wmax=-ΔG.\n-ΔrG=nFE电功W=I·V·t=电量•电压=n×6.023×1023×1.602×10-19×E=n×96485×E=nFE标态下反应:-ΔrGø=nFEøΔrG=ΔrGø+RT·lnQE=Eø-RT/nF·lnQE=Eø-0.0592/n·lgQ1.Nernst方程\nΔrGø=-nFEø同时,ΔrGø=-RT·lnKølnKø=2.反应平衡常数与电池标准电动势的关系\n§4.2电极电势Cu|Cu2+(cCu2+);Zn|Zn2+(cZn2+)①电极电势大小与参与电极反应的物质浓度有关②只能用相对值一、标准电极电势ø①参与反应的物质为标准浓度时的值②在规定øH2(p0)|H+(1.0mol.L-1)≡0下得到的。其他电极与标准氢电极组成电池得到的电动势就是该电极的电极电势值。\n1.标准氢电极2H+(1.0)+2e=H2(po)øH+/H2=0(V)与标准锌电极组成电池:(-)Zn|Zn2+‖H+|H2|Pt(+)Eo=øH+/H2-øZn/Zn2+0.7628=0-øZn/Zn2+øZn/Zn2+=-0.7628V\n2.其它常用的参比电极①甘汞电极:Hg2Cl2(s)+2e=2Hg(l)+2Cl-298K时:øHg2Cl2/Hg=0.2801V饱和(KCl溶液)甘汞电极:Hg2Cl2/Hg=0.2412V0.1MKCl:Hg2Cl2/Hg=0.3337V②氯化银电极:AgCl(s)+e=Ag(s)+Cl-标准态时:cCl-=1.0øAgCl/Ag=0.2223V\n二、电极电势Nernst方程E=Eø-RT/nF·lnQ298K时:E=Eø-0.0592/n·lgQ据此:E=正-负=(正o-负o)-0.0592/n·lgQ导出:如甘汞电极Hg2Cl2(s)+2e=2Hg(l)+2Cl-Hg2Cl2/Hg=øHg2Cl2/Hg+\nMnO4-+8H++5e-=Mn2++H2OO2+2H2O+4e=4OH-øO2/OH-=0.401VpO2=pocOH-=1.0O2+4H++4e=4H2OøO2/H2O=1.230VpO2=pocH+=1.0\nO2+2H2O+4e=4OH-øO2/OH-=0.401VpO2=pocOH-=1.0O2+4H++4e=4H2OøO2/H2O=?pO2=pocH+=1.0与O2/OH-相关øO2/H2O=O2/OH-=øO2/OH-+(cOH-=10-14)=0.401+=0.401+0.829=1.230\nAg++e=AgøAg/Ag+=0.799AgCl(s)+e=Ag(s)+Cl-øAgCl/Ag=?标准态时:cCl-=1.0→cAg+=KspAgCløAgCl/Ag=Ag+/Ag=øAg+/Ag+0.0592×lgcAg+=0.799+0.0592×lg1.8×10-10=0.2217V\nAg(NH3)2++e=Ag(s)+2NH3øAg(NH3)2+/Ag标准态时:cAg(NH3)2+=1.0cNH3=1.0cAg+=?cAg+=cAg(NH3)2+/K稳·c2NH3=1/K稳Ag++e=AgøAg/Ag+=0.799Ag+/Ag=øAg+/Ag+0.0592×lgcAg+\n§4.3电池电势和电极电势的应用一、氧化还原能力的大小顺序氧化型+ne=还原型ø值越大,电对氧化型氧化能力越强;同理ø值越小,电对还原能力越强。如:øMnO4-/Mn2+=1.51VøFe3+/Fe2+=0.77VøCu2+/Cu=0.34VøSn4+/Sn2+=0.154VøCl2/Cl-=1.36VøI2/I-=0.54VøZn2+/Zn=-0.762氧化能力:MnO4->Cl2>Fe3+>I2>Cu2+>Sn4+>Zn2+还原能力:Mn2+(还原剂)此时,E=正极-负极>0,这样ΔrG=-nFE<0如:MnO4-+Cl-→Mn2++Cl2标态时自发吗?∵øMnO4-/Mn2+=1.51>øCl2/Cl-=1.36∴反应可自发\n①标态下:2Fe3++2I-=2Fe2++I2自发否?∵øFe3+/Fe2+>øI2/I-∴Fe3+可以氧化I-。已知:øI2/I-=0.54V,øFe3+/Fe2+=0.77V②在上述体系中加入KCN,使cCN-=1.0K稳[Fe(CN)6]3-=1.0×1042,K稳[Fe(CN)6]4-=1.0×1035此时反应能否自发?此时cFe3+=cFe2+=1/K稳II\n∴氧化剂的Fe3+/Fe2+=øFe3+/Fe2++0.0592lg=0.77+0.0592lg=0.77+0.0592×(-7)=0.36V还原剂I2/I-=øI2/I-=0.54>Fe3+/Fe2+∴此时Fe3+不能氧化I-K稳[Fe(CN)6]3-=1.0×1042,K稳[Fe(CN)6]4-=1.0×1035\n三、反应程度—Kø的求法ΔrGø=-RT·lnKøΔrGø=-nFEøRT·lnKø=nFEø→2.303RT·lgKø=nFEø298K时lgKø=公式\n例:求反应2Fe3++Cu=2Fe2++Cu2+平衡常数解:根据反应设计电池如下:(-)Cu︱Cu2+‖Fe3+,Fe2+︱Pt(+)Eø=ø正极-ø负极=øFe3+/Fe2+-øCu2+/Cu=0.771-0.341=0.430VlgKø=nEø/0.0592=2×0.430/0.0592=14.55Kø=3.6×1014\n例:
求溶度积Ksp如:AgCl←→Ag++Cl-解:据反应设计电池(-)Ag︱Ag+‖Cl-︱AgCl︱Ag(+)Eø=ø正极-ø负极=øAgCl/Ag-øAg+/Ag=0.222-0.799=-0.577㏒Kø=nEø/0.0591=-9.78Ksp=Kø=1.7×10-10\n四、元素电位图ACu2+0.152Cu+0.521Cu∣0.34∣BCu(OH)2-0.08Cu2O-0.358CuAMnO4-_0.56_MnO42-_2.26_MnO2_0.95_Mn3+_1.51_Mn2+-1.18_M∣(不稳定)(不稳定)∣∣____________1.51________________________∣\n§4.4化学电源一、一次电池1.锌锰电池(-)Zn︱ZnCl2,NH4Cl︱Mn2O3︱MnO2︱Ag(+)2.锌汞电池(-)Zn︱ZnO,KOH︱HgO︱Hg︱C(+)\n二、二次电池1.铅蓄电池(-)Pb︱PbSO4,H2SO4(1.25~1.30g·cm-3)︱PbO2(+)2.铬镍电池(-)Cd︱Cd(OH)2,KOH(1.19~1.21g·cm-3),Ni(OH)2︱NiO(OH)︱C(+)三、燃料电池—连续的电池(-)C︱H2(p)|KOH(aq)︱O2︱C(+)电池反应:2H2(g)+O2(g)=2H2O(l)\n§4.5电解电解电镀§4.6金属的腐蚀及防护腐蚀阴极保护法\n