- 713.50 KB
- 2022-08-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
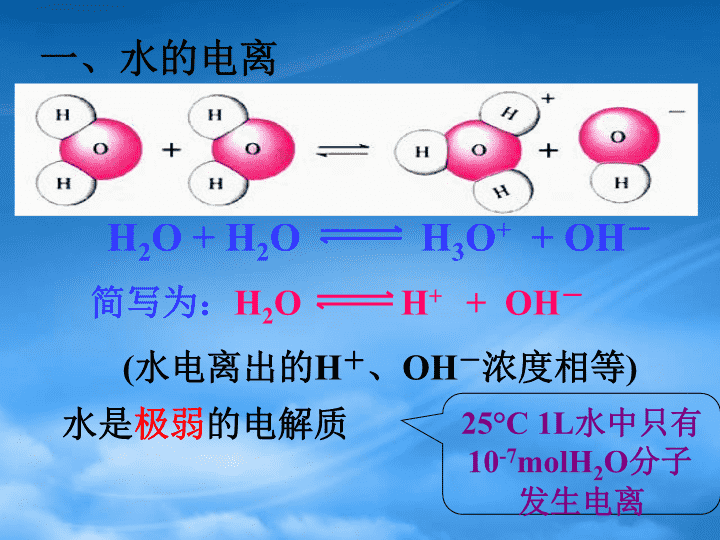
第1节水溶液第3章物质在水溶液中的行为\nH2O+H2OH3O++OH-简写为:H2OH++OH-(水电离出的H+、OH-浓度相等)一、水的电离水是极弱的电解质25°C1L水中只有10-7molH2O分子发生电离\nK=[H+]×[OH-][H2O]K.=[H+].[OH-][H2O]Kw=[H+].[OH-]其中常数Kw,称为水的离子积常数,简称为水的离子积。H2OH++OH-\nKW=[H+]·[OH-]=1×10-14mol2·L-21.水的离子积常数25℃时(常温)如果温度变化Kw会如何变化?为什么?实验测得:在25℃,水电离出来的[H+]=[OH-]=10-7mol·L-15.5x10-132.5x10-137.3x10-141.0x10-14Kw100℃80℃55℃25℃温度\n△H>0(1)升高温度,促进水的电离,Kw增大[H+]=[OH-]升高温度:平衡向移动,[H+],[OH-],Kw右增大增大增大注意:水的离子积只随温度的改变而改变2.影响水的电离平衡的因素H2OH++OH-Kw适用于一定温度下任何稀的水溶液\n对常温下的纯水进行下列操作:加NaOH加HCl加热Kw[H+]、[OH-]浓度大小关系[OH-][H+]水的电离平衡移动方向酸碱性条件(2)加入酸或碱,抑制水的电离,Kw不变。中性正向增大增大[H+]=[OH-]增大酸性逆向增大减小[H+]>[OH-]不变碱性逆向减小增大[H+]<[OH-]不变H2OH++OH-\n水的电离水的离子积:影响因素KW=[H+]·[OH-](25℃时,KW=1.0×10-14)温度:加酸:加碱:T↑,KW↑抑制水的电离,KW不变抑制水的电离,KW不变3、无论是酸溶液还是碱溶液中都同时存在H+和OH-!注意:1、在任何水溶液中,均存在水的电离平衡,Kw=[H+]·[OH-]均成立。(25℃时Kw=10-14)2、水电离出的H+、OH-永远相等H2OH++OH-\n水的离子积常数Kw=c(H+).c(OH-)对水电离平衡的影响c(H+)mol/Lc(OH-)mol/Lc(H+)与c(OH-)比较溶液酸碱性纯水无=10-7=10-7c(H+)=c(OH-)中性HCl左移>10-7<10-7c(H+)>c(OH-)酸性NaOH左移<10-7>10-7c(H+)1mol/L的溶液的酸碱性不用pH表示。三、溶液的酸碱性与PH\npH=-lgc(H+)\npH值与溶液酸碱性的关系?pH01234567891011121314酸性增强中性碱性增强25℃回忆初中所学常温下pH大小与溶液酸碱性的关系\n0100110-1210—2310—3410—4510—5610—6710—7810—8910—91010—101110—111210—121310—131410—14中性pHC(H+)C(OH-)10—1410—1310—1210—1110—1010—910—810—710—610—510—410—310-210-1100酸性碱性增强增强0100110-1210—2310—3410—4510—5610—6710—7810—8910—91010—101110—111210—121310—131410—14c(H+)越大pH越小酸性越强,碱性越弱结合pH与c(H+)的关系,思考溶液酸碱性与pH的关系\n中性溶液酸性溶液碱性溶液c(H+)=c(OH-)=1×10-7mol/Lc(H+)>c(OH-)>1×10-7mol/Lc(H+)<c(OH-)<1×10-7mol/LpH=7pH<7pH>7思考:pH为7的溶液是否一定是中性溶液?(25℃)2.溶液的酸碱性与pH的关系\n任意温度25℃酸碱性与PH的关系酸性中性碱性c(H+)>c(OH-)c(H+)=c(OH-)c(H+)<c(OH-)PH<7PH=7PH>7c(H+)越大PH越小,酸性越强c(OH-)越大PH越大,碱性越强不变减小2.溶液的酸碱性与pH的关系\n1.甲溶液的pH=3,乙溶液的pH=1,则甲溶液中[H+]与乙溶液中[H+]之比为A.100B.1/100C.3D.1/3pH相差a,[H+]相差10aB练习:2.pH=3的盐酸pH增大1,c(H+)差多少倍?盐酸浓度差多少倍?c(H+)相差10倍;物质的量浓度强酸相差10倍PH=3的醋酸pH增大1,c(H+)差多少倍?醋酸浓度差多少倍?c(H+])相差10倍;物质的量浓度弱酸相差>10倍\n3、有关溶液pH的计算(1)单一溶液的计算:pH=-lgc(H+)酸性:求c(H+)→pH碱性:求c(OH-)→c(H+)→pHpH+pOH=14c(H+)·c(OH-)=1×10-14\n(2)强酸、强碱的稀释:例1.pH=3的盐酸①加水稀释到原来的10倍,pH=________②加水到原来的103倍,pH=___________,③加水到原来的104倍pH=_______,④加水到原来的106倍,pH=________例2.①pH=10的NaOH溶液加水稀释到原来的10倍,则溶液的pH=___________②加水稀释到原来的102倍,则溶液的pH=______________③加水稀释到原来的103倍,则溶液的pH=_______________④加水稀释到原来的105倍,则溶液的pH=_______________关键:抓住氢离子进行计算!关键:抓住氢氧根离子离子进行计算!\n结论:强酸(碱)每稀释10倍,pH值向7靠拢一个单位。强酸溶液每稀释10倍,PH增大一个单位。酸、碱溶液无限稀释时,pH均无限接近于7(均要考虑水的电离)。强碱溶液每稀释10倍,PH减小一个单位。\n(3)弱酸、弱碱的稀释结论:弱酸(碱)每稀释10倍,pH值向7靠拢不到一个单位例3.pH=3醋酸加水稀释到原来10倍,溶液的pH值范围_______________________pH=12氨水加水稀释到原来10倍,溶液的pH值范围________________________弱酸、弱碱稀释后溶液pH的变化比强酸、强碱小。例4.有两瓶pH=2的溶液,一瓶是强酸,一瓶是弱酸。现只有石蕊试液、酚酞试液、pH试纸和蒸馏水,而没有其它试剂,简述如何用最简单的实验方法来判断那瓶是强酸?\n(4)强酸(碱)溶液混合\n例6.pH=10和pH=8的两种NaOH溶液等体积混合,求混合溶液的pH值。例5.pH=4和pH=5的两种盐酸溶液等体积混合,求混合溶液的pH值结论:两种强酸溶液等体积混合,溶液的pH值等于浓溶液的pH加0.3结论:两种强碱溶液等体积混合,溶液的pH值等于浓溶液的pH减0.3\n例7.0.1LpH=2盐酸和0.1LpH=11的NaOH溶液相混合,求混合后溶液的pH值例8.pH=2盐酸和pH=12的Ba(OH)2溶液等体积相混合,求混合后溶液的pH值。(5)强酸、强碱溶液混合方法:先反应---按过量的计算,若酸过量,求c(H+),再算pH值。若碱过量,求c(OH-),求c(H+),再算pH值\n4.pH的测定方法酸碱指示剂的颜色变化是在一定的pH值范围内发生的。我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。pH123.14.4567891011121314甲基橙红色橙色黄色石蕊红色紫色蓝色酚酞无色浅红色红色(1)酸碱指示剂(定性测量范围)\n(2)pH试纸(定量粗略测量)pH01234567891011121314强酸性弱酸性中性弱碱性强碱性红色橙红色橙黄色浅草绿色深草绿色蓝色深蓝色黄色蓝紫色(整数位)\n讨论:pH试纸的使用能否直接把pH试纸伸到待测液中?是否要先湿润pH试纸后,再将待测液滴到pH试纸上?能否用广泛pH试纸测出pH=7.1来?标准比色卡中的数据都是整数如用湿润的pH试纸检验待测液,对该溶液pH值的测定:A、一定有影响B、偏大C、偏小D、不确定使用方法:直接把待测液滴在干燥的pH试纸上,跟标准比色卡相对比注意:①不能用水润湿②要放在玻璃片(或表面皿)上③用玻璃棒蘸待测液滴于试纸上\n(3)pH计(定量精确测量)(小数位)\n酸碱中和滴定属性:化学分析中的定量分析特点:简便、快捷、准确应用:广泛用于科研和工农业生产定义:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。\n对于一元酸和一元碱发生的中和反应:c酸c碱V酸V碱H++OH-=H2O酸碱中和滴定原理C酸V酸=C碱V碱C未知V未知=C标准V标准\n酸碱中和滴定的关键C标准V标准=C待测V待测(一元酸碱中和)酸碱滴定时一般选用酚酞和甲基橙作为指示剂,确定酸碱恰好完全反应。a.准确测定V标准和V待测溶液的体积—滴定管b.如何判断中和反应是否恰好进行完全(滴定终点的确定)—酸碱指示剂\n酸碱中和滴定所需的仪器:酸式滴定管碱式滴定管铁架台滴定管夹锥形瓶烧杯操作步骤:洗涤→检漏→蒸馏水洗→溶液润洗→装液→排气泡→调整液面并记录→放出待测液→加入指示剂→滴定→记录→计算。\n左手右手视线与凹液面水平相切滴加速度先快后慢眼睛注视瓶内颜色变化半分钟颜色不变滴定管保持垂直\n一次滴定二次滴定三次滴定终点读数起点读数用量差值V标NaOHV待HClC待HClC待HCl平均CHCl=——————CNaOH.VNaOHVHCl酸碱中和滴定数据处理和计算:\n中和滴定实验中的误差因素分析:一、仪器润洗不当⒈盛标准液的滴定管用蒸馏水洗后未用标准液润洗;⒉盛待测液的滴定管或移液管用蒸馏水洗后未用待测液润洗;⒊锥形瓶用蒸馏水洗后再用待测液润洗;二、读数方法有误⒈滴定前仰视,滴定后俯视;⒉滴定前俯视,滴定后仰视;⒊天平或量筒的使用读数方法错误;三、操作出现问题⒈盛标准液的滴定管漏液;⒉盛待测液的滴定管滴前尖嘴部分有气泡,终了无气泡(或前无后有);⒊振荡锥形瓶时,不小心有待测液溅出;⒋滴定过程中,将标准液滴到锥形瓶外;⒌快速滴定后立即读数;偏大偏小偏大偏大偏小偏大偏小偏小\n四、指示剂选择欠妥⒈用强酸滴定弱碱,指示剂用酚酞;(正确选择:甲基橙)⒉用强碱滴定弱酸,指示剂选用甲基橙;(正确选择:酚酞)(①强酸滴定弱碱,必选甲基橙;②强碱滴定弱酸,必选酚酞;③两强滴定,原则上甲基橙和酚酞皆可选用;④中和滴定肯定不用石蕊。)五、终点判断不准确⒈如滴定管的尖嘴部分有半滴或一滴标准液未滴下;六、样品中含有杂质⒈用盐酸滴定含Na2O的NaOH样品;⒉用含Na2CO3的NaOH标准液滴定盐酸;七、指示剂的变色范围指示剂酸中颜色PH变色范围碱中颜色甲基橙红色PH<3.13.1→4.4橙色黄色PH>6.2酚酞无色PH<8.28.2→10.0粉红色红色PH>10石蕊红色PH<5.05.0→8.0紫色蓝色PH>10偏大\n俯视图仰视图滴定管的俯视和仰视正确视线仰视视线正确读数仰视读数读数偏大正确视线俯视视线正确读数俯视读数读数偏小0\n先偏大后偏小先仰后俯V=V(后)-V(前),偏小实际读数正确读数先俯后仰先偏小后偏大V=V(后)-V(前),偏大实际读数正确读数滴定管的俯视和仰视\n滴定过程中溶液的pH变化:例:用0.100mol/LNaOH溶液滴定20.00mL0.100mol/L盐酸NaOH(ml)0.0018.0019.6819.9820.0020.0220.2022.0023.00溶液pH1.02.33.34.37.09.710.711.712.5问题2:滴定终点时多半滴和少半滴溶液性质发生怎样改变?PH发生怎样改变?问题1:滴定终点消耗碱多少?pH等于多少?问题3:以NaOH加入量为横坐标,以pH值变化为纵坐标,绘制中和滴定曲线引出pH值突变概念及范围\nPH1210864210203040突变范围反应终点加入NaOH(ml)中和滴定曲线酸碱指示剂的颜色在此pH值突跃范围发生明显的改变,则就能以极小的误差指示出滴定终点的到达。\n