- 2.00 MB
- 2022-08-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
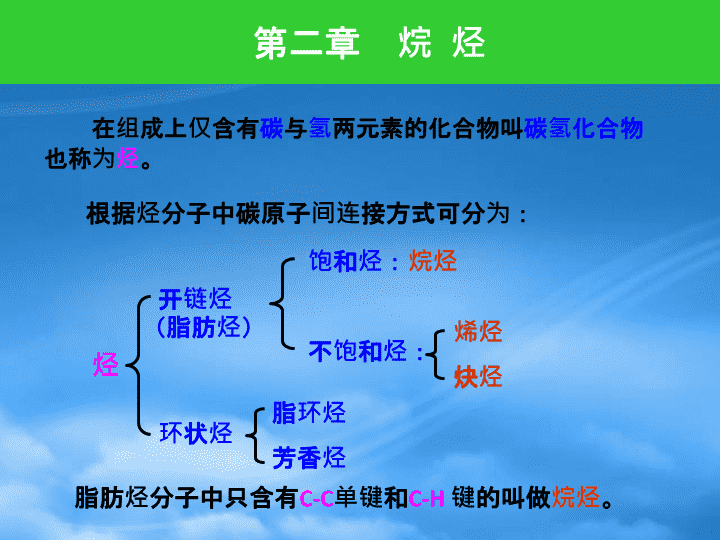
烷烃1烷烃的同系列和同分异构体现象2烷烃的命名法3烷烃的分子结构4烷烃的性质5卤代反应历程6烷烃的来源\n在组成上仅含有碳与氢两元素的化合物叫碳氢化合物也称为烃。脂肪烃分子中只含有C-C单键和C-H键的叫做烷烃。第二章烷烃根据烃分子中碳原子间连接方式可分为:烃开链烃饱和烃:烷烃不饱和烃:烯烃炔烃脂环烃芳香烃环状烃(脂肪烃)\n一、同系列在烷烃的一系列化合物中,其分子组成中所含的碳原子和氢原子在数量上存在着一定的关系,即每增加一个C原子,就相应地增加二个H原子。可用一个式子代表:HCHHHn()烷烃通式:CnH2n+2这些结构上相似而组成上相邻的两个烷烃的组成都是相差CH2。CH2叫做同系列差。1烷烃的同系列和同分异构体现象H–C–HH–C–C–HH–C–C–C–HH–C–C–C–C–HHHHHHHHHHHHHHHHHHHHH甲烷乙烷丙烷丁烷CH4C2H6C3H8C4H10\n具有同一个通式,组成上相差只是CH2或其整数倍的一系列化合物叫做同系列。同系物具有相似的化学性质,其物理性质(例如沸点、熔点、相对密度、溶解度等)一般是随着相对分子质量的改变而呈现规律性的变化。二、同分异构现象分子式相同的结构不同化合物叫做同分异构体(简称异构体)。这种现象叫做同分异构现象。从丁烷开始出现同分异构体H–C–C–C–HHHHHHHH–C–C–C–C–HHHHHHHHHH–C–C–C–HHHHHHH-C-HH链端被-CH3取代中间被-CH3取代HH\n异构体数目如戊烷C5H123己烷C6H145壬烷C9H2035一个已知分子式的烷烃究竟有多少个异构体?利用逐步缩短碳链的方法,推导出异构体的数目及其构造式。基本步骤:(以己烷C6H14为例)同分异构现象是有机化合物中存在的普遍现象。随着化合物分子中所含碳原子数目的增加,同分异构体的数目也越多。\n基本步骤:(以己烷C6H14为例)1.写出己烷的最长直链式:2.写出比①式少一个碳原子的直链式:3.再写出比①式少两个碳原子的直链式:C-C-C-C-C-C①C-C-C-C-CC-C-C-C-CC-C-C-C-CCCC②③④⑤⑥⑦⑧⑨⑩C-C-C-CC-C-C-CC-C-C-CC-C-C-CC-C-C-CC-C-C-CCCCCCCCCCCCC\n化合物的结构式不仅能代表化合物分子的组成,而且能反映出分子中的成键顺序。因此,常用结构式来表示有机化合物。CH3C(CH3)2CH2CH3或(CH3)3CCH2CH3结构简式如:CH3-C-CH2-CH3构造式CH3CH3CH3-CH2-CH2-CH2-CH2-CH3CH3-CH-CH2-CH2-CH3CH3CH3-CH-CH-CH3CH3CH3CH3-CH2-CH-CH2-CH3CH3CH3-C-CH2-CH3CH3CH3分子式是在其碳干上配上相应的H原子。\n与伯、仲、叔碳原子相连的氢原子分别称为伯、仲、叔氢原子。不同类型的氢原子在同一反应中的反应性能是有一定差别。如:CH3—C—CH2—CH—CH3CH3CH3CH3只连有四个碳原子的称为季碳原子,常以4°表示(四级碳原子)。只连有一个碳原子的称为伯碳原子,常以1°表示(一级碳原子);只连有二个碳原子的称为仲碳原子,常以2°表示(二级碳原子);只连有三个碳原子的称为叔碳原子,常以3°表示(三级碳原子);1°1°1°1°1°2°3°4°三、伯、仲、叔和季碳原子碳链中的碳原子按照它们所连结的碳原子数目可分为四类:\n一、普通命名法“天干”——甲、乙、丙、丁、戊、己、庚、辛、壬、癸。十一碳以上用汉字数字表示:一般按烷烃所含碳原子数目来命名,碳原子在十以内用“天干”表示,称“某烷”。如:C6H14C8H18C12H26己烷辛烷十二烷区别异构体用“正”、“异”、“新”。2烷烃的命名法\n异戊烷如:CH3-CH2-CH2-CH2-CH3CH3-CH-CH2-CH3CH3-C-CH3CH3CH3CH3正戊烷新戊烷将直链烷烃——叫“正”具有结构,即端位第二个碳原子有2个CH3——叫“异”CH3-CH-CH3具有结构,即端位第二个碳原子有3个CH3——叫“新”CH3-C-CH3CH3\n例题:用普通命名法命名下列化合物\n二、系统命名法系统命名法是采用国际纯化学与应用化学联合会(简称IUPAC)的命名原则,结合我国文字的特点,制定了中文系统命名法(1960年)。1.烷基烷烃分子中去掉一个氢原子后,剩下的原子团叫烷基。烷基是一价基,通式为CnH2n+1,常用R-代表烷基。烷基的名称由相应的烷烃而得。\n例如:异丙基-CH2CH2CH3丙基CH3CH3-CH2CH3乙基CH3CH2CH3CH3-CH-CH3CH4-CH3甲基-H-H中间碳-H链端碳-H\n缩写符号名称构造式缩写符号名称构造式CH3-CH-CH3CH3-CH2-CH-CH3-CH-CH2CH3CH3-C-CH3CH3CH3-CH3-CH2CH3-CH2CH2CH3-CH2(CH2)2CH3甲基乙基正丙基异丙基正丁基异丁基-CH2CH2CHCH3CH3-CH2-C-CH3CH3CH3-C-CH2CH3CH3CH3仲丁基叔丁基叔戊基新戊基异戊基MeEtn-Pri-Prn-Bui-Bus-But-Bui-Pentt-Pentneo-Pent常见的烷基名称\n2.直链烷烃的命名与普通命名法基本相同,但不用“正”字。具有1~10个碳原子数的烷烃采用我国古代记数的“天干”。10个碳以上的烷烃则用汉字数字表明。如:CH3CH2CH2CH2CH3正戊烷(普通命名法)戊烷(系统命名法)3、支链烷烃的命名把它看作是直链烷烃取代衍生物如:CH3-CH2-CH-CH2-CH2-CH3CH33-甲基己烷(看作是己烷的衍生物)123456取代基位置位置与名称用短线连接母体名称取代基名称\n①选取主链——选择最长的碳链为主链。支链当作取代基。②编号——(1)从靠近支链的一端开始,编号时应尽可能使取代基具有最低编号。步骤如:CH3-CH2-CH2-CH-CH3CH2-CH3CH3-CHCH2CH-CH2CH3CH2CH3CH2CH2CH3CH3CH2CHCH2CH-CH2CH2CH3CH3CH2CH3(如上例)2165432167834512345678\n(2)当几种可能的编号方向时,应当选定使取代基具有“最低系列”的那种编号(即顺次逐项比较各系列的不同位次,最先遇到位次最小者定为最低系列)。(3)两端一样长时,从小取代基一端开始编号。CH3-CH—CH-CH2-CH2-C-CH3CH3CH3CH3CH3CH3CHCH2CH2CH2CH2CH—CHCH2CH3CH3CH3CH3CH3CH2CHCH2CHCH2CH3CH3CH2CH3从左到右:2,3,6,6从右到左:2,2,5,6123456776543211234567123456789102,7,8-三甲基癸烷(不叫3,4,9-三甲基癸烷)3-甲基-5-乙基庚烷\n(4)有多种等长的最长碳链可供选择时,应选择取代基最多的碳链为主链。CH3-CH2-CH—CH-CH2-CH3CH3CH—CH3CH3—CHCH3CH3CH2CH2-CH—CH-CH-CH3CH3CHCH3CH3CH3CH243215673214562,5-二甲基-3,4-二乙基己烷2,3,5-三甲基-4-丙基庚烷不是2,3-二甲基-4-仲丁基庚烷\n③“先小后大,同基合并”(如前例)烃基大小的次序(按“对映异构中的次序规则”决定):甲基<乙基<丙基<丁基<戊基<己基<异戊基<异丁基<异丙基CH3-CH—C-CH2-CH2-CH3CH3CH2CH3CH32,3-二甲基-3-乙基己烷123456——有不同取代基时,把小取代基名称写在前面,大取代基写在后面。相同取代基合并起来,取代基数目用二、三、……等表示。\n小结:命名规则:(1)选主链:最长碳链。取代基最多;(2)编号:a:从离支链最近的一端开始编号;b:“位置和最小”--“最低系列”规则(3)写出名称:a:支链烷基名称和位置写在前;b:小基团在前,大基团在后(次序规则);c:相同基团合并,以汉字二、三、四等标明数目。注意:(1).数字与汉字间用“—”隔开,数字间用“,”分开;(2).“某基”和“某烷”之间不能用“—”隔开;(3).汉字二、三、四等不能用阿拉伯数字2,3,4等替换\n课堂习题:1.对下列烷烃进行命名3,3,5-三甲基庚烷2,4-二甲基-4-乙基已烷2.指出下列两化合物的命名不正确的地方并重新命名2,4-二甲基-6-乙基庚烷4-乙基-5,5-二甲基戊烷\n4-丙基-6-异丙基壬烷课堂练习\n一、碳原子的SP3杂化轨道、σ键1.碳原子的sp3杂化轨道碳原子在基态时电子构型:1S2、2S2、2p2键角:109.5°↑↑↑↑杂化SP3↑↑↑↑跃迁2S2Py2Px2PZ↑↓↑↑2S2P↑↓1SE3烷烃的分子结构SP3杂化轨道含1/4S轨道3/4P轨道1个SP3杂化轨道形状4个SP3杂化轨道\n2、甲烷的分子模型虚线——表示伸向纸平面后方实线——表示在纸平面前上楔线——表示伸向纸平面前方甲烷模型凯库勒模型斯陶特模型H—C—HHH甲烷凯库勒模型甲烷的立体构造式(透视式)甲烷斯特模型\n乙烷分子结构虽然是四面体,但不是正四面体,键角也不是109.5°而是接近109.5°。甲烷的形成示意图σ键乙烷的结构σ键3.成键方式\n二、烷烃的构象构象——围绕碳碳σ键旋转而使分子中原子或基团在空间的不同排列方式。纽曼投影式重叠式交叉式锯架式(透视式)HHHHHHHHHHHHHHHHHHHHHHHH乙烷分子中两个极端的空间形象:\n1.乙烷的构象\n2.丁烷的构象全重叠式CH3H3CHHHH邻位交叉式HHHHCH3CH3转60°部分重叠式CH3H3CHHHH转60°对位交叉式HHHHCH3CH3转60°\n2.丁烷的构象\n一、物理性质烷烃是无色物质,具有一定的气味。直链烷烃的物理性质,例如熔点、沸点、相对密度等,随着分子中碳原子数(或相对分子质量)的增大,而呈规律性的变化。(表2-1)1.物理状态C1~C4——气态C5~C16——液态C17以上——固态2.沸点(b.P.)4烷烃的性质②同数碳烷烃,直链比支链沸点高。①直链烷烃,碳数则沸点。\n3、熔点(m.P.)一般含碳原子数相同的烷烃的熔点是随着分子的对称才增加而升高的,分子越对称,它们在晶格中排列越紧密,分子之间的范德华作用力也越强,故熔点越高。①碳数,则熔点。②偶数碳链比奇数碳链稍高。③同数碳异构体:新>正>异。\n5.水溶性烷烃几乎不溶于水,但易溶于有机溶剂。结构相似或极性大小相近的化合物可以彼此互溶,这就是“相似相溶”的经验溶解规律。4.相对密度(D)碳数,则相对密度,最后近于0.78相对密度与分子引力有关,分子间引力增大,分子间的距离相应减少,故相对密度就增大。对称性逐渐增高熔点逐渐增大新戊烷正戊烷异戊烷CH3-C-CH3CH3CH3CH3-CH2-CH2-CH2-CH3CH3CH3-CH-CH2-CH3mP:-17℃-130℃-160℃\n烷烃的稳定性不是绝对的,在一定条件下(如光、高温或催化剂的影响下)也可以发生某些反应。二、化学性质在常温下烷烃的化学性质很不活泼,与强酸、强碱、强氧化剂和还原剂等都不起作用。烷烃化学性质比较稳定的主要原因:(C-C键能为345.6KJ/mol;C-H键能为415.3KJ/mol)●C-C及C-Hσ键较牢固●烷烃为非极性分子,一般条件下试剂不易进攻。\n②部分氧化(选择性氧化)1.氧化反应①燃烧CH4+2O2CO2+2H2O+891.2kJ/mol点燃CnH·2n+2+O2nCO2+(n-1)H2O+热能3n+12点燃CH3CH2-CH2CH3+O22CH3COOH+H2O乙酸钴52150~225℃~5Mpa~50%R-CH2-CH2-R/R-COOH+R/-COOH+其它酸MnO2107~110℃高级脂肪酸R—R/R-OH+R/-OH催化剂\n2.裂化反应烷烃在高温下分子中的C-C键与C-H键间易发生断裂而生成分子量较小的烷烃与烯烃,这称为烷烃的裂化。这个反应在石油化工生产中极为重要。裂化反应热裂化——指在500~700℃高温、加压下进行。催化裂化——在400~500℃常压催化下进行。CH3-CH=CH2+H2CH2=CH2+CH4CH3—CH—CH2HH460℃CH3-CH2-CH2-CH3CH2=CH2+CH3-CH3CH3-CH=CH2+CH4CH3-CH2-CH=CH2+H2500℃\n3.卤代反应烷烃分子中的氢原子被卤素所取代的反应称为卤代反应。烷烃与卤素在室温和黑暗中并不发生反应,但在强烈日光照射下,则发生猛烈反应。在漫射光、加热或某些催化剂作用下,能够进行可以控制的卤代反应。CH4+2Cl24HCl↑+C强日光一氯甲烷CH4+Cl2CH3Cl+HClhν或250℃二氯甲烷CH3Cl+Cl2CH2Cl2+HClhν或250℃三氯甲烷CH2Cl2+Cl2CHCl3+HClhν或250℃四氯化碳CHCl3+Cl2CCl4+HClhν或250℃\n其它烷烃的卤代碳链较长的烷烃进行氯化时,可以取代不同的氢原子得到不同的氯化烃。丙烷1-氯丙烷2-氯丙烷CH3-CH2-CH3+Cl2CH3CH2CH2Cl+CH3-CH-CH3Clhν25℃43%57%氯代叔丁烷氯代异丁烷CH3-C-H+Cl2CH3-C-Cl+CH3-C-HCH3CH3hν25℃CH3CH3CH3CH2Cl异丁烷36%64%伯氢叔氢=36/164/915≈仲氢伯氢=57/243/614≈在室温下,叔、仲、伯氢原子被氯原子夺取的相对速率为5:4:1。反应活性:3°>2°>1°HHH\n在溴代反应中,烷烃分子中的各种H的活性次序也是3°>2°>1°,但是它们的反应活性相差很大。HHH烷烃的溴代反应的选择性比氯代要好。反应活性:3°:2°:1°=1600:82:1HHH丙烷CH3-CH2-CH3+Br2CH3CH2CH2Br+CH3-CH-CH3Brhν127℃3%97%CH3-C-H+Br2CH3-C-Br+CH3-C-HCH3CH3hν127℃CH3CH3CH3CH2Br异丁烷99%微量\n游离能——1mol烷烃被夺取1个氢原子后形成游离基说所需要的能量。三、游离基的稳定性键离解能(KJ/mol)乙基游离基丙基游离基甲基游离基异丙基游离基叔丁基游离基CH3-H·CH3+H·435.1CH3CH3·CH2CH3+H·410CH3CH2CH3·CH2CH2CH3+H·410CH3CHCH3CH3CHCH3+H·397.5·H(CH3)3C-H(CH3)3C·+H·380.7形成各种类型的游离基所需的能量按如下次序降低:CH3>1°>2°>3°\n一般讲,越稳定的游离基越容易生成,其反应速率也越快,这是一个非常有用的通则。可以认为,在许多有游离基生成的反应中,游离基的稳定性支配着反应的取向和活性。形成游离基的能量越小,这种游离基越稳定,故游离基的稳定性次序为:3°>2°>1°>CH3·R·R·R·游离基的结构:碳原子为SP2杂化,为平面型。甲基游离基(CH3·)CHHH·\n一、烷烃的天然来源烷烃的天然来源主要是石油和天然气。1.天然气2.石油——主要是烃类的混合物。从地下开采出来的石油一般是深褐色液体,叫原油。6烷烃的来源干性天然气——主要成分是甲烷。湿性天然气——主要成分除甲烷外还含有乙烷、丙烷、丁烷等。石油经炼制可产生汽油、煤油、柴油等轻质燃料,以及润滑油、石油沥青等产品。\n1.武慈(Wurtz)反应利用卤代烷和金属钠以制得烷烃的反应——称武慈反应。范围:X=Cl、Br、IR=一般要求为伯烃基反应物R-X要相同,产物为碳链总长一倍的对称化合物。如果烷基不相同的两种卤代烷,反应得到三种烷烃混合物。二、烷烃的制备CH3Cl+CH3CH2ClNaCH3-CH3CH3CH2-CH3CH3CH2-CH2CH32CH3CH2CH2Br+NaCH3CH2CH2CH2CH2CH3+NaBrR-X+R-X+2NaR-R+2NaX\n二烷基铜锂的制备范围:X=Cl、Br、IR=伯、仲、叔、乙烯型等烃基R/=一般为伯烃基乙醚二烷基铜锂R2CuLi+R/XR-R/+RCu+LiXRX+LiRLiR2CuLi烷基锂CuI乙醚如:试合成CH3CH2-CH-CH2CH2CH3CH32.科瑞(Corey)-郝思(House)反应(铜锂试剂合成法)\n3.柯尔贝(Koble)电解法将高浓度的羧酸钠或钾盐溶液进行电解而制得碳数增加一倍的烷烃。4.烯烃的氢化在某些金属催化剂下,烯烃和氢反应可以生成烷烃。正极负极2R-COONa+2H2OR-R+2CO2↑+2NaOH+H2↑电解R-CH=CH2R-CH2-CH3H2/Pt该法较为适用R为C6以上的烷烃的制备。\n甲烷是天然气、油田气、沼气等的重要成分。埋藏在水底或地下的生物尸体,在腐烂和分解时所产生的气体都含有大量的甲烷。天然气是多种气体的混合物,主要是甲烷,占80~90%。其它的还有少量乙烷、丙烷、丁烷、戊烷等甲烷的实验室制法:CH3COONa+NaOH(CaO)CH4↑+Na2CO3△碱石灰三、甲烷\n