- 173.00 KB
- 2022-08-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
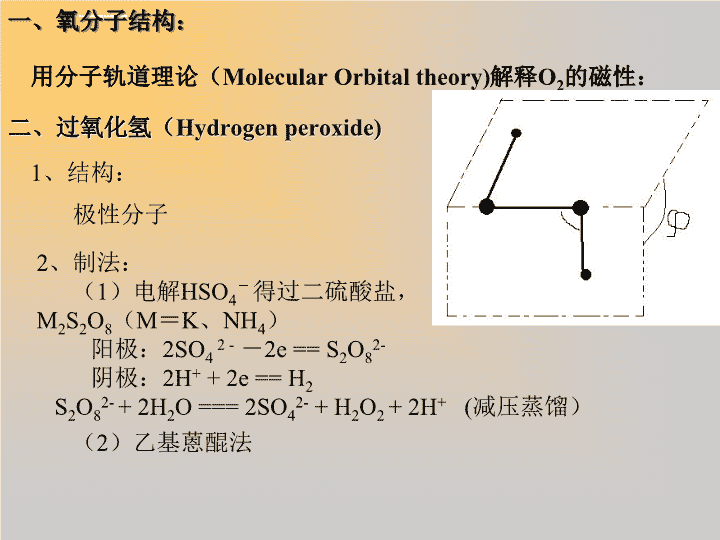
高中化学竞赛辅导元素化合物——氧族元素\n一、氧分子结构:用分子轨道理论(MolecularOrbitaltheory)解释O2的磁性:二、过氧化氢(Hydrogenperoxide)1、结构:极性分子2、制法:(1)电解HSO4-得过二硫酸盐,M2S2O8(M=K、NH4)阳极:2SO42--2e==S2O82-阴极:2H++2e==H2S2O82-+2H2O===2SO42-+H2O2+2H+(减压蒸馏)(2)乙基蒽醌法\nH2O2保存:阴凉、加阻化剂锡酸钠Na2Sn(OH)63、性质:酸性:K1=1.55×10-12K2~=10-25(1)分解:催化剂(如:MnO2)MnO2+H2O2=Mn2++O2+H2OH2O2+Mn2+==MnO2+H2O总反应:2H2O2=======2H2O+O2MnO2(低温蒸馏)\n(2)氧化还原性:作为氧化剂的突出优点:氧化性强、不引入杂质。PbS+4H2O2=PbSO4+4H2O(将油画还原颜色)测定H2O2的定量方法:用KMnO4溶液滴定:2MnO4-+5H2O2+6H+==2Mn2++5O2+8H2O鉴定H2O2的方法:Cr2O72-+4H2O2+2H+==2CrO5+5H2O用乙醚萃取CrO5,显蓝紫色。(3)中和(取代)反应:NaOOH(一取代)、Na2O2(二取代)(4)加合反应:(通水合物)2Na2CO3+3H2O2==2Na2CO3•3H2O2\n三、臭氧(Ozone)1、结构:(唯一单质极性分子)(转移电子4/3e)2、强氧化性:鉴定或测定O3含量:O3+2I-+H2O==O2+I2+2OH-I2+2S2O32-===2I-+S4O62-\n四、硫1、存在:硫化物(ZnS、PbS、FeS2、Sb2S3)硫酸盐(CaSO4、CrSO4、BaSO4)煤、蛋白质2、同素异形体:(Allotrope)3、硫化物H2SNaSHNa2SAs2S3As2S5Na2S2H2ONaOHNa2OAs2O3As2O5Na2O2碱性碱性两性、还原性酸性碱性、氧化性思考:Na2S、硫化铵为什么要保存在棕色瓶中?2S2-+O2+2H2O==2S+4OH-Na2SAl2S3FeSZnSCuSHgS\n4、多硫化物:S2-+xS=Sx+12-S8+S2-=S-S-S-S-S-S-S-S-S2-M2Sx(x=2~6)M2Sx+2H+==2M++(x-1)S+H2S硫烷:H2Sx(x达到8)H-S-(S)x-2-S—H5、过硫酸:H2O2——HO-O-SO3H——HSO3-O-O—SO3H(过一硫酸)(过二硫酸)可通过电解HSO4-得到(H2O2的制取)6、硫代硫酸钠:Na2SO4•5H2O大苏打、海波。(1)还原性:I2+2S2O32-==S4O62-+2I-(进行I2的定量测定)\n(2)自身氧化还原:(在酸性条件下)S2O32-+2H+==S+SO2+H2O(3)作为配体:Ag++2S2O32-===Ag(S2O3)23-β2=4×1013OOOMSSOOSSOM单基配体双基配体7、连二亚硫酸Na2S2O4•2H2O保险粉\n8、硫的卤化物:SCl4可以水解:(写出离子方程式)S2F2水解:S2F2+6H2O=6S+10HF+H2S4O6SF6比较稳定,不易水解,(为什么?)\n【例题1】氧及卤素反应生成许多不同的化合物(硫原子是中心原子),这些化合物大多数是分子,其中有许多种在水中容易水解。1.SCl2、SO3、SO2ClBr、SF4及SBrF5等分子的路易斯(Lewis)结构式。2.画出上述五种分子的几何构型。\n【例题2】同主族元素其性质相似。例如,硫化物性质类似于氧化物;它也可以分为酸性硫化物和碱性硫化物;也存在氧化性或还原性;互相间也能发生反应。例如:Na2S+CS2=NaCS3(硫代碳酸钠),完成下列反应方程式:l.Na2S+As2S5→2.Na2S+SnS2→3.Na2S2+SnS→【例题3】判断含氧酸强弱的一条经验规律是:含氧酸分子的结构中含非羟基氧原子数越多,该含氧酸的酸性越强。某些含氧酸的酸性如右表:1.亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大。H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可推出它们的结构式分别为:2.H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是3.在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况,写出化学反应方程式。