- 1.58 MB
- 2022-08-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
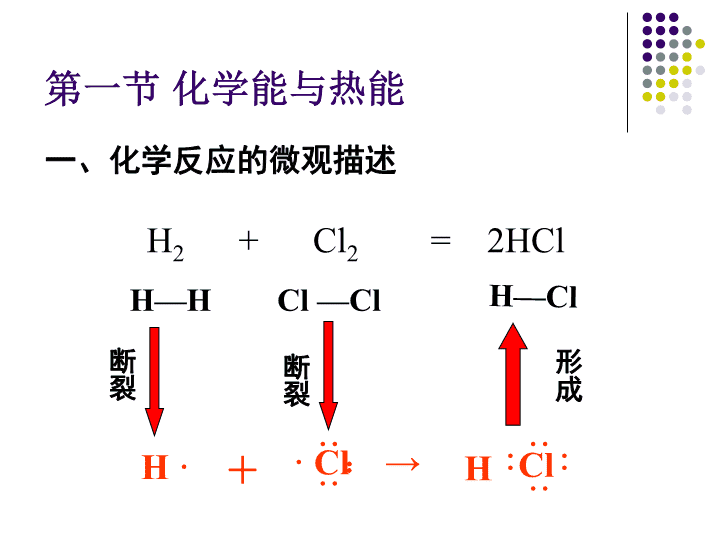
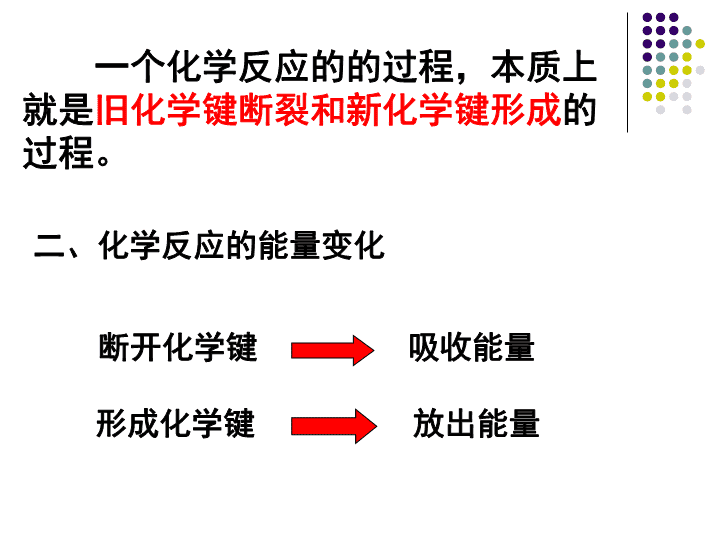
第二章化学反应与能量第一节化学能与热能第二节化学能与电能第三节化学反应的速率与限度\n第一节化学能与热能一、化学反应的微观描述H····Cl··:+→Cl····H····H2+Cl2=2HClH—HCl—ClH—Cl断裂断裂形成\n一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。断开化学键吸收能量形成化学键放出能量二、化学反应的能量变化\n思考一个化学反应吸收能量还是放出能量是由什么决定的呢?\n放出能量如果E反高于E生,那么在发生化学反应时,就有部分能量以热的形式释放出来;\n\n吸收能量如果E反低于E生,那么在发生化学反应时,反应物就需要吸收能量,才能转化为生成物。\n思考如何确定化学反应的热效应?取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小,即取决于反应物的总能量与生成物的总能量的相对大小。\n反应物的能量之和E反生成物的能量之和E生若E反>E生,若E反4Q32Q1+Q2<4Q3C.Q1+Q2b>c>dB.a>c>d>bC.c>a>b.>dD.b>d>c>aB\n4.如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组()A、A是锌,B是铜,C为稀H2SO4B、A是铜,B是锌,C为稀硫酸C、A是铁,B是银,C为AgNO3溶液D、A是Ag,B是铁,C为AgNO3溶液ACABD\n三.原电池的构成条件[实验探究]原电池的构成条件根据原电池的工作原理以及电学知识,利用所提供的实验用品,自主设计若干套原电池,并在实验中探究原电池的构成条件.实验用品:铜板、锌板、铁板、导线、安培表、自备果汁、电池盒请将你的设计内容及时记录在课本P41页的表格内\n小结:构成原电池的条件:1、活泼性不同的两种电极。2、有电解质溶液并形成闭合回路。3、通常至少有一极能与电解质溶液发生氧化还原反应。\n5.下列装置中能构成原电池的是()CZnCuH2SO4AZnCuCuSO4AZnCu酒精ABZnH2SO4ACuH2SO4CD没有形成闭合回路酒精不是电解质没有形成闭合回路课堂练习:\n\n\n\n四.发展中的化学电源化学电源一次电池二次电池燃料电池碱性锌锰电池铅蓄电池氢氧燃料电池锂离子电池银锌蓄电池普通锌锰干电池锌银纽扣电池\n锌筒石墨棒MnO2和C普通锌-锰干电池的结构NH4Cl、ZnCl2和H2O等1、普通干电池负极正极电池反应:(Zn):Zn–2e-=Zn2+(C):优点:制作简单、价格便宜。缺点:放电时间短,电压下降快。2NH4++2e-=Zn2++2NH3+H2Zn+2NH4+=Zn2++2NH3+H2\n2、铅蓄电池\n放电过程总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2OPb+SO42--2e-=PbSO4正极:PbO2+4H++SO42-+2e-=2PbSO4+2H2O氧化反应还原反应负极:①放电过程铅蓄电池充电的反应则是上述反应的逆过程\n②充电过程PbSO4+2e-=Pb+SO42-还原反应阴极:阳极:PbSO4+2H2O-2e-=PbO2+4H++SO42-氧化反应接电源负极接电源正极充电过程总反应:2PbSO4+2H2O=Pb+PbO2+2H2SO4铅蓄电池的充放电过程:Pb+PbO2+2H2SO42PbSO4+2H2O放电充电\n3、燃料电池氢氧燃料电池酸性电解质:碱性电解质负极:2H2-4e-+4OH-==4H2O正极:O2+2H2O+4e-==4OH-总反应:2H2+O2==2H2O负极:2H2-4e-==4H+正极:O2+4H++4e-==2H2O总反应:2H2+O2==2H2O\n甲烷氧气燃料电池KOH溶液CH4O2H2OabCH4+10OH--8e-=CO32-+7H2OCH4+2O2+2KOH=K2CO3+3H2O负极:正极:2O2+4H2O+8e-=8OH-总反应:\n第三节化学反应速率与限度有些塑料的分解需要几百年的时间。现在的生物降解材料的分解也需要几周的时间。\n而有些反应,例如核反应。在很短的时间内就可以完成反应,巨大的能量在一瞬间放出,所以无控制的核反应是很危险的。\n一.化学反应速率1、定义:单位时间内反应物浓度的减少或生成物浓度的增加来表示某反应的速率.2、数学表达式:V=tΔc\n3、使用注意:①v表示平均反应速率;②Δc表示指定物质的反应前后的变化浓度;③t表示反应时间;④浓度单位常用mol.L-1,时间单位常用s,min。所以化学反应的速率单位为:mol·L-1·s-1或mol·L-1·min-1\n课堂练习:1.在某反应中,反应物A的浓度在10s内从4.0mol·L-1变成1.0mol·L-1,在这10s内A的化学反应速率为多少?2.在5升密闭容器中发生如下反应:C(s)+CO2(g)=2CO(g)若最初加入22g二氧化碳,5min后测得还剩有17.6g,求在这段时间内,二氧化碳的平均速率。0.3mol·L-1·s-10.004mol·L-1·min-1\n3.在一定条件下2升的反应容器中充入1molN2和3molH2发生下反应,N2+3H2=2NH3,5分钟后测得体系内N2为0.75mol,H2为2.25mol,NH3为0.5mol,则NH3的反应速率为_____________。思考:如果用H2浓度的变化表示反应速率应为多少?如果用N2呢?三个速率的关系如何?\n4、同一反应中各物质速率关系:一定条件下,用不同的物质来表同一个反应的速率,其数值可能不同,但表示的意义相同。且它们的数值之比等于反应方程式中系数比。如N2+3H2=2NH3132\n课堂练习:4.在2升的密闭容器中发生了某反应:3A(g)+B(g)=2C(g)若最初加入的A和B都为4mol,A的平均速率是0.12mol·L-1·s-1,求10s后容器中B的物质的量。3.2mol5.在某反应中,经过10s后,各物质的浓度变化为:A减少amol·L-1;B减少a/2mol·L-1;C增加amol·L-1;求该反应的化学方程式。2A+B=2C\n6.对于反应A2+3B22AB3以下表示的反应速率中,速率最大的是A、v(A2)=0.4mol·L-1·min-1B、v(B2)=0.8mol·L-1·min-1C、v(AB3)=0.6mol·L-1·min-1D、v(A2)=0.01mol·L-1·s-1D\n二.影响化学反应速率的因素1、浓度对速率的影响[实验探究]浓度对速率的影响用量筒向一支试管中加入4mlNa2S2O3溶液,向另一支试管中加入2mlNa2S2O3和2mlH2O,然后向两支试管中分别加入1滴管H2SO4,观察现象.根本原因:物质本身的化学性质客观原因:\n结论:增大某反应物的浓度可以加快反应速率;减小某反应物的浓度会减慢反应速率。\n2、温度对速率的影响[实验探究]温度对速率的影响向两支试管中分别加入2mlH2O2溶液和1-2滴FeCl3溶液.将一支试管放在盛有热水的烧杯中,对比观察现象,分别用带火星的木条检验生成的气体.\n结论:升高温度可以加快反应速度。一般每升高10℃反应速率可增加2—4倍。反之,降低温度会减慢反应速率.\n3、催化剂对速率的影响[实验探究]催化剂对速率的影响向三支试管中分别加入2mlH2O2溶液,再向其中一支试管加入1-2滴FeCl3溶液,另一支试管中加入少量MnO2粉末.对比观察.\n催化剂有加快反应速率的催化剂,也有减慢反应速率的催化剂,一般在没特殊指明的情况下都是指加快反应速率的催化剂。结论:适当的催化剂可以有效的改变化学反应速率。\n4、压强对速率的影响压强对化学反应速率的影响实质上是通过改变气体反应物的浓度来实现的。结论:加压可提高有气体参加的反应速率。压强对固相、液相反应的反应速率无影响。思考:压强的改变对哪类物质影响最明显?压强改变对气体物质的影响最大,而固体和液体受压强的影响很小。所以,讨论压强因素时,必须指的是有气体参加的化学反应。思考:压强改变对有气体参与的反应如何影响?\n5、固体表面积对速率的影响化学反应时,与固体的接触面积越大,化学反应速率就越快。反之,就越慢。如:把固体粉碎.6、原电池效应对速率的影响小结:对于同一个化学反应来说,条件不同,反应速率会发生变化。一般来讲,增大反应物浓度、升高温度、对于有气体参与的反应增大压强、使用催化剂等,均可以增大化学反应速率。\n第三节化学反应限度—化学平衡在工业生产中,只考虑化学反应的速率问题是不够的。为了更好的控制生产成本,还需要同时考虑化学反应所能达到的最大限度。这就涉及到化学反应进行的程度问题了。化学平衡就是研究可逆反应进行程度规律的。\n一、可逆反应1、定义:在同一条件下正反应方向和逆反应方向均能进行的化学反应.2、可逆反应的特征:①、同一条件下②、无论哪个方向都不能进行彻底\n二、化学平衡的建立如果外界条件不变,反应无论进行多长时间,反应混合物中各种物质的浓度都不再发生变化。\n三、化学平衡的特征动,化学平衡为动态平衡,化学反应仍在进行,没有停止。等,达到化学平衡时,正反应速率等于逆反应速率。定,达到化学平衡时,平衡混合物中各组分含量保持一定。变,当外界条件发生改变时,原有平衡就会被破坏,并在新的条件下建立新的平衡,这一过程叫做平衡的移动。\n四、达到化学平衡的标志正反应速率等于逆反应速率反应混合物中各组分的含量保持一定\n课堂练习:1.可逆反应达到平衡的重要特征是:A反应停止了B正、逆反应的速率都为零C正、逆反应都还在继续进行D正、逆反应速率相等D\n2.一定条件下,可逆反应达到平衡时:A单位时间内反应物减少的分子数等于生成物增加的分子数B反应物浓度等于生成物浓度C反应物与生成物浓度保持不变D混和体系中各组成成份和含量保持不变CD\n3.在一定温度下,2NO2(g)N2O4(g)(无色)的可逆反应中,下列情况属于平衡状态的是()A.N2O4不再分解B.v(N2O4):v(NO2)=1:2C.体系的颜色不再改变D.NO2的浓度与N2O4的浓度之比2:1C对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化,也可以说明体系已经平衡\n4.在一定温度下的定容容器中,当下列的物理量不再发生变化时,表明反应A(固)+2B(气)C(气)+D(气)已达到平衡状态的是:()A混合气体的压强B混合气体的密度C气体的总物质的量DA的浓度B对于有气体参加或生成的反应,气体密度和压强也可以作为判断平衡的标准,但需要灵活应用.\n5.对反应A(气)+B(气)C(气)+D(气)的以下叙述中,能说明恒温、恒容下已达平衡状态的A反应容器中,压强不随时间改变而改变B反应容器中,密度不随时间改变而改变C反应容器中,A、B、C、D质量不再改变D反应容器中的各物质物质的量不随时间变化CD\n五、转化率物质转化率的高低体现了反应向某方向进行的程度。转化率=某反应物的转化浓度该反应物的起始浓度\n转化率=某反应物消耗的物质的量该反应物起始的物质的量转化率=某气体反应物消耗的体积数该气体反应物起始的体积数对于气体反应物:\n课堂练习:6.在温度和压强不变时,1LNO2高温分解:2NO22NO+O2达到平衡,体积变为1.2L,NO2的转化率是?\n2SO2(g)+O2(g)2SO3(g)7.加入amolSO2和bmolO2,反应达到平衡时有cmolSO3生成,求SO3在平衡混合气中所占的体积分数\n8.在一个体积为5L的密闭容器中,充入NH3和O2,它们的物质的量比为1:2,发生如下反应:4NH3+5O24NO+6H2O上述反应在一定条件下进行,2min后平衡,此时NH3有2mol,已知NH3的转化率为20%,以NO的浓度变化表示的平均反应速率为?NH3的起始浓度为?O2的平衡浓度为?