- 4.45 MB
- 2022-08-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
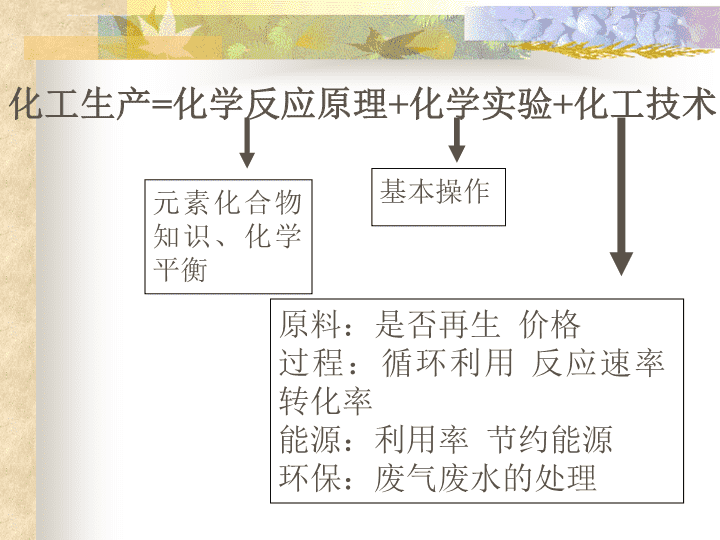
化工生产设计和制作:童文琴\n化工生产=化学反应原理+化学实验+化工技术元素化合物知识、化学平衡基本操作原料:是否再生价格过程:循环利用反应速率转化率能源:利用率节约能源环保:废气废水的处理\n选择生产条件时主要考虑的几个因素(1)尽可能提高反应混合物中所需物质的百分含量;(2)尽可能缩短反应到达平衡所需要的时间;(3)尽可能降低对耐高温设备所需材料的要求。(4)符合绿色化学理念(一是注意环境保护二是原子利用率接近百分之百)\n化工信息材料航天生命轻工食品能源环境建筑农牧业化肥农药高能电池。。。医药功能材料添加剂饲料\n\n\n硫酸工业生产原料原理和方法技术的发展\n在我国,硫酸的年产量已超过800Mt,其中72%用硫铁矿作原料,其次是用硫磺(占16%)和冶炼废气(占12%)为原料生产的。硫磺是生产硫酸的优质原料。我国的天然硫资源很少,自从能从煤和石油的加工中回收硫磺后,陆续建立利用硫磺生产硫酸的工厂。冶炼废气是冶炼有色金属时的废气,特别是硫化矿中的废气含有二氧化硫,含量可达5%以上。\n\n1、硫铁矿的焙烧:4FeS2+11O22Fe2O3+8SO2沸腾炉2、二氧化硫的催化氧化:钒催化剂2SO2+O22SO3400—500º(放热的、体积缩小的可逆反应)接触室3、SO3的吸收:吸收塔SO3+H2OH2SO4接触法高温\n接触法制硫酸小结硫铁矿粉碎鼓入强大空气流矿粉燃烧沸腾炉SO2O2净化处理催化氧化接触室SO3热交换器水合吸收塔98.3%硫酸高浓度硫酸稀释成品硫酸\n\n硫酸厂要排放大量的废渣、废水、废气,严重污染环境。近20年来,对三废的治理已采取了一些有效的措施:利用废渣作建筑材料;采用封闭式流程,控制废水的排放;提高二氧化硫的转化率,达99.7%以上,防止吸收塔排放的尾气对空气的污染,等等。硫酸生产过程中的几个主要反应都是放热的。包括硫铁矿的焙烧、二氧化硫氧化、三氧化硫吸收,每生产1吨硫酸,合计放热7.2*106kJ,折合电力2000度。\n合成氨工业\n1914年,第一次世界大战一开始,英国就从海上封锁德国从智利进口硝石。于是人们预言,德国得不到智利硝石,农田将缺乏肥料,炸药工厂也将停产,那么德国最迟在1915年或1916年便要自动投降,可是1916年过去了,德国还在顽强的战斗,农田照样一派浓绿,前线的炮火反而更加猛烈。原来……德国以哈伯为首的一批化学家克服了当时的世界化学难题——以廉价的空气、水和煤炭合成了重要的化工原料:氨(NH3)\n哈伯与合成氨合成氨从第一次实验室研制到工业化投产经历了约150年的时间。德国科学家哈伯在10年的时间内进行了无数次的探索,单是寻找高效稳定的催化剂,2年间他们就进行了多达6500次试验,测试了2500种不同的配方,最后选定了一种合适的催化剂,使合成氨的设想在1913年成为工业现实。鉴于合成氨工业的实现,瑞典皇家科学院于1918年向哈伯颁发了诺贝尔化学奖。\n氨的合成以氮、氢两种气体为原料。燃料(煤、焦碳、液态石油烃、天然气、石油炼厂气)空气、水CO、氢气氮气氢气、氮气二氧化碳氢气、氮气\n勒沙特列(LeChatelier)原理(平衡移动原理)如果改变任一个影响平衡的条件(eg.c、p、Tetc.),平衡就向着能够削弱这种改变的方向移动。HenriLeChatelier\n合成氨反应使氨生成的快(从化学反应速率分析)使氨生成的多(从化学平衡分析)压强温度是否要用催化剂N2(g)+3H2(g)2NH3(g)+92.4kJ分析角度反应要求外界条件高温高压高压低温使用不影响\n合成氨1.合成氨的适宜条件:(1)压强:20~50MPa(2)温度:500℃(3)催化剂:铁触媒(以Fe为主体的多成分催化剂)N2+3H22NH3铁触媒500℃20~50MPa\n合成氨工业简述:空气压缩降温液态空气蒸发N2(先逸出)炭CO2+N2除去CO2N2H2O(g)赤热炭或其他燃料CO+H2H2O(g)催化剂CO2+H2除去CO2H2原料:空气、水、燃料C+H2O(g)→CO+H2高温CO+H2O(g)→CO2+H2催化剂原料气的制备净化压缩(防止催化剂中毒)合成分离液氨N2、H2\n智利硝石(NaNO3)缺氮的棉花是植物体内蛋白质、核酸和叶绿素的组成元素。蛋白质是细胞原生质的重要成分,核酸是合成蛋白质的必要成分。在植物生长发育过程中,细胞分裂和新细胞的形成必须要有蛋白质;而光合作用则离不开叶绿素。因此,在缺氮的情况下,由于新细胞形成受阻,植物的生长发育会迟缓或停滞;如果叶绿素含量下降,则直接影响光合作用的速率和光合作用产物的形成。同时,蛋白质含量的下降使作物的品质降低。氮\n氮的固定:把大气中的氮转化为氮的化合物叫做氮的固定。包括:①自然固定:豆科植物固氮、雷雨天产生NO气体;②人工固定:合成氨等。\n硝酸工业\n在17世纪,人们用硫酸分解硝石来生产硝酸。NaNO3+H2SO4NaHSO4+HNO320世纪初,曾利用电弧产生的高温模拟闪电,使空气中的氮和氧合成一氧化氮,再冷却吸收生成硝酸。1913年后,由于合成氨的工业化,用氨为原料生产硝酸成为主要方法。\n1、氨的催化氧化Pt—Rh4NH3+5O24NO+6H2O800ºC2、一氧化氮的氧化:2NO+O22NO2二氧化氮的吸收:3NO2+H2O2HNO3+NO(这是一个放热的、气体体积缩小的可逆反应,降温、加压对反应有利。补充空气可使二氧化氮充分被水吸收。)4NO2+O2+2H2O4HNO3设备:吸收塔设备:氧化炉\n\n生产浓硝酸(98%)可用浓缩法:使浓硫酸和稀硝酸混合(如49份50%的硝酸和51份98%的硫酸混合),在精馏塔内精馏,从塔顶可得到浓硝酸,塔底得到稀硫酸。稀硫酸蒸发浓缩后能循环使用。思考:若蒸馏过程中HNO3、H2SO4、H2O均无损耗,则蒸馏后得到的稀硫酸的浓度?已知蒸馏前的投料比即硝酸和硫酸的质量比,若蒸馏过程中水有损耗,则投料比应(增大、减小、不变)\n计算硝酸工业尾气中氮的氧化物(NO、NO2)是主要的大气污染物之一。可用以下方法进行治理:2NO2+2NaOHNaNO2+NaNO3+H2ONO2+NO+2NaOH2NaNO2+H2O现有aL(STP)NO2(其中占体积分数20%的气体是N2O4)和bLNO的混合气体,恰好可被200mLNaOH溶液完全吸收。问:欲保证尾气全部被吸收,则a:b的值应控制在什么范围。氢氧化钠溶液的物质的量浓度是多少?\n氯碱工业\n在化学工业中,由电解食盐水生产氯气和烧碱的工业,叫做氯碱工业。当烧碱过剩时,可用碳化法把烧碱转化为纯碱:2NaOH+CO2Na2CO3+H2O当烧碱不足时,可用苛化法生产部分烧碱:Na2CO3+Ca(OH)2CaCO3+2NaOH氢气是氯碱工业的副产品,常用于生产盐酸。氯气主要用于生产聚氯乙烯等有机氯产品。\n电解饱和食盐水反应原理阴极:阳极:总反应:2H++2e-=H2↑2Cl--2e-=Cl2↑2H2O+2Cl-=H2↑+Cl2↑+2OH-电解2H2O+2NaCl=H2↑+Cl2↑+2NaOH电解\n上述装置的弱点:1.H2和Cl2混合不安全2.Cl2会和NaOH反应,会使得到的NaOH不纯\n1.离子交换膜电解槽的简单构造如何?
2.离子交换膜的作用是什么?
3.工业制碱的简单生产流程怎样?思考:\n隔膜通常用石棉制成,将浆状的石棉纤维均匀的吸附在阴极网上。近年来,有些工厂在石棉浆中添加聚四氟乙烯、聚多氟二氯乙烯纤维来延长隔膜的使用寿命。阴极材料一般用铁丝网或打铁的铁板制成。阳极过去主要用石墨板,它使用寿命短,降低电能的利用率。70年代后,我国的一些大厂陆续改用金属钛为基体的金属阳极。\n离子交换膜法制烧碱\n1、生产设备名称:离子交换膜电解槽阳极:金属钛网(涂钛钌氧化物)阴极:碳钢网(有镍涂层)阳离子交换膜:只允许阳离子通过,把电解槽隔成阴极室和阳极室。2、离子交换膜的作用:(1)防止氯气和氢气混合而引起爆炸(2)避免氯气与氢氧化钠反应生成次氯酸钠影响氢氧化钠的产量\n\n\n3、生产流程\n氯碱工业的原料是食盐。有海盐、湖盐(青海)、井盐(四川)、岩盐(湖北)。我国的氯碱工业多建于沿海,所用食盐主要是海盐。海盐中含有CaSO4、MgSO4、MgCl2等杂质,要净化制成饱和食盐水再电解。思考1、为什么要净化?2、如何净化?\n1.用什么方法除去泥沙?2.用什么试剂除去Ca2+、Mg2+、Fe3+、SO42-?3.所用试剂只有过量才能除净这些杂质,你能设计一个合理的顺序逐一除杂吗?思考:\n粗盐水(Ca2+、Mg2+、Fe3+、SO42-)过量BaCl2Ba2++SO42-=BaSO4Ca2+、Mg2+、Fe3+、Ba2+BaSO4Ca2++CO32-=CaCO3Ba2++CO32-=BaCO3CaCO3BaCO3过量Na2CO3Mg2+、Fe3+、CO32-Mg2++2OH-=Mg(OH)2Fe3++3OH-=Fe(OH)3过量NaOHFe(OH)3Mg(OH)2OH-、CO32-精制食盐水\n饱和食盐水的精制杂质:泥沙、Ca2+、Mg2+、Fe3+、SO42-加入BaCl2,除去SO42-,再加Na2CO3,以除去过量的Ba2+:Ba2++SO42-=BaSO4↓CO32-+Ba2+=BaCO3↓加入Na2CO3溶液以除去Ca2+:Ca2++CO32-=CaCO3↓加入NaOH溶液于除去Mg2+、Fe3+:Mg2++2OH-=Mg(OH)2↓Fe3++3OH-=Fe(OH)3↓再经过阳离子交换塔,用阳离子交换树脂除去剩余的Ca2+、Mg2+等。\n\n练习一:写出用碳棒作阳极,铁棒作阴极分别电解NaCl溶液、熔融的NaCl的电极反应式。练习二:写出用铜棒或碳棒作阳极,铁棒作阴极分别电解CuSO4溶液电极反应式。\n以氯碱工业为基础的化工生产\n\n\n纯碱工业\n知道纯碱的用途吗?你\n\n想一想?获得纯碱的方法有哪些?\n自然界中有纯碱吗?内蒙古鄂尔多斯合同查汗淖碱湖\n鄂尔多斯天然碱厂\n纯碱即苏打,化学组成为Na2CO3。碳酸钠用途非常广泛。是一种重要的化工原料,虽然人们曾先后从盐碱地和盐湖中获得碳酸钠,但仍不能满足工业生产的需要。盐湖\n两种著名的制碱技术(1)氨碱法制纯碱(索尔维制碱法)(2)联合制碱法(侯氏制碱法)\n总原理相同:两种著名的制碱技术2NaHCO3======Na2CO3+CO2↑+H2ONaCl+NH3+CO2+H2ONaHCO3↓+NH4Cl原料来源和副产物不同\n历史1810年法国物理学家福瑞斯奈尔用碳酸氢铵和食盐为原料制取纯碱:NaCl+NH4HCO3NaHCO3+NH4Cl2NaHCO3Na2CO3+H2O+CO21859年,比利时化学家苏尔维利用他父亲煤气厂的副产品,发明了新的制碱法:H2O+CO2+NH3NH4HCO3NH4HCO3+NaClNaHCO3+NH4Cl2NaHCO3Na2CO3+H2O+CO2氨碱法(苏尔维法)\n饱和食盐水通氨气氨盐水过滤洗涤通CO2碳酸氢钠煅烧纯碱(产品)二氧化碳滤液NH4ClNaCl加热Ca(OH)2氨(循环使用)(循环使用)废液CaCl2、NaCl石灰石煅烧二氧化碳CaOCa(OH)2石灰乳\nNaCl+NH3+CO2+H2ONaHCO3+NH4Cl2NaHCO3Na2CO3+CO2↑+H2O氨碱法制纯碱原理(索尔维法)CaCO3CO2+CaOCaO+H2OCa(OH)22NH4Cl+Ca(OH)2CaCl2+2NH3+2H2O\n氨碱法优点原料(食盐、石灰石)便宜产品(纯碱)纯度高副产品氨、二氧化碳可循环使用步骤简单,适用于大规模生产缺点两种原料的成分里只利用了一半食盐的利用率只有72%-74%\n侯德榜\n侯氏制碱法的诞生1921年10月侯德榜接受了永利碱业公司的聘请,毅然从美国启程回国,决心自己开发制碱新工艺,经过600多次研究实验,分析了2000多个样品,历时5年,于1942年发明并创立了举世闻名的“侯氏制碱法”。\n我国科学家侯德榜在研究了生产的苏尔维法后,发明了侯氏制碱法:在苏尔维法的滤液中加入固体食盐,就会析出氯化铵晶体,母液还能回到氨碱法生产中。NaCl+NH3+CO2+H2ONaHCO3+NH4Cl2NaHCO3Na2CO3+H2O+CO2\n饱和食盐水通氨气氨盐水过滤洗涤通CO2碳酸氢钠煅烧纯碱(产品)二氧化碳滤液NH4ClNaCl加氯化钠细粉、通氨气冷却、过滤、洗涤、干燥氯化铵(产品)(循环使用)饱和NaCl(循环使用)合成氨工厂二氧化碳氨气氯化铵在低温、氯化钠浓溶液里的溶解度小\n联合制碱法食盐的利用率提高到96%以上综合利用了氨厂的二氧化碳和氨气,,生产出纯碱和氯化铵。\n“侯氏制碱法”流程图侯先生用了5年做了600次实验才完成此设计。\n侯德榜1890年8月9日出生于福建的一个农民家庭,就读于福州英华书院和沪皖两省路矿学堂,1910年考入清华留美预备学堂,1913年公费赴美留学,1917~1921年先后获得麻省理工学院化学工程学学士学位、哥伦比亚大学硕士学位和该校哲学博士学位。\n我国民族化学工业的先驱\n吴蕴初(1891—1953)江苏嘉定人,是位值得称道与世人尊敬的中国人,是位对中华民族做出过突出贡献的人物。他的家业,谈不上富裕,连温饱也不足以保障;他开创实业时,几乎是一文不名。有的只是良好的素质与知识,这是他的全部资本,也是最可靠、最强大的资本。\n天厨——天原——天盛——天利——天山,如同化学的连锁反应方程式一般,互为动因与补充,形成一个完善的天字号系列,虽有先后之序,却在国内都是天字第一号的化学工业企业\n酱油的鲜味主要就是来自于蛋白质发酵后分解产生的谷氨酸钠,但过去人们不知道这个道理,1866年,德国的雷特豪生教授利用硫酸与小麦中的麦胶蛋白分离制出了谷氨酸钠,但他并没有发现谷氨酸钠在饮食上的用途。天字第一号:敬请国人入“天厨”\n1908年,日本东京帝国大学的化学教授池田菊苗进行关于海带的研究,从海带中成功地提取了谷氨酸钠。同时他发现,只要在汤或菜中放入极少量的谷氨酸钠,便可使其味道鲜美至极。后来池田与铃木三郎助合作,研制成功了通过酵解大豆或小麦蛋白质制取谷氨酸钠的方法,他们后为谷氨酸钠的商品起名为“味の素”。\n1921年,中国的化工实业家吴蕴初发明了盐酸水解法,成功提取出谷氨酸钠,并为它起了一个中国式的名字“味精”。它是提炼自植物蛋白,是素的,却兼有鲜肉之美。佛门之徒,食素已惯,必更喜欢,乐于享用。佛在天堂,供佛所用的美味自也多集中于天堂之上。\n佛手味精大量生产,自然所需原料也随之猛增,这也就越发显出原料的重要性了。吴蕴初制造味精的原料,主要是面筋,其次是盐酸。当时国内根本没有生产盐酸的厂家,国内用盐酸基本上靠进口,也基本上靠从日本进口,自是价格十分昂贵,日商也往往用以卡中国的民族企业。\n天字二三号:请赴“天原”观“天盛”不到一年的时间,天原厂于1929年正式投产了。日产盐酸两吨、液碱四吨、漂白粉三吨。这些产品与味精一样,在此前的中国是没有的,如果说有,那么天原电化厂就是第一个,为中国的化学工业的发展奠定了一个新起点\n“天原”是为天厨味精厂提供原料的,故吴蕴初为它取名为“天原电化厂”。且“天原”还有天府乐原之解,自是响亮而吉祥。直到此刻,天原盛装盐酸的“盐酸甏”还是日产。价格昂贵是一个方面,更主要的是抵制日货不彻底,如味精般,必须全部原料都能自产自给才行。吴蕴初又深切地感到创办耐酸陶器厂已经条件成熟。中国的陶业虽精,却从未烧制过耐酸陶器,因为千百年来,尚无那种必要。近代化学有了酸类产品,它才应需而生,当然是“生”在产酸的外国。厂名仍是吴蕴初的巧思,以产天原产品盛器为因,取做“天盛”。\n原料原料气的制备、净化、压缩氨的合成氨的分离循环气产品天字第四好:请以“天利”效家邦\n虽说日产量很低,不过四吨,且全上海由于当时对液氨尚无认识与采用,需求量也只在五百斤左右。但吴蕴初并不悔,他早知其不可为,可为了救国强本,开拓化学工业,他必欲为之,这就是他常说的,特别是办硝酸厂时一再重复的“知其不可为而为之!”因硝酸厂所使用的原料除取自“天原”,便是取自天然:水、空气。故吴蕴初将其厂名也顺应其初取做“天利”。于是,在天厨——天原——天盛的连锁反应的分子结构式上又多了一个反应链——天利。\n天字第五号:请登“天山”望天下八一三以后,日寇占领了上海,他忍痛弃了四大厂房,拆卸了设备,冒着巨大的危险迁往了内地。一面努力医治企业的战争创伤,一面积极参与抗战救亡活动。\n如果将他的事业的每一个进程,或看做是一次化学的反应,那么,金钱则是每一个反应环节中的“催化剂”。资本,不取决于金钱,而取决于素质和知识