- 631.50 KB
- 2022-08-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
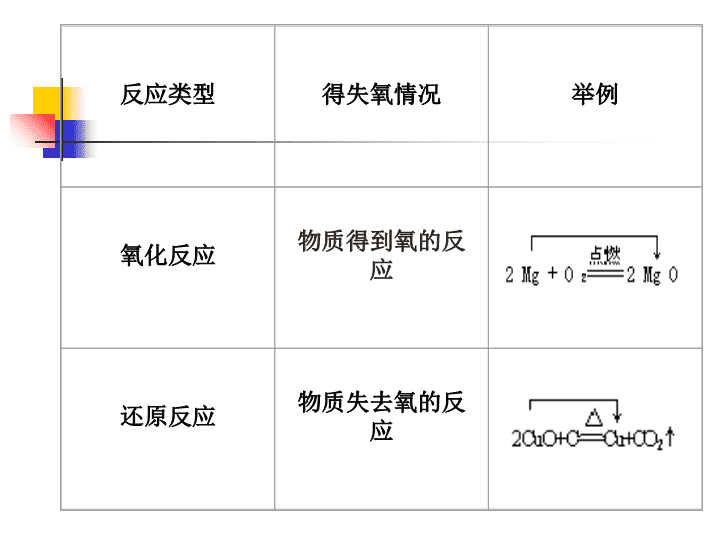
第二章化学物质及其变化第三节氧化还原反应\n反应类型举例表示式化合反应C+O2==CO2A+B====AB分解反应CaCO3===CaO+CO2↑AB====A+B置换反应C+CuO===Cu+CO↑A+BC===AC+B复分解反应AgNO3+NaCl==AgCl↓+NaNO3AB+CD=AD+CB△高温△\n反应类型得失氧情况举例氧化反应物质得到氧的反应还原反应物质失去氧的反应\n化学反应基本反应类型从形式上分从化合价升降角度分从是否有离子参与反应分化合反应分解反应氧化还原反应置换反应复分解反应非氧化还原反应非离子反应离子反应\n二.氧化还原反应反应类型得失氧情况举例物质得到氧的反应物质失去氧的反应氧化反应还原反应2Cu+O22CuO反应中,CuO失去氧而变成单质铜CuO+H2Cu+H2O反应中,Cu得到氧而变成氧化铜CuO\n从得氧失氧角度分析反应失去氧,被还原得到氧,被氧化CuO+H2=Cu+H2O(1)对于此反应,谁得到氧,谁失去氧?得到的氧原子与失去的氧原子有什么关系?(2)进一步分析,可以得到什么结论?思考:\n一种物质被氧化,同时另一种物质被还原的反应,叫做氧化还原反应。1.定义:从得氧失氧角度分析反应\n请大家阅读35页并完成思考与交流\n定义2:据元素化合价在反应前后是否发生变化分为:物质中某元素化合价在反应前后发生了变化。元素化合价在反应前后都不变。氧化还原反应:非氧化还原反应:\n判断氧化还原反应的依据:——有元素化合价升降\n反应是否氧化还原“得”“失”氧化合价升降氧化还原情况C+2CuO=2Cu+CO22Na+Cl2=2NaCl小结:有元素化合价升降的化学反应反应前后是否有元素化合价的改变物质所含元素化合价升高的反应物质所含元素化合价降低的反应1、从反应前后元素化合价是否升降看,氧化还原反应是。2、氧化反应:;还原反应:。3、判断一个反应是否为氧化还原反应的依据。是是碳元素化合价升高铜元素化合价降低C发生氧化反应CuO发生还原反应钠元素化合价升高氯元素化合价降低Na发生氧化反应Cl2发生还原反应\n【过渡】在反应物中:化合价升高被氧化还原剂化合价降低被还原氧化剂(特征)(变化)反应物注意:化合价升高总数=降低总数\n生成物中被氧化得到的物质:氧化产物被还原得到的物质:还原产物氧化剂+还原剂——氧化产物+还原产物\n2.有元素化合价升降的化学反应就是氧化还原反应。特征\n从化合价升降观点分析氧化还原反应物质所含元素化合价升高的反应是氧化反应化合价降低,被还原化合价升高,被氧化(氧化剂)(还原剂)CuO+H2=Cu+H2O+2-200+1-2物质所含元素化合价降低的反应是还原反应所含元素化合价升高的物质是还原剂所含元素化合价降低的物质是氧化剂(氧化产物)(还原产物)\n化合价升高,被氧化化合价降低,被还原(还原剂)(氧化剂)2Na+Cl2===2NaCl00+1-1从化合价升降观点分析氧化还原反应(氧化产物)(还原产物)\n[练习1]下列反应属于氧化还原反应的是()A、CaCO3+2HCl=CaCl2+H2O+CO2↑B、CaCO3CaO+CO2↑C、CaO+H2O=Ca(OH)2D、Mg+2HCl=MgCl2+H2↑高温D[练习2]在反应MnO2+4HCl=MnCl2+2H2O+Cl2↑中,元素化合价升高,被(填“氧化”或“还原”),发生(填“氧化”或“还原”)反应;元素化合价降低,被(填“氧化”或“还原”),发生(填“氧化”或“还原”)反应。氧化剂_______还原剂_____氧化产物________还原产物_________+4-1+20氯氧化氧化锰还原还原MnO2HClMnCl2Cl2\n从化合价升降观点分析氧化还原反应化合价升高,被氧化化合价降低,被还原Cl2+H2O=HCl+HClO0+1-2+1-1+1+1-2氯气是还原剂,也是氧化剂练习1(氧化剂)(还原剂)(氧化产物)(还原产物)\n化合价升高,被氧化化合价降低,被还原MnO2+4HCl=MnCl2+2H2O+Cl2↑+4-2+1-1+2-1+1-2氯化氢部分被氧化。练习20特点:从化合价升降观点分析氧化还原反应(氧化剂)(还原剂)(氧化产物)(还原产物)\n元素化合价和电子得失的关系NaNa+ClCl-Cl-Na+电子转移化合价升高数=失去的电子数化合价降低数=得到的电子数失去电子的反应就是氧化反应得到电子的反应就是还原反应化合价升高,被氧化化合价降低,被还原2Na+Cl2=2NaCl00+1-1\n氢气氯气化合时没有发生电子的得失,氢氯两原子通过共用电子对结合成共价化合物的分子由于原子吸引电子的能力有差别,造成共用电子对的偏移,且共用电子对偏向氯原子,偏离氢原子。使氢元素的化合价从0价升高到+1价,被氧化;氯元素的化合价从0价降低到-1价,被还原。H2+Cl2===2HCl光照元素化合价和电子偏移的关系\n练习3:分析化合价变化的情况,说明反应中的电子得失。Mg+2HCl=MgCl2+H2↑0+1+20镁元素的化合价由0升高至+2失去2e-氢元素的化合价由+1降低至0得到2xe-(一个镁原子失去两个电子)(一个氢得到一个电子,有两个氢,共得到两个电子)\n3.氧化还原反应的实质:电子的转移(得失或偏移)。\n从电子得失的观点分析氧化还原反应化合价升高,被氧化化合价降低,被还原2Na+Cl2=2NaCl00+1-1化合价升高数=失去的电子数化合价降低数=得到的电子数化合价升高,失去2xe-被氧化化合价降低,得到2xe-被还原2Na+Cl2=2NaCl00+1-1金属钠失去电子,是氯气得到电子,是还原剂氧化剂\n结论:化合价变化的本质——电子转移(得失或偏移)。有电子转移的反应是氧化还原反应。\n得氧失氧观点化合价升降观点电子转移观点氧化反应还原反应氧化还原的关系氧化还原反应得到氧的反应失去氧的反应得氧失氧同时发生有氧得失的反应化合价升高的反应化合价降低的反应化合价升高降低同时发生有化合价升降的反应失去电子的反应(或电子对偏离)得到电子的反应(或电子对偏向)得失电子同时发生(且得失电子总数相等)有电子转移的反应不完善有一定局限性特征(表现)本质\n二、氧化剂和还原剂氧化剂——得电子(电子对偏向)的物质还原剂——失电子(电子对偏离)的物质\n二、氧化剂和还原剂氧化产物——还原剂失电子被氧化后所得的物质(生成物)还原产物——氧化剂得电子被还原后所得的物质(生成物)\n12字真言:升、失、氧;降、得、还。若说剂,恰相反氧化剂+还原剂——氧化产物+还原产物元素化合价升高,失去电子,被氧化,发生氧化反应元素化合价降低,得到电子,被还原,发生还原反应\n双线桥上的标示:化合价的升降得失电子(nxme-)被氧化或被还原n:代表变价原子个数m:代表每个原子转移电子数\n总结1.得氧和失氧的反应只是氧化还原反应中的一部份。2.化合价发生改变是所有氧化还原反应的共同特征。3.电子得失是氧化还原反应的本质。失电子化合价升高被氧化还原剂得电子化合价降低被还原氧化剂(本质)(特征)(变化)(反应物)\n六字真言:升、失、氧;降、得、还。\n讨论后完成下表:反应实例基本反应类型化合反应化合反应分解反应分解反应置换反应复分解反应是否氧化还原反应是是是非非非3Fe+2O2===Fe3O4点燃CaO+H2O===Ca(OH)22H2O===2H2↑+O2↑通电CaCO3===CaO+CO2↑高温Fe+CuSO4=Cu+FeSO4NaOH+HCl=NaCl+H2O\n基本反应类型化合反应(1)单质间的化合(2)单质与化合物间的化合(3)化合物间的化合分解反应(1)分解产物均为化合物(2)分解产物中至少有一种单质置换反应反应物与生成物中均有单质复分解反应反应物与生成物均为化合物(氧还反应)(氧还反应)(氧还反应)(氧还反应)(非氧还反应)(非氧还反应)(非氧还反应)\n四、氧化还原反应与四种基本反应类型的关系。\n五、表示氧化还原反应的两种方法1.双线桥法:Cl2+H2O=HCl+HClO失1e-得1e-表示同一元素的原子或离子得失电子的结果。双箭号跨过等号,从反应物指向生成物,起止为同一元素。注明失去或得到电子的总数,得或失两字不能省略。注意:0+1-1失2e-2Na+Cl2=2NaCl得2e-0+10-1\n2.单线桥法:Cl2+H2O=HCl+HClO表示不同种元素间的电子转移情况。箭号不跨过等号,起点为失电子元素,终点为得电子元素。只标电子转移总数,不标得与失。注意:0+1-11e-Cl-Cl+H2O=HCl+HClO0+10-12Na+Cl2=2NaCl2e-\n失2e-MnO2+4HCl=MnCl2+Cl2+2H2O得2e-+4+2-102e-MnO2+4HCl=MnCl2+Cl2+2H2O+4+2-10课堂练习用双线桥表示同种元素的电子得失。用单线桥表示不同种元素的电子转移。\n练习分别用双线桥和单线桥表示下列方程式的的电子转移方向和数目2KMnO4===K2MnO4+MnO2+O2↑2KClO3===2KCl+3O2↑△△4P+5O2===2P2O5↑点燃2HgO===2Hg+O2↑△\n六、两类特殊的氧化还原反应Cl2+H2O=HCl+HClO0+1-1歧化反应S+2H2SO4(浓)3SO2↑+2H2O0+6+4归中反应\n1、根据反应方程式判断氧化剂+还原剂——氧化产物+还原产物元素化合价升高,失去电子,被氧化,发生氧化反应元素化合价降低,得到电子,被还原,发生还原反应[结论] 氧化性:氧化剂>氧化产物还原性:还原剂>还原产物氧化剂、氧化产物具有氧化性还原剂、还原产物具有还原性七、氧化还原反应中剂的判断和比较\n氧化性:化合价降低得电子的性质。还原性:化合价升高失电子的性质。氧化剂具有氧化性;还原剂具有还原性。判断方法2、元素化合价:最高价——只具氧化性,最低价——只具还原性,中间价——兼有氧化性和还原性。\n3、根据金属活泼性判断,金属单质还原性;金属阳离子氧化性K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au单质的还原性(失电子能力)减弱K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+、Sn2+、Pb2+、(H+)、Cu2+、Hg2+、Ag+金属阳离子的氧化性(得电子能力)增强注意:氧化性Cu2+〈Fe3+〈Ag+[讨论]将少量铁置于Cu(NO3)2和AgNO3的混合溶液中,先析出什么物质?\n常见的氧化剂:(1)典型的非金属单质如:F2、O2、Cl2……(3)高价金属阳离子如:Fe3+、Cu2+、Ag+、……(2)含有变价元素的高价态化合物:如KMnO4、浓H2SO4、HNO3等等。在化学反应中易得电子被还原的物质。\n常见的还原剂:在化学反应中易失电子被氧化的物质。(1)典型的金属单质如:K、Ca、Na、Mg、Al……(其还原性强弱与金属活动性基本一致)(2)某些非金属单质及其化合物如:H2、C、CO……(3)有变价元素的最低价态化合物如:H2S、HI……\n既有还原性又有氧化性微粒Fe3+FeFe2+S-2SSS0+4+6\n还原性:KCaNaMgAlZnFe氧化性:F2Cl2Br2I2氧化性:氧化剂>氧化产物还原性:还原剂>还原产物氧化性还原性比较:>>>>>>>>>判断氧化还原反应能否发生的方法\n*七、氧化还原反应方程式的配平配平步骤1.标变价2.列变化3.求总数4.配系数5.细检查\n配平下列化学反应方程式Cu+HNO3Cu(NO3)2+NO+H2O\n标变价标出反应前后发生改变的化合价,不变不标。Cu+HNO3Cu(NO3)2+NO+H2O0+5+2+2\n列出元素的化合价的变化,即某元素一个原子化合价升高或降低的绝对值。列变化Cu+HNO3Cu(NO3)2+NO+H2O0+5+2+223\n求总数求化合价升降的最小公倍数,使化合价升高和降低的总数相等。Cu+HNO3Cu(NO3)2+NO+H2O0+5+2+223×3×2\n配系数先配变价元素,再用观察法配平其它元素原子的系数。Cu+HNO3Cu(NO3)2+NO+H2O0+5+2+223×3×2332284细检查等号两边各种元素的原子总数是否相等。\nC+HNO3NO2+CO2+H2O0+5+4+441×1×4442\n三、配平原则1.质量守恒原则即反应前后各元素的原子个数相等2.电子守恒原则反应中还原剂失去电子的总数与氧化剂得到的电子总数相等(即化合价升降总数相等)\n练习NH3+O2N2+H2OC+H2SO4(浓)CO2↑+SO2+H2OCu+HNO3(浓)Cu(NO3)2+NO2+H2O\n3×2×22×2×34NH3+3O2(纯)=2N2+6H2O-300-2\nC+2H2SO4(浓)=CO2↑+2SO2+2H2O0+6+4+442×2\nCu+4HNO3=Cu(NO3)2+2NO2+2H2O2×11×20+4+2+4\n思考:FeS2+O2———Fe2O3+SO2高温411———28