- 728.50 KB
- 2022-08-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
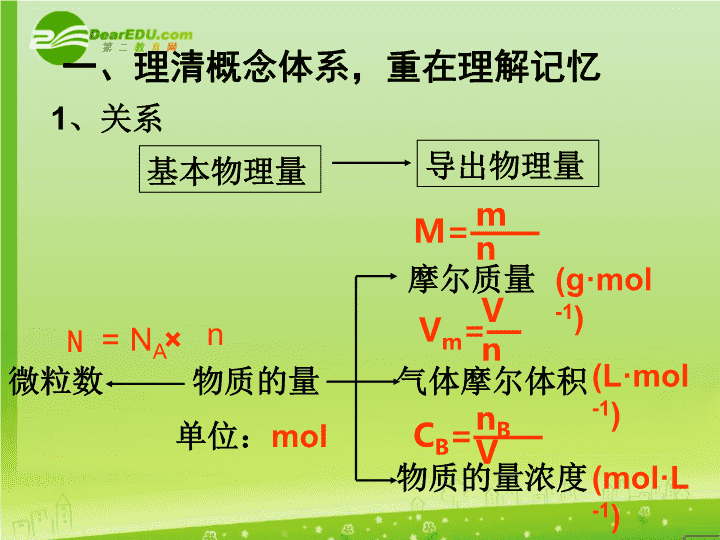
物质的量复习课\n一、理清概念体系,重在理解记忆1、关系基本物理量导出物理量物质的量微粒数N=NA×n单位:mol摩尔质量(g·mol-1)气体摩尔体积(L·mol-1)物质的量浓度(mol·L-1)M=——mnVm=—VnCB=——nBV\n2、理解概念1)物质的量2)摩尔质量3)阿伏加德罗常数4)气体摩尔体积5)阿伏加德罗定律6)物质的量浓度\n二、以物质的量为中心建立各物理量之间的关系物质的量浓度(mol/L)物质的量(mol)物质的粒子数(mol/L)物质的质量(g)标况时气体体积(L)÷V(L)×V(L)×M(g/mol)÷M(g/mol)×NA÷NA×22.4(L/mol)÷22.4(L/mol)\n1、有关气体摩尔体积的计算相关公式:——mM——NNAn——VVmρ=—mV1)2)PV=nRT—=—=—(T,P一定)n2V2V1n1N1N2——=——ρ1ρ2M1M2(P,T一定)—=—=—P1P2n1n2N1N2(T.V一定)\n1.NA为阿伏加德罗常数,下列说法不正确的是()A.23gNa变成Na+时,失去的电子数NAB.体积为11.2L的氯气中,含有氯原子数约为6.02×1023个C.200C,101KPa时,1molCO2的体积比22.4L大D.在标准状况下,22.4L由H2和N2组成的混合气体所含分子总数为NAE.水的摩尔质量等于NA水分子质量之和例题分析BE\n3、同温同压下,等质量的CO和CO2相比较,不正确的是()A.所含质子数目之比为1:1B.密度之比为7:11C.所含氧元素的质量之比为11:14D.体积之比为7:112.在标准状况下,1个装满H2的容器的质量为2g,若装满O2为17g,则此容器的体积为_____例题分析D11.2L\n2、有关摩尔质量的计算M=—mnM=22.4×ρ(气体,标况)M1=M2×D(气体,D为相对密度)—m1m2M1M2—=(n相等)M=NA·ma(ma为一个原子的质量)M(混)=M1·x1+M2·x2(x为物质的量分数或体积分数)\n例题分析1.某元素一个原子的质量为ag,又知一个C-12原子的质量为bg,则该原子的相对原子质量可表示为()A.12a/bB.12aC.NA·aD.b/12aAC\n2.CH4和CO的混合气体的密度是同温同压下氢气的10倍,混合气体的平均摩尔质量为_________,混合气体中CH4所占的质量分数为______.3.按体积比为4:3:3所组成的N2、O2、CO2混合气体68g在标准状况下的体积为_______例题分析20g·mol-153.3%44.8L\n3、有关溶液浓度的计算质量分数ω=——×100%S100+S(饱和溶液)物质的量浓度ω=——×100%m(质)m(液)[m(液)=m(质)+m(剂)]CB=—nBVρ=—mV1000mLρωCB=——————1LMC(浓)V(浓)=C(稀)V(稀)S=——×100m(质)m(剂)\n1.下列溶液中Cl-的浓度最大的是()A.20mL2mol·L-1氯化镁溶液B.1000mL2.5mol·L-1氯化钠溶液C.50mL1mol·L-1氯化铝溶液D.300mL5mol·L-1氯酸钾溶液A2、50mL2mol·L-1的硫酸溶液中,加入50mL水,下列说法中正确的是()A.混合溶液的物质的量浓度为1mol·L-1B.溶合液中含有0.2molH2SO4C.混合液中的体积恰好为100mLD.无法正确计算混合液的物质的量浓度D3.将标准状况下的aLHCl(气)溶于1L水中,所得盐酸溶液的密度为dg·cm-3,则该盐酸溶液的物质的量浓度为__________\n4.在t℃时,ag某化合物饱和溶液的体积为bmL。将其蒸干后得到cg摩尔质量为dg/mol的不含结晶水的固体物质。计算:1)此物质在t℃时的溶解度;2)在t℃时此化合物的饱和溶液中溶质的物质的量浓度。\n5.若以w1和w2分别表示浓度为amol·L-1和bmol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)()A.2w1=w2B.2w2=w1C.w2>2w1D.w1