- 1.05 MB
- 2022-08-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
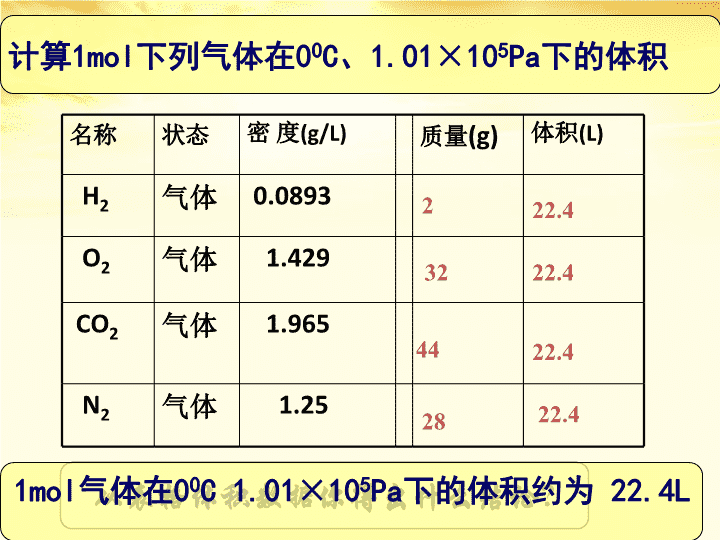
气体摩尔体积第二课\n1、复习上节课内容物质的量(n)微粒数(N)÷NA物质的质量(m)÷M2、1mol任何物质的质量,我们可以通过摩尔质量求出,那么1mol物质的体积,我们如何求算?V=m/ρn==NNAMm\n计算1mol下列气体在00C、1.01×105Pa下的体积名称状态密度(g/L)质量(g)体积(L)H2气体0.0893O2气体1.429CO2气体1.965N2气体1.25222.43222.44422.42822.4从表格体积数据你得出什么结论?1mol气体在00C1.01×105Pa下的体积约为22.4L\n固体物质1mol铁7.2cm31mol铝10cm31mol铅18.3cm31005053.6cm3100501mol水18.0cm31mol硫酸物质状态密度体积Fe固体7.8g/ml7.2mlAl固体2.7g/ml10mlH2O液体1g/ml18mlH2SO4液体1.83g/ml53.6ml液体物质1mol固体和液体物质在200C、1.01×105Pa下的体积在相同状态下,1mol不同的固态或液态物质,体积不同。\n影响物质体积的因素从微观的角度\n粒子数目因素一\n粒子的大小因素二\n粒子之间的距离因素三\n相同状况下,固体、液体、气体分子间距离比较图液体气体固体构成固态、液态物质结构微粒间的距离很小构成气态结构微粒间的距离也小紧密\n固体或液体变为气体,分子间距离的变化。\n固体或液体变为气体,分子间距离的变化。\n【小结】气体分子间的平均距离要比固体和液体中粒子之间的平均距离大得多。20℃1molH2O(18mL)100℃1molH2O(g)(3.06×104mL)(体积扩大约1700倍)\n固体、液体的体积粒子的数目粒子本身大小主要决定于气体的体积粒子的数目粒子间的平均距离\n气体同温同压下:1、分子数目2、分子本身大小3、分子间距离结论:同温同压下1mol气体的体积约相等其中:标准状况下1mol气体的体积约为22.4L相等忽略相等1mol00C、1.01×105Pa\n气体摩尔体积:定义:可表示为:Vm=V/n单位:L/mol或L·mol-1标况下气体摩尔体积约为22.4L/mol。符号:Vm单位物质的量的气体所占的体积为气体摩尔体积。=VVmn=NNAMm=00C、1.01×105Pa\n[练习]1.标准状况下,1mol任何物质的体积都约是22.4L。(错,物质应是气体)2.1mol任何气体的体积约为22.4L。(错,应标明条件-标准状况)3.标准状况下,1molO2和N2混合气体的体积约为22.4L。(对,气体体积与分子种类无关)\n(6)22.4L气体所含分子数一定大于11.2L气体所含的分子数。(错,未指明气体体积是否在相同条件下测定)(错,“约为”;单位应为L/mol)(4).标准状况下,气体的摩尔体积都是22.4L。(5)1mol氧气、水、硫酸在标准状况下所含分子数相同。(对、分子数与物质状态无关)[练习]\n同温、同压下,相同体积的任何气体含有相同数目的分子。3、阿伏加德罗定律二、阿伏加德罗定律及推论1、理想气体状态方程PV=nRT=2、推论(1)同温、同压:(2)同温、同体积:V1/V2=n1/n2,P1/P2=n1/n2\nH2O2下面就请同学们完成P13科学探究结论在相同状态下,1mol气体的体积基本相同\n\n此课件下载可自行编辑修改,供参考!感谢您的支持,我们努力做得更好!