- 992.50 KB
- 2022-08-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
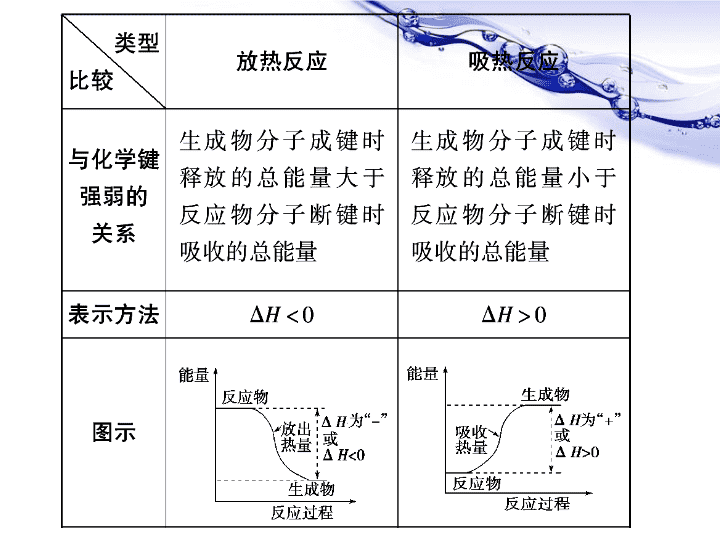
高中化学必修2第二章《化学反应与能量》复习第一节化学能与热能第二节化学能与电能第三节化学反应的速率和限度巴东三中高一化学备课组\n放热反应与吸热反应放热反应与吸热反应比较\n\n\n特别提醒:(1)物质键能越小,破坏它需要的能量就越小,稳定性越弱,说明本身具有的能量越高;反之物质键能越大,破坏它需要的能量就越大,稳定性越强,说明本身具有的能量越低。(2)ΔH=反应物键能总和-生成物键能总和。\n1、下列说法正确的是()A.需要加热才能发生的反应一定是吸热反应B.任何放热反应在常温条件下一定能发生反应C.反应物和生成物所具有的总能量决定了反应结果是放热还是吸热D.吸热反应在一定条件下也能发生反应CD\n燃烧热与中和热的比较燃烧热中和热相同点能量变化放热反应ΔH及其单位ΔH<0,单位均为kJ·mol-1不同点反应物的量可燃物为1mol不一定为1mol生成物的量不确定生成的水为1mol含义101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量在稀溶液里,强酸与强碱发生中和反应生成1mol水时所放出的热量\n中和热的测定1.中和热是反应热的一种,其ΔH<0。2.必须是酸和碱的稀溶液,因为浓酸和浓碱在稀释时会放热。3.只有强酸和强碱的稀溶液才能保证H+(aq)+OH-(aq)===H2O(l)的中和热为57.3kJ/mol,而弱酸和弱碱在中和反应中电离时吸收能量,其中和热一般小于57.3kJ/mol。ΔH=-\n2、下列有关热化学方程式的叙述正确的是()A.已知2H2(g)+O2(g)===2H2O(g)ΔH=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/molB.已知C(s,石墨)===C(s,金刚石)ΔH>0,则金刚石比石墨稳定C.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57.4kJ/molD.已知2C(s)+2O2(g)===2CO2(g)ΔH12C(s)+O2(g)===2CO(g)ΔH2,则ΔH1>ΔH2C\n反应热的计算应注意的问题(1)热化学方程式中化学计量数只表示物质的物质的量,必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。尤其是利用盖斯定律计算反应热时,热化学方程式可以直接相加减,化学计量数必须与ΔH相对应。(2)必须注明物质的聚集状态。气体用“g”,液体用“l”,固体用“s”,溶液用“aq”。热化学方程式中不用“↑”和“↓”。(3)热化学方程式中的反应热是指按所给形式反应完全时的反应热。(4)正、逆反应的反应热数值相等,符号相反。\n3、下列各组热化学方程式中,化学反应的ΔH前者大于后者的是()①C(s)+O2(g)===CO2(g)ΔH1C(s)+1/2O2(g)===CO(g)ΔH2②S(s)+O2(g)===SO2(g)ΔH3S(g)+O2(g)===SO2(g)ΔH4②③④\n定义:将化学能转化为电能的装置构成条件:两极一液一连线判断:正负极和电子流向工作原理:(总的氧化还原反应,电极反应)应用分析常见、简单电池工作原理。比较金属活动性强弱。加快化学反应速率判断溶液pH变化。原电池(从活泼性比较、电子得失、氧化还原反应等多角度判断)设计简单电池。\n氧化反应Zn-2e-=Zn2+铜锌原电池电解质溶液失e,沿导线传递,有电流产生还原反应2H++2e-=H2↑阴离子阳离子总反应:负极正极2H++2e-=H2↑Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑Zn+H2SO4=ZnSO4+H2↑(离子方程式)(化学方程式)电极反应正极:负极:(氧化反应)(还原反应)原电池工作原理:原电池反应的本质是氧化还原反应。\nZnCuZnCuABCDEF1、下列哪些装置能构成原电池?G水果C.D.G\n2、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则这四种金属的活动性顺序由强到弱为。a>c>d>b\n3、如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组()A、A是锌,B是铜,C为稀H2SO4B、A是铜,B是锌,C为稀硫酸C、A是铁,B是银,C为AgNO3溶液D、A是银,B是铁,C为AgNO3溶液ACABD\n4、微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH-2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-根据上述反应式,判断下列叙述中正确的是:()A.在使用过程中,电池负极区溶液的pH减小B.使用过程中,电子由Ag2O极经外电路流向Zn极C.Zn是负极,Ag2O是正极D.Zn电极发生还原反应,Ag2O电极发生氧化反应AC\n总反应:2MnO2+2H2O+Zn=Zn(OH)2+2MnOOH碱性锌锰干电池负极是Zn、正极是MnO2、电解质是KOH正极:2MnO2+2H2O+2e-=2MnOOH+2OH-负极:Zn+2OH--2e-=Zn(OH)2发展中的化学电源\n蓄电池放电过程工作原理正极:PbO2PbO2+2e-+SO42-+4H+=PbSO4+2H2O负极:PbPb-2e-+SO42-=PbSO42PbSO4+2H2OPb+PbO2+2H2SO4放电充电充电电池:二次电池镍镉电池:负极:Cd正极:NiO(OH)电解质:KOH溶液锂电池:可充电的绿色电池负极:锂\n燃料电池负极(Pt):2H2-4e-=4H+正极(Pt):O2+4H++4e-=2H2O电池总反应:2H2+O2=2H2O氢氧燃料电池①(-)Pt│H2│H+│O2│Pt(+)②(-)Pt│H2│OH-│O2│Pt(+)负极(Pt):2H2-4e-+4OH-=4H2O正极(Pt):O2+2H2O+4e-=4OH-电池总反应:2H2+O2=2H2O\n正极反应:O2+2H2O+4e-=4OH-酸性先写总反应:燃料在氧气中的燃烧燃料电池的电极反应的书写若有CO2生成,且电解质为强碱时,考虑CO2+2OH—=CO32—+H2OO2+4H++4e-=2H2O碱性常见燃料:H2、NH3、CO、CH4、CH3OH等\nCH4-O2燃料电池:碱性介质:总的离子方程式为:CH4+2O2+2OH-=CO32-+3H2O负极:CH4+10OH--8e-=CO32-+7H2O正极:2O2+4H2O+8e-=8OH-酸性介质:则总的离子方程式为:CH4+2O2=CO2+2H2O负极:CH4-8e-+2H2O=CO2+8H+正极:2O2+8e-+8H+=4H2O\n\n5、据报道,科学家已经研制出固体氧化物燃料电池,该电池以固体氧化锆、氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,其工作原理如图所示(多孔电极a、b均不参加电极反应)。下列说法正确的是()A.有H2放出的a极为电池的正极B.b极对应的电极反应式为:O2+4e-+2H2O===4OH-C.正极对应的电极反应式为:O2+4H++4e-===2H2OD.该电池的总反应式为:2H2+O2===2H2OD\n化学腐蚀电化学腐蚀定义金属跟接触到的物质直接发生化学反应引起的腐蚀不纯金属(或合金)跟接触到的电解质溶液所发生的原电池反应,较活泼金属原子失去电子被氧化而引起的腐蚀吸氧腐蚀析氢腐蚀条件金属与干燥气体或非电解质直接接触水膜中溶有O2,呈极弱酸性或中性水膜酸性较强\n化学腐蚀电化学腐蚀现象无电流产生有微弱电流产生反应式(以铁腐蚀为例)2Fe+3Cl2===2FeCl3负极:Fe-2e-===Fe2+正极:2H2O+O2+4e-===4OH-正极:2H++2e-===H2↑联系两种腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀更普遍、危害更大\n析氢腐蚀吸氧腐蚀电极反应负极Fe-2e-===Fe2+2Fe-4e-===2Fe2+正极C总反应2H++2e-===H2↑Fe+2H+===Fe2++H2↑O2+2H2O+4e-===4OH-2Fe+2H2O+O2===2Fe(OH)2\n二、金属的防护1.金属的电化学防护(1)牺牲阳极的阴极保护法:应用原理,让被保护金属作极,另找一种活泼性较强的金属作极。原电池正负2.改变金属的内部组织结构制成防腐合金。如不锈钢。3.加保护层如在金属表面喷油漆、涂油脂、电镀、喷镀或使表面钝化等。\n1.相同材质的铁在图中四种情况下最不易被腐蚀的是()C\nC\n化学反应速率1、表示方法∆C:浓度的变化量,常用单位:mol/L(注意气体和溶液都可以用此表示浓度);单位:(1)mol•L-1•S-1,也可写作:mol/(L•S)(2)mol•L-1•min-1,也可写作:mol/(L•min)注意单位中的括号\n注意:①化学反应速率是平均速率而不是瞬时速率。②反应速率比=方程式系数比=浓度变化量比=物质的量变化量比③在同一反应体系中用不同的物质来表示反应速率时,其数值是可以不同的,但是这些数值都表示同一个反应速率。因此化学反应速率的表示必须说明用哪种物质来做标准。④比较同一化学反应的快慢,应取同一参照物.即要将不同物质表示的化学反应速率转化成同一物质表示的化学反应速率。⑤固体和纯液体的浓度视为常数,因此,不能用它们来表示化学反应速率。\n1、4NH3+5O2=4NO+6H2O若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确关系是()A、4/5v(NH3)=v(O2)B、5/6v(O2)=v(H2O)C、2/3v(NH3)=v(H2O)D、4/5v(O2)=v(NO)D\n2、反应A+3B2C+2D在四种不同条件下的反应速率为:(1)v(A)=0.3mol/(L·s)(2)v(B)=0.6mol/(L·s)(3)v(C)=0.2mol/(L·s)(4)v(D)=0.45mol/(L·s)则该反应速率的快慢顺序为—————————。(1)>(4)>(2)>(3)比较反应的快慢,应取同一参照物且单位相同\n3、将1molN2和3molH2混合在1L容器里,反应进行1min后,压强变为原来的75%,求该反应的V(NH3)4、已知合成氨反应一段时间后,氨气的浓度增加到0.6mol/L,V(H2)=0.4mol/(L·s),求反应时间1mol/(L·min)2.25s246XYZtVX+3Z2Y5、确定化学方程式\n影响化学反应速率的因素颗粒大小浓度温度催化剂外因压强内因(主要因素)反应物本身的性质2、温度每升高10℃,反应速率通常增大到原来的2~4倍。\n\n\n6、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率增大的是()A.对该反应体系加热B.改用98%浓硫酸C.不用铁片,改用铁粉D.加适量水BD7、在CaCO3(块状)+2HCl=CaCl2+H2O+CO2的反应中,为了加快反应的速率,下列那些方法可行()A、增加HCl的浓度B、加水C、增加同浓度盐酸的量D、加块状CaCO3练习A\n化学反应限度的定义:一定条件下的可逆反应,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变时,达到化学平衡状态.这就是这个反应所能达到的限度。反应限度的特点:逆等动定变:可逆反应:v正=v逆:v正=v逆≠0:平衡时,各组分浓度保持恒定:条件改变,平衡移动其中“等”和“定”判断化学反应是否处于平衡状态的关键例:N2+3H22NH3高温、高压催化剂任何化学反应都有一定的限度,不同的化学反应限度不同。\n化学平衡的标志:反应速率反应时间v正v逆ν正=ν逆ν正=ν逆反应混合物中各组分的浓度保持不变\n8、一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)2Z(g)一定达到化学平衡状态的是()A.X、Y、Z的物质的量之比为1:2:2B.X、Y、Z的浓度不再发生变化C.容器中的压强不再发生变化D.单位时间内生成nmolX,同时生成2nmolYE.单位时间内生成nmolZ,同时生成2nmolYB\n9、在一定温度下,固定体积的密闭容器内,反应2HI(g)H2(g)+I2(g)达到平衡状态的标志是()A、I2的百分含量不再变化B、生成1molH2同时消耗1molI2C、容器内压强不再变化D、形成2molH—I键同时断裂1molH—H键AB\n10、在密闭容器中进行如下反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的物质的量浓度有可能是()A.Z为0.3mol/LB.Y2为0.35mol/LC.X2为0.2mol/LD.Z为0.4mol/LAB\n再见