- 103.60 KB
- 2022-08-15 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
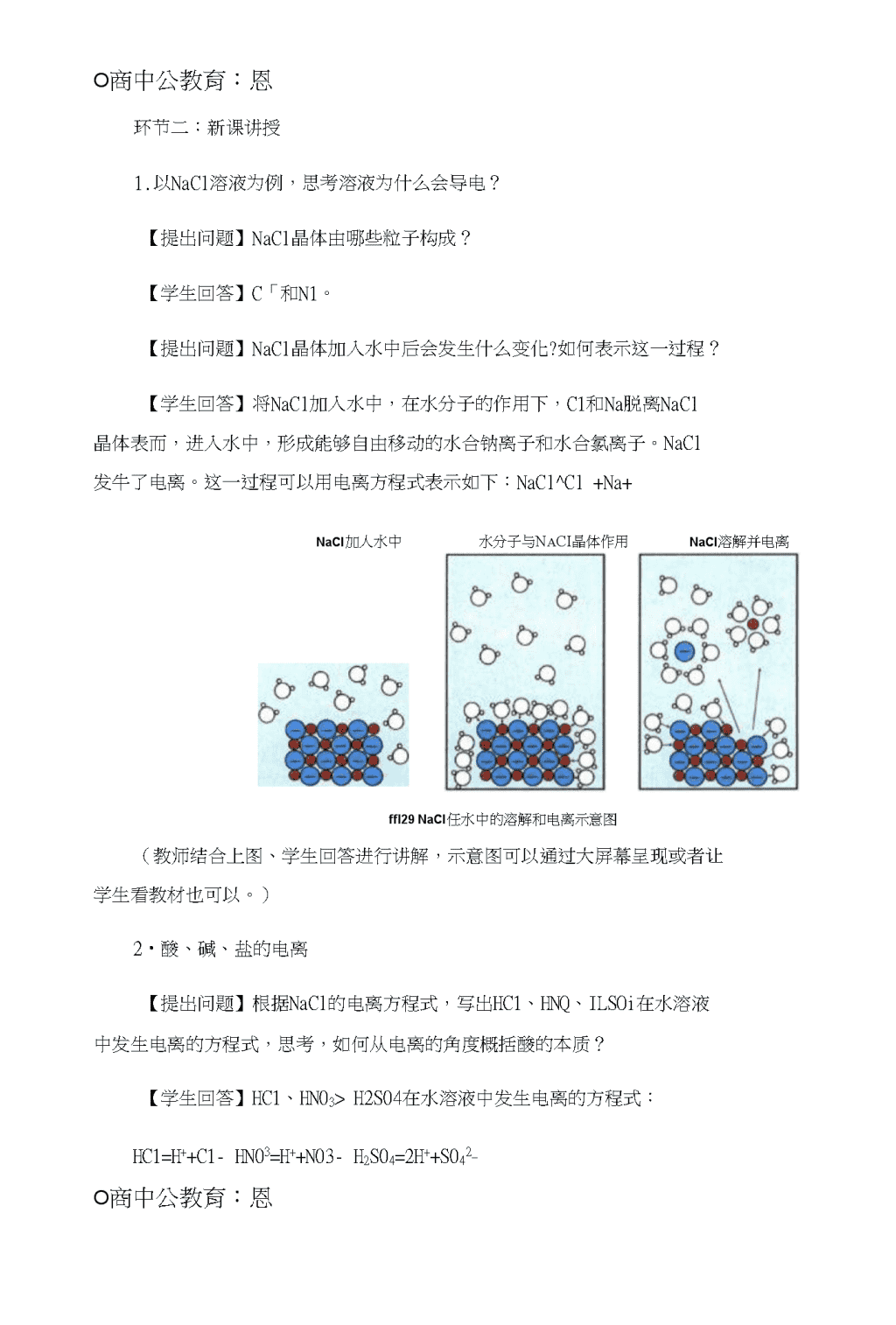
O商中公教育:恩高中化学《离子反应》教案一、教学目标【知识与技能】会书写酸、碱、盐的电离方程式,能从电离的角度重新认识酸碱盐。【过程与方法】通过书写酸碱盐的电离方程式重新认识酸碱盐,学生分析归纳总结能力得到提髙。【情感态度与价值观】学生在学习中感受探究物质奥秘的乐趣,感受化学世界的奇妙。二、教学重难点【重点】电离方程式的书写【难点】从电离的角度认识酸、碱、盐三、教学过程环节一:导入新课【提岀问题】在中学的时候就做过这样一个实验:把连有小灯泡和电源的两个金属片插入不同溶液中,发现有的溶液可以使小灯泡发光,有的则不能,哪些溶液可以使小灯泡发光呢?【学生回答】氯化钠溶液,烧碱溶液,盐酸溶液……都可以使小灯泡发光。【提出问题】为什么氯化钠溶液能够导电?一起来学习“酸、碱、盐在水溶液中的电离”。\nO商中公教育:恩环节二:新课讲授1.以NaCl溶液为例,思考溶液为什么会导电?【提出问题】NaCl晶体由哪些粒子构成?【学生回答】C「和N1。【提出问题】NaCl晶体加入水中后会发生什么变化?如何表示这一过程?【学生回答】将NaCl加入水中,在水分子的作用下,C1和Na脱离NaCl晶体表而,进入水中,形成能够自由移动的水合钠离子和水合氯离子。NaCl发牛了电离。这一过程可以用电离方程式表示如下:NaCl^Cl+Na+NaCl加人水中水分子与NaCI晶体作用NaCl溶解并电离ffl29NaCl任水中的溶解和电离示意图(教师结合上图、学生回答进行讲解,示意图可以通过大屏幕呈现或者让学生看教材也可以。)2•酸、碱、盐的电离【提岀问题】根据NaCl的电离方程式,写出HC1、HNQ、ILSOi在水溶液中发生电离的方程式,思考,如何从电离的角度概括酸的本质?【学生回答】HC1、HN03>H2S04在水溶液中发生电离的方程式:HC1=H++C1-HN03=H++N03-H2S04=2H++S042_O商中公教育:恩\nHC1.HN03、II2S04都能电离出H+,因此,从电离的角度认识酸:电离时牛成的阳离子全部是H+的化合物叫做酸。【提出问题】试着写出NaOH>Ca(0H)2>Ba(0H)2>KOH的电离方程式,思考如何从电离的角度概括碱的本质?【学生回答】NaOH、Ca(0H)2>Ba(0H)2.KOH的电离方程式:NaOH=Na+OH'Ca(OH)2=Ca2++20H'Ba(0H)2=Ba++20HKOH二K+OHNaOH、Ca(0H)2>Ba(0H)2>KOH都能电离出OFT,因此,从电离的角度认识碱:电离时生成的阴离子全部是0H-的化合物叫做碱。【小组活动】列举常见的盐,思考如何从电离的角度定义盐?【学生冋答】小组回答①:根据CuS04>NaN03>MgCl2等的电离方程式,能够电离出金属阳离子和酸根阴离子的化合物叫做盐。(错误答案,该设置的目的是引导学生认识到钱根离子当做金属阳离子对待。)小组冋答②:(讯忘0(、NH4C1也是盐,但是电离出的阳离子不是金属阳离子。小组回答③:盐能电离出的阳离子有金属阳离子、也有钱根离子,电离出的阴离子都是酸根离子。【教师总结】由此可知盐是能够电离出金属阳离子或桜根离子和酸根阴离子的化合物。环节三:巩固提升O商中公教育:恩【提出问题】从电离的角度判断Na2S04.Na2C03.NaHC03是不是盐,它们的电离方程式如何书写?解析:Na2S04>Na2C03>NaHC03的电离方程式:\nNa2S04=2Na++S042_Na2C03=2Na++C032_NaHCO3=Na++HCO32_教师需要讲解NaHC03属于酸式盐,电离吋,电离成金属阳离子和酸式酸根离子。环节四:小结作业请学生冋答本堂课的收获有哪些,可以冋答学到了哪些知识,也可以冋答学习的感受。布置作业:思考NaHSOt的电离方程式该如何书写?酸式盐的电离方程式的书写有什么规律没有?四、板书设计酸.砾盐在水溶液中的电离L电离NaCl=:_+Na'WxAAAAA.2•酸:H-碱:0H-盐:|5B:NH4*s金属阳离子阴:酸根五、教学反思(略)