- 324.03 KB
- 2022-08-15 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
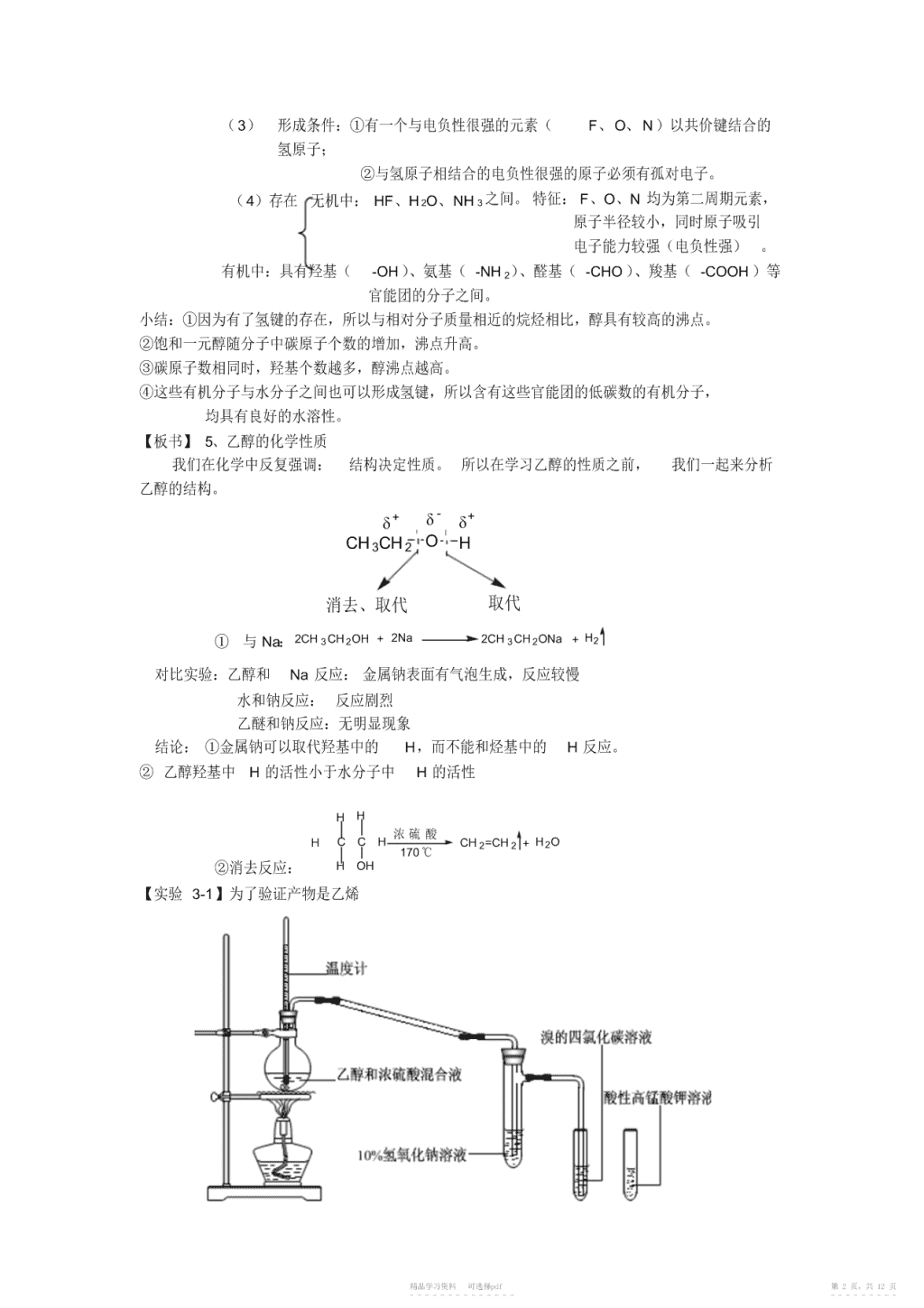
醇酚【重难点】重点:乙醇、苯酚的结构特点和主要化学性质难度:醇和酚结构的差别及其对化学性质的影响【板书】醇:羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇;酚:羟基与苯环直接相连接而形成的化合物称为酚。【Part1】一、醇1、官能团:羟基—OH2、命名(1)普通命名法——用于简单的醇烃基+醇(2)系统命名法:a、选含羟基的最长碳链做主链,称某醇;b、从靠近羟基一端编号;c、羟基的位置用阿拉伯数字表示;个数用“二”“三”表示3、分类一元醇:饱和一元醇通式:CnH2n+1OH,表达式:R—OH如:CH3CH2OHCH2OHCH2OHCHOH按羟基的数目二元醇如:CH2OH如:CH2OH多元醇饱和醇醇按烃基的种类脂肪醇不饱和醇芳香醇CHCHCHOH伯醇322CH3CH3CHCH3CH3CCH3按α碳的种类仲醇OHOH叔醇【板书】4、氢键(1)定义:氢原子与电负性的原子X(F、O、N)以共价键结合时,共用的电子对强烈地偏向X的一边,使氢原子带有部分正电荷,能再与另一个电负性高而半径较小的原子Y(F、O、N)结合,形成的X—H┅Y型的键。(2)机理:由于氧吸电子能力较强原子且原子半径较小,O因此氧原子上有很大的电子云密度,而由于H-O键的共用HH电子对偏向于氧原子,氢原子变成接近“裸露”的质子,OHH这种氢核由于体积较小,又不带内层电子,不易被其他原OO子的电子云所排斥,所以它还与另一个分子中的氧原子中HHHH的孤对电子产生相互吸引力。精品学习资料可选择pdf第1页,共12页-----------------------\n(3)形成条件:①有一个与电负性很强的元素(F、O、N)以共价键结合的氢原子;②与氢原子相结合的电负性很强的原子必须有孤对电子。(4)存在无机中:HF、H2O、NH3之间。特征:F、O、N均为第二周期元素,原子半径较小,同时原子吸引电子能力较强(电负性强)。有机中:具有羟基(-OH)、氨基(-NH2)、醛基(-CHO)、羧基(-COOH)等官能团的分子之间。小结:①因为有了氢键的存在,所以与相对分子质量相近的烷烃相比,醇具有较高的沸点。②饱和一元醇随分子中碳原子个数的增加,沸点升高。③碳原子数相同时,羟基个数越多,醇沸点越高。④这些有机分子与水分子之间也可以形成氢键,所以含有这些官能团的低碳数的有机分子,均具有良好的水溶性。【板书】5、乙醇的化学性质我们在化学中反复强调:结构决定性质。所以在学习乙醇的性质之前,我们一起来分析乙醇的结构。+δ-+δδCH3CH2OH消去、取代取代①与Na:2CH3CH2OH+2Na2CH3CH2ONa+H2对比实验:乙醇和Na反应:金属钠表面有气泡生成,反应较慢水和钠反应:反应剧烈乙醚和钠反应:无明显现象结论:①金属钠可以取代羟基中的H,而不能和烃基中的H反应。②乙醇羟基中H的活性小于水分子中H的活性HH浓硫酸HCCHCH2=CH2+H2O170℃②消去反应:HOH【实验3-1】为了验证产物是乙烯精品学习资料可选择pdf第2页,共12页-----------------------\n步骤:在长颈圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20mL,放入几片碎瓷片,以免混合液在受热时暴沸。加热混合液,使液体温度迅速上升到170℃,将生产的气体通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察并记录实验现象。装置解读:①浓硫酸的作用:催化剂、脱水剂、吸水剂;②温度计的水银球在页面一下;③碎瓷片:防止暴沸④长直导管的作用:导气;冷凝挥发出的乙醇蒸汽(乙醇也可以使酸性高锰酸钾溶液褪色);⑤氢氧化钠溶液的作用:吸收乙醇;吸收SO2和CO2;操作要点:①加入药品顺序:注酸入醇;②大火加热,使液体温度迅速上升到170℃,分子内脱水生成乙烯;140℃时,发生副反应,分子间脱水生成乙醚。浓硫酸2CH3CH2OHCH3CH2OCH2CH3+H2O140℃现象解释:①烧瓶中液体颜色变深:发生了碳化,碳化产物有:C、CO2、SO2;②溴的四氯化碳溶液褪色:产物乙烯发生了加成反应;③酸性高锰酸钾溶液褪色:产物乙烯被氧化乙醇在不同温度下的脱水反应说明了反应物在不同反应条件下可生成不同的产物。【讨论】溴乙烷和乙醇的消去反应有何异同?CH3CH2BrCH3CH2OH反应条件NaOH乙醇溶液,加热浓硫酸,170℃化学键的断裂C—Br、C—HC—O、C—H化学键的生成C=CC=C反应产物CH2=CH2、NaBr、H2OCH2=CH2、H2O③取代:C2H5OH+HBrC2H5Br+H2O制备溴乙烷(也可以乙烯与溴化氢加成)2C2H5OH+2NaBr+H2SO4浓Na2SO4+2CH3CH2Br+2H2O(75%)④氧化:在有机化学反应中,通常把有机物分子中失去氢原子或加入氧原子的反应叫做氧化反应;把加入氢原子或失去氧原子叫做还原反应。点燃燃烧:CH3CH2OH+3O22CO2+3H2O点燃CxHyOz+(x+y/4-z/2)O2xCO2+y/2H2OCu或Ag2CH3CH2OH+O22CH3CHO+2H2O催化氧化:断键位置:①③说明:醇的催化氧化是羟基上的H与α-H脱去下列饱和一元醇能否发生催化氧化,若能发生,写出产物的结构简式CH3OHCH3CH3CCH2CHCH3CH3COHCH3CH3(CH2)5CH2OHCH3精品学习资料可选择pdf第3页,共12页-----------------------\nABC结论:伯醇催化氧化变成醛仲醇催化氧化变成酮叔醇不能催化氧化强氧化剂氧化:酸性高锰酸钾溶液5CH3CH2OH+4KMnO4+6H2SO45CH3COOH+4MnSO4+2K2SO4+11H2O酸性重铬酸钾溶液3CH3CH2OH+2K2Cr2O7+8H2SO43CH3COOH+2K2SO4+2Cr2(SO4)3+11H2O【实验3-2】在试管中加入少量重铬酸钾酸性溶液,然后迪加少量乙醇,充分振荡。观察并记录实验现象。[O][O]CH3CH2OHCH3CHOCH3COOH浓硫酸CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O⑤酯化:第二课时酚【板书】二、酚苯酚——最简单的一元酚1、结构和组成OHOHOHCCHCH分子式:C6H6O结构简式:HC简写为:、或C6H5OHCH特点:所有原子共平面HC官能团:羟基—OH2、物理性质:性状:无色晶体,放置时间较长的苯酚是粉红色的(因为被空气中的O2氧化了)气味:特殊气味熔点:43℃→易挥发溶解性:易溶于有机溶剂;室温下,在水中溶解度为9.3g,当温度高于65℃时,能溶与水混溶毒性:有毒,对皮肤有腐蚀性(沾到皮肤上,立即用酒精洗涤)消毒、杀菌【实验3-3】实验现象现象解释向盛有少量苯酚晶体的无色晶体、或粉红色晶苯酚不完全溶解于水试管中加入2mL,蒸馏体,加入水后得到白色水,振荡试管浑浊的液体向试管中逐滴加入5%的溶液由浑浊变澄清OHONa+NaOH+H2ONaOH溶液并振荡试管苯酚的羟基显示出了酸性再向试管中加入稀盐酸溶液再次浑浊ONaOH+HCl+NaCl精品学习资料可选择pdf第4页,共12页-----------------------\n苯酚的酸性弱于盐酸3、化学性质:①弱酸性:又名石炭酸O-OH++HOHONa+NaOH+H2OONaOH+HCl+NaCl-[思考]如果向澄清的苯酚钠溶液中通入CO2,会看到那些现象?[参考]先看到溶液由澄清变浑浊,一段时间后,也不会变澄清。ONaOH+CO2+H2O+NaHCO3OH酸性很弱,不能使酸碱指示剂变色。酸性:H2CO3>>HCO3由于受苯环的影响,对比于醇羟基,酚羟基上的氢原子的活性,明显增强了许多,甚至表现出了弱酸性。羟基氢的活性:醇<水<酚<酸OHONa2+2Na2+H2②与活泼金属:OHOOCCH3浓硫酸+CH3COOH+H2O③酯化:【过渡】我们在学习苯的同系物的时候,知道苯环和苯环上的取代基是相互影响,使得彼此都变得活泼了。那么酚是不是也有这样的情况呢?【实验3-4】向少量苯酚稀溶液的试管里逐滴加入饱和溴水,边加边振荡,观察并记录实验现象。现象:有白色沉淀生成。OHOHBrBr+3Br2(饱和)+3HBr④取代+Br2:Br注意:只发生在邻、对位;该反应非常灵敏,可用于苯酚的定性和定量检测。该反应的反应条件:饱和溴水;对比与苯和溴发生反应的条件:液溴、Fe/FeBr3作催化剂来说温和了许多,这是由于羟基对苯环的影响。OHOHO2NNO2浓H2SO4+3HNO3+3H2O⑤硝化:NO2精品学习资料可选择pdf第5页,共12页-----------------------\nOHOH一定条件+3H2⑥加成+H2:⑦氧化:与空气(O2):现象:粉红色+与KMnO4(H):现象:酸性高锰酸钾溶液褪色⑧与FeCl3的显色反应:紫色3+【复习】Fe的检验方法:KSCN:血红色苯酚:紫色NaOH:红褐色沉淀OHOHO一定条件H[CH2]nOHn+nHCH+(n-1)H2O⑨缩聚(制电木):【拓展】电木的化学名称叫酚醛塑料(酚醛树脂)酚的化学性质(1)弱酸性:由于苯环对羟基的影响,使苯酚中的羟基能发生微弱电离-—+OH—OH+所以苯酚能够与NaOH溶液反应:A.与NaOH溶液的反应—OH—ONa+NaOH+H2O苯酚钠(易溶于水)所以向苯酚的浊液中加入NaOH溶液后,溶液变澄清。苯酚的酸性极弱,它的酸性比碳酸还要弱,以致于苯酚不能使紫色石蕊试剂变红,B.苯酚的制备(强酸制弱酸)—ONa—OH+H2O+CO2+NaHCO3-注意:产物是苯酚和碳酸氢钠这是由于酸性:H2CO3>苯酚>HCO3—ONa—OH+HCl+NaCl(2)苯酚的溴化反应苯酚与溴水在常温下反应,立刻生成白色沉淀2,4,6-三溴苯酚OHOHBrBr+3Br2↓+3HBr2,4,6-三溴苯酚该反应可以用来定性检验苯酚也可以用来定性测定溶液中苯酚的含量Br(3)显色反应3+酚类化合物与Fe显紫色,该反应可以用来检验酚类化合物。精品学习资料可选择pdf第6页,共12页-----------------------\n醛【重难点】重点:乙醛的结构特点和主要化学性质难点:乙醛与银铵溶液、新制Cu(OH)2反应的化学方程式的正确书写【引入】在上一节我们讲乙醇的氧化剂氧化的时候,提到了乙醇被氧化剂分步氧化,其中,乙醇首先被氧化成了一种叫乙醛的物质。今天我们就来学习醛。【板书】一、醛1、定义:醛是由烃基与醛基相连而构成的化合物。2、表达式:R-CHO3、官能团:-CHO醛基4、分类饱和醛H3CCHO脂肪醛按烃基种类不饱和醛H2CCHCHOCHO芳香醛CH3CH2CH2CHO按醛基的数目一元醛二元醛OHCCHO饱和一元醛通式:CnH2nO5、命名:普通命名法:与醇相似。CH3CH2CH2CHOCH3CHCHOCH3CH3【举例】正丁醛异丁醛苯甲醛系统命名法:①脂肪醛:选含有醛基的最长连续碳链为母体,称为某醛。芳香醛:以脂肪醛为母体,芳基作为取代基。②由于醛基总是在碳链的一端,所以不用编号。CH3CH2CHCHOCH3CHCHCHOCH2CH2CHOCH3【举例】2-甲基丁醛2-丁烯醛3-苯基丙醛注意:醛基的写法:在右端“—CHO”,在左端“OHC—”二、代表:甲醛、乙醛甲醛:①物性:无色,刺激性气味,气体,易溶于水②用途:有机合成原料;35%-40%的水溶液又称福尔马林:消毒、杀菌③分子组成与结构:分子式:CH2O,O结构式:HCHO结构简式:HCHO或HCH精品学习资料可选择pdf第7页,共12页-----------------------\n特点:所有原子公平面乙醛:①物性:无色,刺激性气味,液体,密度小于水,沸点是20.8℃,易挥发,易燃烧,与水、乙醇互溶②分子组成与结构:分子式:C2H4OHOHCCH结构式:HO结构简式:CH3CHO或CH3CH等效氢:两种P56核磁共振氢谱三、化学性质1、加成:催化剂CH3CHO+H2CH3CH2OH+H2:(还原反应)CH催化剂CH3CHOH3CHO+HCN+HCN:CN2、氧化:【实验3-5】P57在洁净试管中加入1mL2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止,制得银铵溶液。再滴入3d乙醛,振荡后将试管放在热水中温热。观察并记录实验现象。现象:①向AgNO3溶液中滴加稀氨水的过程中:溶液先生成白色沉淀,然后沉淀溶解。【板书】①银镜反应解释:a、AgNO3+NH3·H2O===AgOH↓(白色)+NH4NO3b、AgOH+2NH3·H2O===Ag(NH3)2OH+2H2O氢氧化二氨合银(银铵溶液)溶于水;弱氧化剂②加热后有银镜生成。解释:c、CH2Ag(NH3)2OH水浴加热CH3COONH4+3NH3+2Ag+H2O3CHO+——银镜反应(可用于醛基的检验)工业制镜或保温瓶胆【强调】通过离子方程式的书写说明:银镜反应在碱性条件下才能发生++Ag+NH3·H2O===AgOH↓+NH4+-AgOH+2NH3·H2O===Ag(NH3)2+OH+2H2O(络离子很稳定)+--+CH3CHO+2Ag(NH3)+2OH水浴加热CH3COO+NH4+3NH3+2Ag+H2O【实验3-6】P57在试管里加入10%的NaOH溶液2mL,滴入2%的CuSO4溶液4~6d,得到新制的氢氧化铜,振荡后加入乙醛溶液0.5mL,加热。观察实验现象。现象:①有蓝色絮状沉淀生成【板书】②新制的Cu(OH)2悬浊液解释:2NaOH+CuSO4===Cu(OH)2↓(蓝色)+Na2SO4精品学习资料可选择pdf第8页,共12页-----------------------\n弱氧化剂②加热后有砖红色沉淀生成解释:CH3CHO+2Cu(OH)2CH3COOH+Cu2O(砖红色)+2H2O——(可用于醛基的检验)【强调】通过离子方程式的书写说明:该反应在碱性条件下才能发生-2+2OH+Cu===Cu(OH)2↓2+-CH3CHO+2Cu+2OHCH3COOH+Cu2O(砖红色)+2H2O【板书】③O2、Br2或KMnO4等强氧化剂氧化催化剂2CH3CHO+O22CH3COOH+O2:+Br+H2OCH3COOH+HBr+Br2:CH3CHO2+KMnO4:5CH3CHO+2KMNO4+3H2SO45CH3COOH+2K2SO4+2MnSO4+3H2O【小结】从以上对乙醛的学习能够看出:乙醛既能被氧化成乙酸,也能被还原成乙醇,说明乙醛既有还原性、又有氧化性;从乙醛发生氧化反应和还原反应的条件来看,说明乙醛的还原性强于氧化性。醛类的性质与乙醛的非常相似,但是其中甲醛的结构比较特殊,所以会发生分步反应:3、乙醛的制取(工业制法)法一:乙炔水化法HCCH+H催化剂2OCH3CHO法二:乙烯氧化法2CH2CH2+O2催化剂2CH3CHO【小结】HX催化剂NaOH水溶液Cu或Ag或CuO作催化剂Cu(OH)2烯烃卤代烃醇醛酸HX催化剂H2作催化剂NaOH醇溶液羧酸酯一、羧酸1、定义:羧酸是羧基跟烃基直接相连的脂肪酸和芳香酸。O⑴特征官能团:或COOHCOHO⑵最简单的羧酸:HCOH甲酸概念二.乙酸精品学习资料可选择pdf第9页,共12页-----------------------\n1.乙酸的物理性质乙酸又叫醋酸,无色冰状晶体(所以又称冰醋酸),溶点16.6℃,沸点117.9℃。有刺激性气味,易溶于水。2.乙酸的分子结构⑴化学式:C2H4O2O⑵结构式CH3COHO⑶官能团:COH⑷结构简式:CH3COOH【讲解】乙酸是极性分子,分子中共有两种氢原子,分别是羧基和甲基中的氢原子。1.乙酸的化学性质(1)乙酸的酸性++CH3COOH→CH3COO+Ha.与Na2CO3溶液反应2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2Ob.与金属反应Mg+2CH3COOH→(CH3COO)2Mg+H2↑c.酸性比较:CH3COOH>H2CO3>C6H5OH(2)酯化反应定义:醇和含氧酸起作用,生成酯和水的反应叫做酯化反应。a.反应机理:醇脱氢原子,羧酸脱羟基结合生成水。b.酯化反应可看作是取代反应,也可看作是分子间脱水的反应。[试验]。乙酸乙酯的制备精品学习资料可选择pdf第10页,共12页-----------------------\n实验注意事项:1)、加药品的先后顺序:乙醇、浓硫酸、冰醋酸。2)、浓硫酸的作用:催化剂(加快反应速率)、吸水剂(使可逆反应向生成乙酸乙酯的方向移动)。3)、加热的目的:加快反应速率、及时将产物乙酸乙酯蒸出以利于可逆反应向生成乙酸乙酯的方向移动。(注意:加热时须小火均匀进行,这是为了减少乙醇的挥发,并防止副反应发生生成醚。)4)、导气管伸到饱和碳酸钠溶液液面上的目的:防止受热不均引起倒吸。三.酯1.概念:酸跟醇作用脱水后生成的化合物4.乙酸乙酯的分子结构化学式:C4H8O2结构简式:CH3COOCH2CH3①水解反应浓硫酸CH3COOC2H5+H2O△CH3COOH+C2H5OH实质:酸加羟基醇加氢精品学习资料可选择pdf第11页,共12页-----------------------\n△CH3COOC2H5+NaOHCH3COONa+C2H5OH②燃烧——完全氧化生成CO2和水不能使KMnO4酸性溶液褪色。CH3COOCH2CH3+O2点燃CO2+H2O小结:精品学习资料可选择pdf第12页,共12页-----------------------