- 1.97 MB
- 2022-08-15 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
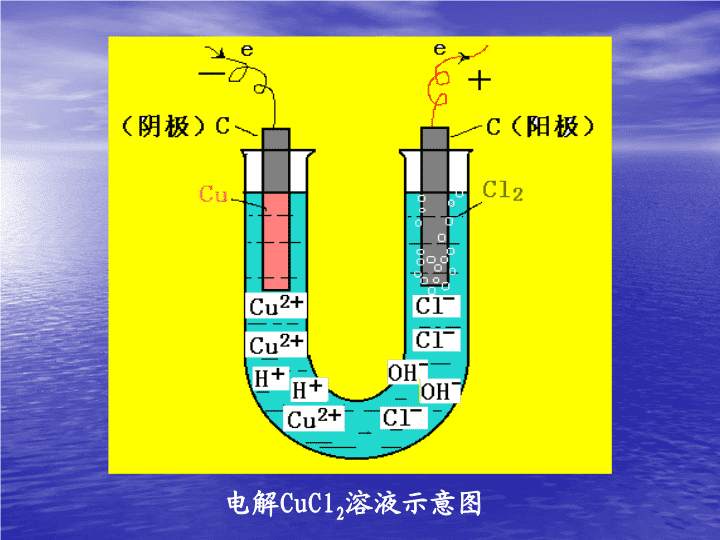
电解原理及其应用\n电解CuCl2溶液示意图\n1、电解:使电流通过电解质溶液(或熔化的电解质)而在阴阳两极引起氧化还原反应的过程。一、电解原理2.电解池-----电能转化为化学能的装置\n3、构成电解池的条件:(1)直流电源;(2)与电源相连的两个电极(一般为惰性电极C、Pt等);阳极-----跟直流电源正极相连的电极阴极-----跟直流电源负极相连的电极(3)电解质溶液或某些熔融态电解质;(4)形成闭合回路。\n电解池的工作原理:①通电前:CuCl2=Cu2++2Cl—,Cu2+、Cl—为自由移动的离子;②通电后:Cu2+移向阴极得到电子,Cl—移向阳极失去电子;-+阴极阳极\n③电极反应:阳极:2Cl—-2e—=Cl2↑(氧化反应)阴极:Cu2++2e—=Cu(还原反应)总反应式:CuCl2Cu+Cl2↑电解由此总结:电解池的工作原理\n电解氯化铜溶液微观模拟\nCu2+oooooooooooooooooooo-+-+阴极阳极CuCl2ooooooooooooooooooooooo电解氯化铜溶液实验装置e-e-单击电子流动\n4.电解池的工作原理阳极:溶液中阴离子----阳极失电子----电子流向电源正极----发生氧化反应阴极:电子从电源负极----阴极----溶液中阳离子得电子----发生还原反应电解质的导电过程,就是该溶液的电解过程。规律:阳氧阴还\n5、阴阳离子的放电顺序(以惰性电极电解)放电:阳离子得电子,阴离子失电子的过程思考:CuCL2溶液中还有什么离子?为何得失电子的是Cu2+和CL-?结论:氧化性越强的离子越易得电子,还原性越强的离子越易失电子。\n阴极-----阳离子放电顺序一般按金属活动顺序表若阳极材料为金属(除金、铂外)则电极本身先溶解。K+﹤Ca2+﹤Na+﹤Mg2+﹤Al3+﹤(H+)水﹤Zn2+﹤Fe2+﹤Sn2+﹤Pb2+﹤(H+)酸﹤Cu2+﹤Fe3+﹤Hg2+﹤Ag+(2)阳极-----若为惰性电极,放电顺序为S2->I->Br->Cl->OH->含氧酸根离子(NO3-、SO42-)>F-\n【例】你能否分析一下电解氯化钠水溶液的产物是什么?答:溶液中存在的离子:Na+,H+,Cl-,OH-阳极反应:2Cl--2e-==Cl2↑(氧化反应)阴极反应:2H++2e-==H2↑(还原反应)总方程式:2NaCl+2H2O===2NaOH+H2↑+Cl2↑电解\n分析电解反应的一般思路溶液中存在的离子两极上的电极反应离子的移动方向及放电顺序判断电解池的阴、阳极\n比较项目电解池原电池能量转换电能转化为化学能化学能转化为电能反应能否自发进行不自发自发电极反应阳极,氧化反应失去电子接电源正极作为负极,电子流出极阴极,还原反应获得电子接电源负极作为正极,电子流入极电池内离子的迁移方向阴离子向阳极迁移阳离子向阴极迁移阴离子向负极迁移阳离子向正极迁移\n电离电解完成的条件过程及特点以氯化铜为例相互联系电离与电解的比较电解质溶于水或熔化状态下电解质电离后,再通以直流电电解质电离成为自由移动的离子阴阳离子定向移动,在两极上放电CuCl2=Cu2++2Cl—CuCl2=Cu+Cl2电解电解必须建立在电离的基础上\n电解无氧酸(如:HCl)﹑不活泼金属无氧酸盐(如:CuCl2).实质是电解质本身电解.电解盐酸阳极:2Cl--2e-=Cl2↑阴极:2H++2e-=H2↑总反应:2HCl===H2↑+Cl2↑电解电解CuCl2阳极:2Cl--2e-=Cl2↑阴极:Cu2++2e-=Cu总反应:CuCl2===Cu+Cl2↑电解思考电解过程中溶液的浓度和PH值如何变化?溶液浓度减小,PH值无氧酸-----增大CuCl2-----略减小\n电解含氧酸(如:H2SO4﹑HNO3﹑H3PO4等)﹑活泼金属含氧酸盐(如:Na2SO4﹑KNO3等)﹑强碱(如:NaOH﹑KOH﹑Ca(OH)2﹑Ba(OH)2等)实质上是电解水.阳极产生O2,阴极产生H2阳极:4OH--4e-=2H2O+O2↑阴极:2H++2e-=H2↑思考:电解过程中溶液浓度及PH值如何变化?溶液浓度增大.PH值变化有三种情况含氧酸------减小活泼金属含氧酸盐------不变强碱------增大\n电解不活泼金属的含氧酸盐(如:CuSO4﹑AgNO3等)电解质和水同时电解,阳极产物是O2,阴极产物是析出不活泼金属如:电解CuSO4溶液阳极:4OH--4e-=2H2O+O2↑阴极:Cu2++2e-=Cu总反应:2CuSO4+2H2O===2Cu+O2↑+2H2SO4电解又如:电解AgNO3溶液阳极:4OH--4e-=2H2O+O2↑阴极:Ag++e-=Ag总反应:4AgNO3+2H2O===4Ag+O2↑+4HNO3思考电解过程中溶液浓度和PH值如何变化?浓度减小,PH值减小.电解\n电解活泼金属无氧酸盐(如:NaCl﹑KBr等).电解质和水同时电解.阳极产生非金属,阴极产生H2如:电解食盐水阳极:2Cl--2e-=Cl2↑阴极:2H++2e-=H2↑总反应:2NaCl+2H2O===2NaOH+H2↑+Cl2↑电解思考电解过程中溶液浓度和PH值如何变化?溶液浓度减小,PH增大.\n电解规律(1)电解含氧酸、强碱溶液及活泼金属的含氧酸盐,实质上是电解水。(2)电解不活泼金属的含氧酸盐,阳极产生氧气,阴极析出不活泼金属。(3)电解活泼金属无氧酸盐,阴极产生氢气,阳极析出非金属。(4)电解不活泼金属无氧酸盐(F-除外),实际上是电解电解质本身。\n7电解规律(1)电解含氧酸、强碱溶液及活泼金属的含氧酸盐,实质上是电解水。(电解水型)如:Na2SO4﹑KNO3等.(2)电解不活泼金属的含氧酸盐,阳极产生氧气,阴极析出不活泼金属。实质上是电解水和电解质本身.(放氧生酸型)如:CuSO4﹑AgNO3等.(3)电解活泼金属无氧酸盐,阴极产生氢气,阳极析出非金属。实质上是电解水和电解质本身.(F-除外)(放氢生碱型)如:NaCl﹑KBr等.(4)电解熔融物﹑不活泼金属无氧酸盐(F-除外)﹑无氧酸(除HF),实际上是电解电解质本身。(分解电解质型)如:HCl、CuCl2等.\n电解后溶液的PH变化分析1、H+和OH-均放电——决定原溶液的性质如:电解H2SO4、NaOH、Na2SO42、只有H+放电,而OH-不放电——PH增大如:电解HCl、NaCl3、只有OH-放电,而H+不放电——PH减小如:电解CuSO44、H+、OH-都不放电——PH基本不变(考虑水解及气体溶于水的情况)如:电解CuCl2\n练习1﹑用Pt作电极电解某种溶液,通电一段时间后,溶液的PH值变小,并且在阳极得到0.56L气体,阴极得到1.12L气体(两气体均在相同条件下测定).由此可知溶液可能是()A﹑稀盐酸B﹑KNO3溶液C﹑CuSO4溶液D﹑稀硫酸D\n2﹑用惰性电极电解下列溶液一段时间后,再加入一定量的另一种物质(方括号内),溶液能与原溶液完全一样的是()A﹑CuCl2〔CuSO4〕B﹑NaOH〔NaOH〕C﹑NaCl〔HCl〕D﹑CuSO4〔Cu(OH)2〕C\n类型电解质
组成电解水型分解电解质型放氢生碱型放氧生酸型Ⅰ、K+、Ca2+、Na+、Mg2+、Al3+Ⅱ、Cu2+、Hg2+、Ag+Ⅲ、S2-、I-、Br-、Cl-Ⅳ、OH-、含氧酸根离子、F-ⅠⅣⅡⅢⅠⅢⅣⅡ小结:惰性电极进行溶液电解,电解质组成情况\n练习:1、用惰性电极电解下列溶液一段时间后,再加入一定量的另一种物质(括号内),溶液能与原来溶液完全一样的是()A.CuCl2(CuCl2)B.NaOH(NaOH)C.NaCl(HCl)D.CuSO4(Cu(OH)2)AC2、利用H2O电解制备H2和O2时,为了增强溶液导电性,通常加入一些电解质。下列电解质不能做为试剂加入的是()A.H2SO4B.KNO3C.NaClD.CuSO4CD\n3、用惰性电极电解某溶液时,发现两电极只有H2和O2生成,则电解一段时间后,若电解前后温度变化忽略不计,下列有关溶液的叙述中正确的是()①该溶液的PH可能增大②该溶液的PH可能减小③该溶液的PH可能不变④该溶液的浓度可能增大⑤该溶液的浓度可能减小A.①②③④⑤B.只有①②④⑤C.只有①③⑤D.只有①②③④A\n铜的电解精炼1、铜的冶炼:煅烧孔雀石→CuO2CuO+C==2Cu+CO2↑高温粗铜:含Zn.Fe.Ni.Ag.Au等杂质\n2、铜的精炼阳极:粗铜(含少量Zn﹑Fe﹑Ni﹑Ag﹑Au等)阴极:纯铜电解液:CuSO4溶液(加入一定量的硫酸)阳极:Cu-2e-=Cu2+Zn-2e-=Zn2+Fe-2e-=Fe2+Ni-2e-=Ni2+(Au﹑Ag沉积下来,形成阳极泥)阴极:Cu2++2e-=CuCuSO4溶液浓度基本保持不变-------因阳极上铜溶解的速率与阴极上铜沉积的速率相同.\n电镀1、定义:利用电解原理在某些金属表面镀上一层其他金属或合金的过程.2、目的:增强抗腐蚀能力,增加美观和表面硬度。3、电镀条件:(1)阳极:镀层金属(2)阴极:镀件(待镀金属)(3)电镀液:含镀层金属阳离子的电解质溶液。(4)外加直流电4、反应特征:阳极:Cu(镀层金属)Cu-2e-=Cu2阴极:待镀金属Cu2++2e-=Cu\n\n二、离子交换膜法制烧碱\n3、生产流程\n3、食盐的精制:(1)粗盐的成份:泥沙、Ca2+、Mg2+、Fe3+、SO42-杂质,会与碱性物质反应产生沉淀,损坏离子交换膜;(2)杂质的除去过程:粗盐水含少量Ca2+.Mg2+精制盐水\n想一想(1)BaCl2与NaOH的顺序能不能调换?(2)NaOH与Na2CO3的顺序能不能调换?(3)BaCl2与Na2CO3的顺序能不能调换?能能不能除去杂质时所加试剂的顺序要求是:Na2CO3必须在BaCl2之后,加入盐酸必须在过滤之后试剂加入顺序有多种选择,如:①)BaCl2NaOHNa2CO3过滤盐酸②BaCl2Na2CO3NaOH过滤盐酸③NaOHBaCl2Na2CO3过滤盐酸\n练习:1、在50mL0.2mol/L的硫酸铜溶液中插入两个电极,通电电解(不考虑水分蒸发),则:⑴若两极均为铜片,试说明电解过程中溶液溶质浓度将怎样变化_______________。⑵若阳极为纯锌,阴极为铜片,阳极反应式是_______________________________⑶如果两极均为质量相同的铜片且不考虑H+在阴极上放电当电路中有0.02mol电子通过时,两极相差____g,阴极上的电极反应式是_____________________。不变Zn-2e-=Zn2+1.28Cu2++2e-=Cu\n3、某溶液中含有两种溶质NaCl和H2SO4,其物质的量之比为3:1。用石墨做电极电解该混合液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是()A.阴极自始至终只析出H2B.阳极先析出Cl2,后析出O2C.电解最后阶段为电解水D.溶液pH不断增大,最后为72、用两支惰性电极插入50mLAgNO3溶液中,通电电解。当电解液的PH值从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是()A、2.7mgB、5.4mgC、10.8mgD、21.6mgBD\n4、用石墨电极电解100mLH2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为()A.1mol/LB.2mol/LC.3mol/LD.4mol/LA阳极O2为0.1mol,电子为0.4mol则H2为0.1mol,所以Cu为0.1mol,浓度为0.1/0.1=1mol/L