- 245.00 KB
- 2022-08-17 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
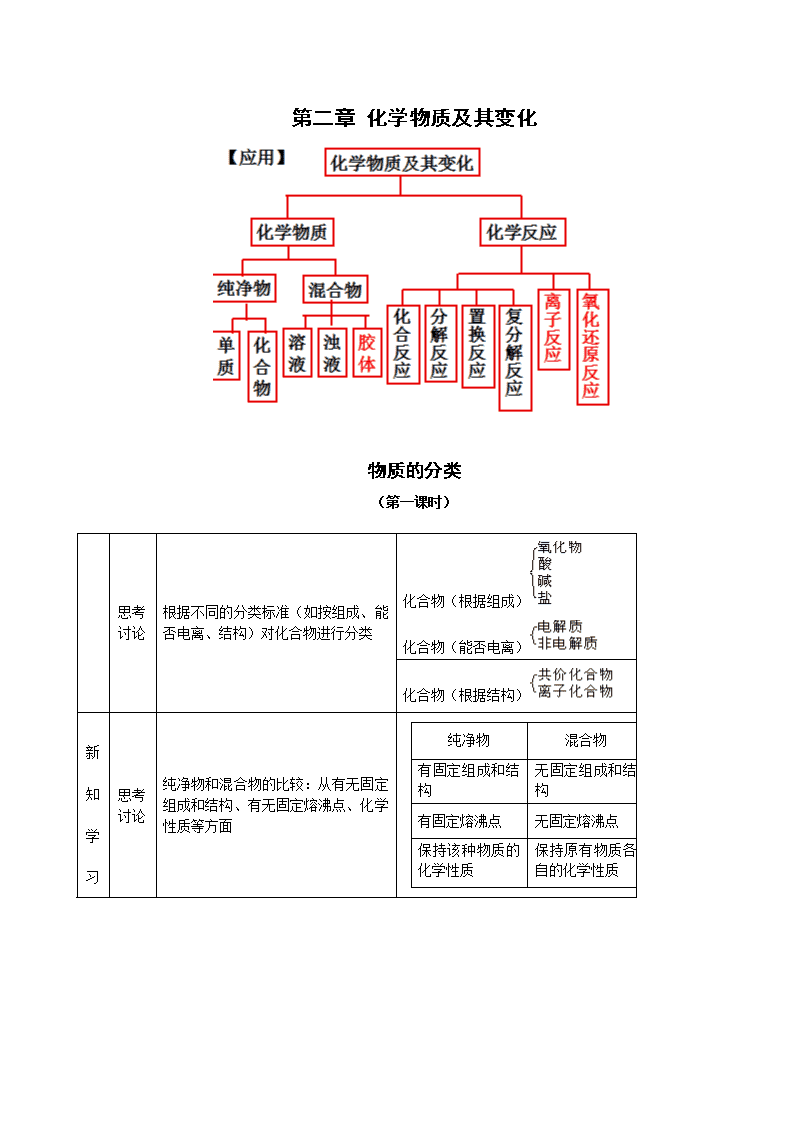
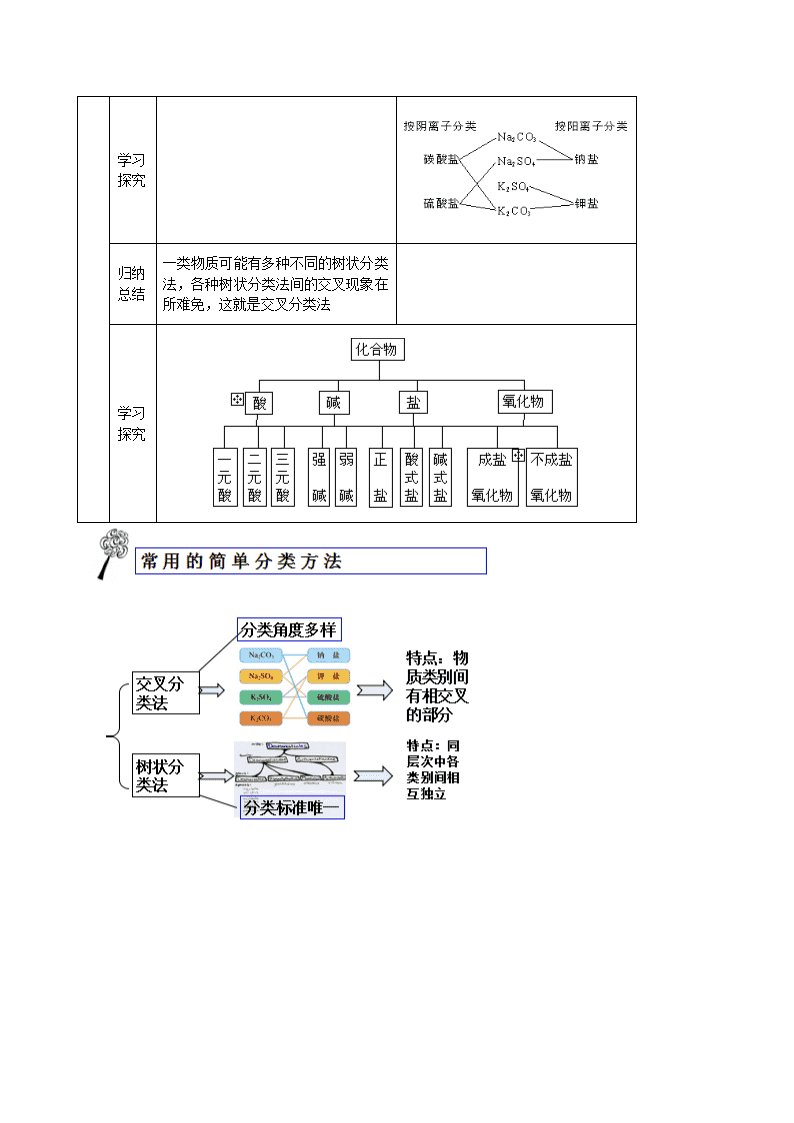
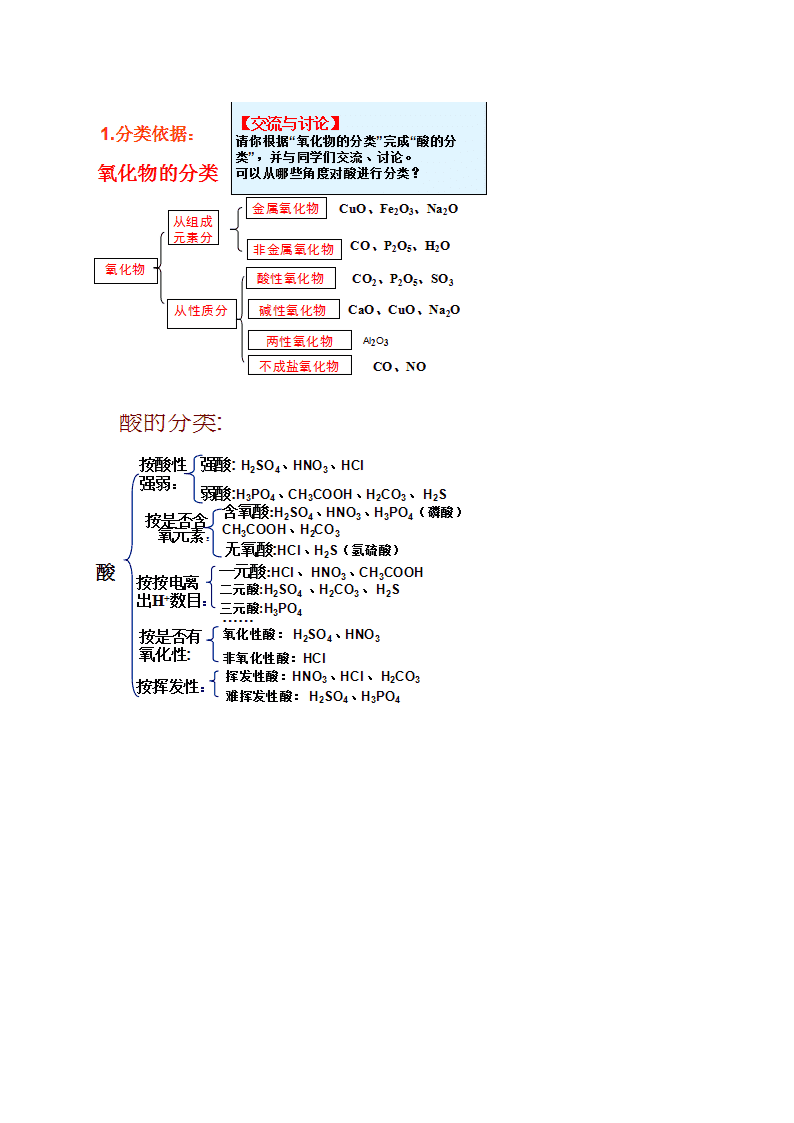
第二章化学物质及其变化物质的分类(第一课时)思考讨论根据不同的分类标准(如按组成、能否电离、结构)对化合物进行分类化合物(根据组成)化合物(能否电离)化合物(根据结构)新知学习思考讨论纯净物和混合物的比较:从有无固定组成和结构、有无固定熔沸点、化学性质等方面纯净物混合物有固定组成和结构无固定组成和结构有固定熔沸点无固定熔沸点保持该种物质的化学性质保持原有物质各自的化学性质\n学习探究归纳总结一类物质可能有多种不同的树状分类法,各种树状分类法间的交叉现象在所难免,这就是交叉分类法学习探究\n\n第一节 物质的分类(第二课时)归纳整理分散系:把一种或多种物质分散在另一种(或多种)物质里所得到的体系。被分散的物质叫分散质,容纳分散质的物质叫分散剂。思考讨论按照分散质和分散剂所处的状态,它们之间的能使方式有哪些,并各举一两例分散质分散剂举例气体气体空气液体气体云、雾固体气体烟灰尘气体液体泡沫液体液体牛奶、酒精溶液固体液体糖水、油漆气体固体泡沫塑料液体固体固体固体有色玻璃、合金归纳小结分散系具有多样性学习探究分散系的分类(按分散质粒子的大小)思考讨论三种分散系性质的比较:分散系分散质粒子大小主要特征粒子能否通过半透膜粒子能否通过滤纸举例浊液>100nm不均一、不稳定不能不能泥浆水溶液<1nm均一、稳定能能盐酸\n胶体1~100nm均一、介稳定不能能蛋清归纳小结1.溶液是常见的一种分散系,溶质是分散质,溶剂是分散剂2.油状物质分散到水中可形成乳浊液;不溶于水的固体分散到水中可形成悬浊液实验探究Fe(OH)3胶体的制备:指导操作操作1:向沸水中滴加少量饱和FeCl3溶液,继续煮沸现象:体系变红褐色操作2:用激光笔分别照射得到的红褐色液体与CuSO4溶液,并进行比较前者:体系中有一条光亮的“通路”后者:溶液中无光亮的“通路”归纳总结丁达尔效应:当光束通过胶体时,在胶体内部产生一条光亮“通路”的现象利用丁达尔效应可以区分溶液和胶体实验探究与上表结论对比:胶体粒子能透过滤纸1.将上述得到的Fe(OH)3胶体和泥浆水进行过滤Fe(OH)3胶体过滤后得到的液体与原体系无明显差异;泥浆水过滤后得澄清透明的液体2.用激光笔照射Fe(OH)3胶体过滤后得到的液体:有丁达尔效应补充:1,胶体的性质:(1)丁达尔效应(2)布朗运动(3)电泳现象(4)胶体的凝聚胶体的凝聚:胶体是一种比较稳定的分散系。由于胶体粒子可以通过吸附而带电荷,同一种胶粒带有相同的电荷,它们之间的相互排斥使得脱粒不容易聚集,胶粒所作的布朗运动也使胶粒不容易聚集成较大的颗粒而沉降。但如果给予一定的条件使胶体中的粒子聚集成较大的颗粒,就会形成从分散系中析出。这个过程 叫胶体的凝聚。通常使胶体凝集的方法有:(1)加热:可使胶粒布朗运动速率加快,胶粒相互碰撞的机会增多,从而使之聚集成较大颗粒而沉降。(2)加入电解质:往胶体中加入某些电解质,由于电解质电离生成的阳离子或阴离子中和了胶粒所带的电荷,使胶体聚集生成沉淀析出。(3)加入胶粒带相反电荷的胶体:不同的胶粒吸附带不同电荷的离子,如金属氢氧化物、金属氧化物吸附阳离子,使胶体带正电荷;非金属氧化物、金属硫化物的胶粒吸附阴离子,使胶粒带负电荷。当两种带相反电荷的胶体混合,也会因胶粒所带电荷发生中和,而使胶体凝聚。巩固练习:1.胶体和其它分散系的本质区别是( )A.分散质粒子的大小 B.是不是一种稳定的体系C.会不会产生丁达尔效应 D.粒子不没有带电荷2.“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥\n静置后会析出黑色沉淀A.①④⑤ B.②③④ C.②③⑤ D.①③④⑥3.下列分散系中分散质的微粒直径属于纳米级的是( )A.溶液 B.悬浊液 C.胶体 D.乳浊液4.下列关于胶体的叙述中,不正确的是( )A.向胶体中加入蔗糖溶液,产生聚沉现象 B.一束可见光透过胶体时,产生丁达尔效应C.用渗析的方法“净化”胶体时,使用的半透膜只能让分子通过D.胶体能够吸附阴离子和阳离子,故在电场的作用下,会产生电泳现象1.下列关于胶体的叙述中正确的是( )A.胶体外观不均匀 B.胶体带电荷,所以会产生电泳现象 C.胶粒能透过滤纸 D.胶体不稳定,静置后容易产生沉淀6.Fe(OH)3胶体带正电荷的原因是( )A.在电场作用下,Fe(OH)3胶粒向阴极定向移动 B.Fe3+带正电荷C.Fe(OH)3带负电荷,吸引阳离子 D.Fe(OH)3胶粒吸附了阳离子7.关于胶体的叙述不正确的是( )A.溶液显电中性,胶体带有电荷 B.胶体能透过半透膜,但不能透过滤纸 C.可用丁达尔效应区分溶液和胶体 D.电泳实验说明了胶体微粒带有电荷8.不能用胶体的知识解释的现象是( )A.豆浆中加入石膏做豆腐 B.一支钢笔使用两种不同牌号的墨水,易出现堵塞C.向FeCl3溶液中加入NaOH溶液,会出现红褐色D.在海水与河水交界处,易形成三角洲9.某胶体遇盐卤或石膏水易发生凝聚,而与食盐水或硫酸钠溶液不易发生凝聚,有关说法不正确的是( )A.胶体粒子直径约为1~100nmB.此胶体粒子带有电荷C.与BaCl2溶液或Fe(OH)3胶体可发生凝聚 D.Na+使此胶体凝聚的效果不如Ca2+、Mg2+10.已知土壤胶体粒子带负电,在土壤中施加含氮质量相同的下列化肥,肥效最差的是( )A.(NH4)2SO4B.NH4HCO3C.NH4NO3D.NH4Cl11.在Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子的作用,使胶体形成了沉淀,这个过程称为_______12.将饱和FeCl3溶液滴入沸水中,液体变为________色,得到的是_________,用此分散系进行下列实验:(1)将其装入U型管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色________,这说明________________,这种现象称为____________(2)向其中加入饱和(NH4)2SO4溶液发生的现象是______________,原因是______________(3)向其中滴入过量稀硫酸,现象是__________________________________________,其原因是______________________________________(4)提纯此分散系常用的方法是_______________________备课参考1.练习答案:1.A2.B3.C4.A5.D6.D7.B8.C9.B10.C11.SO42- 凝聚或聚沉 12.红褐 胶体 (1)加深 胶体粒子带电荷 电泳\n (2)产生沉淀 电解质溶液使胶体发生了凝聚 (3)先出现红褐色沉淀后沉淀溶解 开始加入稀硫酸时,胶体发生聚沉生成Fe(OH)3,当酸过量时,又将Fe(OH)3沉淀溶解第二节离子反应(第一课时)新知学习新知学习实验探究一.酸、碱、盐在水溶液中的电离1.Cu、NaOH、KNO3、蔗糖在下列三种情形下能否导电,为什么?①固体__________②水溶液(Cu除外)_______③熔化_________2.HCl、H2SO4、酒精在下列情形下能否导电,为什么?①液态(纯净物)___________②水溶液_____________Cu在固态或熔化时都能够导电,因为金属中存在自由电子。NaOH、KNO3在固态时不导电,因为阴、阳离子不能自由移动;在水溶液里或熔融状态下能够导电,因为产生了自由移动的离子。HCl、H2SO4作为液态纯净物时,全部由分子构成,不能导电;当溶于水后,在水分子的作用下产生了自由移动的离子,故而能够导电。而蔗糖和酒精在上述情形下都不能够导电,因为二者既不存在自由电子又不能电离产生自由移动的阴、阳离子。\n新知学习归纳思考1.电解质:在水溶液里或熔融状态下能够导电的化合物非电解质:在水溶液里和熔融状态下都不能导电的化合物思考:Cu和NaCl溶液是不是电解质?为什么?归纳整理⑴电解质和非电解质指的都是化合物,应为纯净物⑵单质、混合物既不是电解质也不是非电解质思考交流电解质溶于水或熔化后发生了怎样的变化?2.电离及电离方程式⑴能发生电离的物质类别:______________⑵电离的条件(与通电有无关系):_________________________⑶电离的结果:__________________________⑷电离的定义:__________________________⑸电离的表示方法:______________________酸、碱、盐或电解质溶于水或受热熔化,与通电无关产生了自由移动的离子电解质溶于水或熔化时离解生成自由移动的离子的过程叫做电离电离方程式:用化学式和离子符号来表示电解质电离过程的式子思考交流常见酸、碱、盐的电离情况是怎样的呢?其电离方程式如何书写?思考交流试从电离的角度概括出酸、碱、盐的本质讨论:酸、碱、盐的电离有无共同点?归纳整理⑴.酸:电离时产生的阳离子全部是H+的化合物⑵.碱:电离时产生的阴离子全部是OH-的化合物⑶.盐:电离时,生成金属阳离子(或铵根离子)和酸根离子的化合物应用实践可让学生判断右题以加深对概念的理解已知NaHSO4=Na++H++SO42-,据此判断NaHSO4属于哪类物质?学习探究电解质溶于水形成的溶液与其它溶液有什么本质的区别呢?投影:今有100mL1mol/LAl2(SO4)3溶液①写出Al2(SO4)3的电离方程式________________________________②溶液中阳离子数目为_________,阴离子数目为________________溶液中正电荷总数为___________,负电荷总数为_______________归纳整理4.电解质溶液的特点⑴导电性(存在自由移动的离子)⑵电中性(电荷守恒)补充说明(1)电解质与非电解质的区别电解质非电解质定义在水溶液里或熔融状态下能够导电的化合物在水溶液里和熔融状态下都不能导电的化合物化合物类型离子化合物(强碱、盐),强极性共价化合物非极性共价化合物,弱极性共价化合物、大多数有机物能否直接电离溶于水或熔融时,能直接电离溶于水或熔融时,不能直接电离通电时的现象溶于水或熔融时能导电溶于水或熔融时不能导电实例H2SO4、HF、CaO、CaCO3等CO2、SO3、NH3、CH4等(2)强弱电解质的区别强电解质弱电解质相同点都是电解质,在水溶液中都能电离,都能导电,与溶解度无关不同点电离程度完全电离部分电离电离过程不可逆过程可逆过程,存在电离平衡表示方法电离方程式用“===”电离方程式用“”水溶液中粒子存在形式电离出的阴、阳离子,不存在电解质分子既有电离出的阴、阳离子,又有电解质分子\n实例绝大多数盐:NaCl、BaSO4等强酸:H2SO4、HCl等强碱:Ba(OH)2、Ca(OH)2等弱酸:H2CO3、CH3COOH等弱碱:NH3·H2O、Cu(OH)2等极少数盐:巩固练习1.下列状态的物质,既能导电又属于电解质的是()A.氯化镁晶体B.氯化钠溶液C.液态氯化氢D.熔融氢氧化钾2.下列物质中导电性能最差的是()A.石墨棒B.固体氧化钾C.盐酸D.熔融氢氧化钠3.下列物质在一定条件下能够导电,但不是电解质的是()A.铝B.食盐C.硫酸D.蔗糖4.仅能在水溶液中导电的电解质是()A.KOHB.KNO3C.NH4HCO3D.酒精5.下列物质的水溶液中存在溶质分子的是()A.HClB.NaOHC.Na2CO3D.蔗糖6.下列电离方程式不正确的是()A.H2SO4=2H++SO42- B. NH4NO3=NH4++NO3-C. Na2CO3=Na2+ +CO32- D.Ba(OH)2=Ba2++2OH-7.下列关于电解质的判断中,正确的观点是( )A.在熔融状态下能够导电的物质B.在熔融或溶液中能够导电的物质C.在熔融或溶液中能够导电的化合物D.在熔融和溶液中都能导电的化合物8.下列电离方程式中,正确的是()A.Ca(OH)2=Ca2++2(OH-)B.FeCl3=Fe2++3Cl-B.H2SO4=H2++SO42- D.Al2(SO4)3=2Al3++3SO42-9.设NA为阿伏加德罗常数的值,下列关于0.2mol/LBa(NO3)2溶液不正确的说法是()A.500mL溶液中的阴、阳离子总数为0.3NAB.500mL溶液中NO3-离子浓度为0.2mol/LC.500mL溶液中Ba2+离子浓度为0.2mol/LD.500mL溶液中NO3-离子总数为0.2NA10.在_______中或在_______下能够导电的化合物叫做电解质。电解质溶液之所以能够导电,是由于它们在溶液中发生了___________,产生了________。电离时生成的_______________离子全部是_____的化合物叫做酸;生成的________离子全部是________的化合物叫做碱;生成________和_______的化合物叫做盐。酸与碱发生中和反应的实质是_____________________________________________________。11.下列物质属于电解质的有_______________________①Cu②H2SO4③NaOH④NaCl⑤CaO⑥CO2⑦CaCO3⑧H2备课参考:1.练习答案:1.D2.B3.A4.C5.D6.C7.C8.D9.B10.水溶液熔化电离自由移动的离子阳氢离子阴氢氧根离子金属离子酸根离子酸电离产生的氢离子与碱电离产生的氢氧根离子结合生成水11.②③④⑤⑦\n(第二课时)思考讨论离子方程式用实际参加反应的离子符号来表示反应的式子叫做离子方程式学习探究要求写几个酸碱中和反应的化学方程式并试写它们的离子反应方程式NaOH+HCl=NaCl+H2OKOH+HCl=KCl+H2O2NaOH+H2SO4=Na2SO4+2H2O2KOH+H2SO4=K2SO4+2H2O离子反应方程式都是:H++OH-=H2O总结归纳上述四个中和反应的化学方程式各不相同,但它们的离子方程式却都是相同的,酸碱中和的实质是酸电离出来的H+与碱电离出来的OH-结合生成了H2O学习探究从上例四个中和反应引导不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的离子反应实验探究实验现象结论或解释①Na2SO4溶液+BaCl2溶液产生白色沉淀Ba2++SO42-=BaSO4↓②Na2CO3溶液+HCl溶液放出气泡CO32-+2H+=CO2↑③NaOH溶液(酚酞)+盐酸溶液红色消失H++OH-=H2O归纳总结生成沉淀、放出气体或生成水板书设计二、离子反应发生的条件1.离子反应:2.离子方程式:3.离子反应发生的条件\n巩固练习:1.下列各组反应中,不能用同一个离子方程式表示的是()A.盐酸分别与NaOH溶液、Ca(OH)2溶液反应B.硫酸分别与NaOH溶液、Ba(OH)2溶液反应C.硝酸分别与Na2CO3溶液、K2CO3溶液反应D.锌分别与稀盐酸、稀硫酸反应2.不能用离子方程式CO32-+2H+=CO2↑+H2O表示的是()A.Na2CO3+2HCl=2NaCl+CO2↑+H2OB.NaHCO3+HCl=NaCl+CO2↑+H2OC.K2CO3+H2SO4=Na2SO4+CO2↑+H2OD.K2CO3+2HNO3=2KNO3+CO2↑+H2O3.下列离子方程式错误的是( )A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑B.盐酸与氢氧化钡溶液:H++OH-=H2OC.碳酸钙与稀硝酸:CaCO3+2H+=2Ca2++CO2↑+H2OD.硫酸铜溶液与氢氧化钡溶液:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓4.在pH=1的无色为溶液中,能大量共存的离子组是( )A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、Cl-C.Al3+、MnO4-、SO42-、Cl-D.Na+、Cu2+、Cl-、Ba2+5.对四种无色溶液进行离子检验,检验结果如下,其中明显不正确的是( )A.SO32-、OH-、Cl-、K+ B.Na+、NO3-、OH-、Cl-C.K+、Na+、NO3-、Cl- D.K+、CO32-、H+、Ba2+6.将两种物质的溶液相混合,有魄白色沉淀生成,加入稀硝酸后,沉淀消失并有气泡生成,再加入AgNO3溶液,又生成白色沉淀,则这两种物质是( )A.MgCl2和Na2CO3 B.K2SO4和BaCl2 C.NaOH和CuSO4 D.K2CO3和Ca(NO3)27.离子方程式CO32-+2H+=CO2↑+H2O表示的意义是____________________________________________________________________________________________________________________________________________________________________,写出实现该离子反应的一个化学方程式__________________________________8.某溶液中可能存在下列阴离子:Cl-、SO42-、CO32-中的一种或几种(1)当溶液中存在大量H+时,________________不能在溶液中大量存在(2)当溶液中存在大量Ag+时,________________不能在溶液中大量存在(3)当向溶液中加入Ba(NO3)2溶液能生成白色沉淀,则原溶液中存在的离子是__________为了进一步确定的溶液中存在哪种离子,可继续向溶液中加入_______________,通过观察_______________再作出进一步的判断。备课参考1.练习答案:1.B2.B3.A4.A5.D6.A7.可溶性碳酸盐与强酸溶液反应生成二氧化碳和水Na2CO3+2HCl=2NaCl+CO2↑+H2O8.(1)CO32-(2)Cl-、SO42-、CO32-(3)SO42-、CO32-至少有一种;稀硝酸;沉淀是否部分溶解或全部溶解或都不溶解补充说明:1.离子反应发生的条件(1)生成难溶物质或微溶物:如SO42-与Ag+、SO42-与Ca2+、CO32-与Mg2+\n等生成微溶物导致离子反应发生(1)生成气体或挥发性物质:如NH4+与OH-、H+与、CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等之间发生离子反应(2)生成弱电解质:如H+与CH3COO-、CO32-、S2-、SO32-、F-等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱;H+与OH-生成水(水是一种极弱的电解质)2.书写离子方程式的步骤:(1)写:写出正确的化学方程式(2)拆:将化学式中易溶于水且能完全电离的物质拆写成阴、阳离子符号;而难溶于水、难电离、气体、水、单质等仍用化学式表示(3)删:删去方程式等号两边重复的离子(4)查:检查是否满足元素原子守恒、反应前后电荷守恒等。3,书写离子方程式时应注意的问题(1)在非溶液中进行的化学反应一般不能写成离子方程式:例如,NH4CL(s)和Ca(OH)2(2)单质、氧化物、弱酸弱碱、难溶于水的物质一律写成化学式(3)多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开写⑷对于微溶物的处理:在生成物中有微溶物,微溶物用化学式。当反应物里有微溶物处于浊液或固态,应写化学式。当反应物里有微溶物处于溶液状态(稀溶液),应写成离子形式。⑸操作顺序或反应物相对量不同时离子方程式不同。三,离子共存问题1、溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。⑴生成难溶物或微溶物:如:Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等⑵生成气体或挥发性物质:如:NH4+与OH-、H+与CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等⑶生成难电离物质:如:H+与Ac-、CO32-、S2-、SO32-等生成弱酸;OH-与NH4+生成的弱碱;H+与OH-生成水⑷发生氧化还原反应:氧化性离子(如Fe3+、NO3-、ClO-MnO4-等)与还原性离子(如S2-、I-Fe2+、SO32-等)不能大量共存。(5)附加隐含条件的应用规律溶液无色透明时,溶液中一定没有有色离子常见的有色离子:Cu2+、Fe3+、Fe2+、MnO4-等强碱性溶液中肯定不存在与OH-反应的离子。强酸性溶液中肯定不存在与H+反应的离子1、与H+不能共存(即酸性溶液、PH<7、石蕊变红)OH-、CO32-、SO32-、SiO32-、S2--、CH3COO--、F--、ClO--,AlO2--、S2O32--,HCO3--、HSO3--、HS--、HPO42--、H2PO4--。2、与OH--不能共存(即碱性溶液、PH>7、酚酞变红)H+、NH4+、Mg2+、Fe2+、Fe3+、Al3+、Cu2+等,HSO3--、HS--、HPO42--、H2PO4—等。3、金属阳离子与酸根离子Ag+、Ca2+、Ba2+、Pb2+与CO32-、SO42—、PO43--、SO32-、SiO32-;Ag+与Cl-、Br-、I-;F-与Ca2+。\n第三节氧化还原反应归纳整理投影:从元素化合价升降的角度分析(特征)⑴氧化反应⑵还原反应⑶氧化剂⑷还原剂⑸氧化还原反应⑴氧化反应:所含元素化合价升高的反应⑵还原反应:所含元素化合价降低的反应⑶氧化剂:所含元素化合价降低的物质⑷还原剂:所含元素化合价升高的物质⑸氧化还原反应:有元素化合价升降的反应归纳总结氧化还原反应不局限于存在得氧失氧的反应,凡是有元素化合价升降的反应都是氧化还原反应。元素化合价的变化是氧化还原反应的特征。氧化还原反应的表示方法:用于表示反应中元素化合价变化情况的双箭头——双线桥书写步骤:1.标出变化了的元素化合价;2.箭头总是从反应物指向生成物;3.箭头指向同种元素;4.升价在上,降价在下。⑵用单线桥表示电子转移情况表示氧化剂和还原剂之间元素的电子转移情况时,将氧化剂中降价元素与还原剂中升价元素用直线连接起来,箭头从还原剂指向氧化剂,线上标出电子转移总数,称为“单线桥法”重点:(1)单箭号(在反应物之间)(2)箭号起点为失电子元素,终点为得电子元素(从还原剂指向氧化剂)(3)只标转移电子总数,不标得与失。氧化性、还原性有强弱之分:⑴氧化性越强,说明该物质越易得到电子。⑵还原性越强,说明该物质越易失去电子。一般地氧化性强的易于与还原性强的物质发生氧化还原反应。比如,氯化铁溶液可以与硫化氢反应。你能否写出该反应的化学方程式。五、氧化还原反应的规律1、强制弱规律(强弱律)----判断氧化性和还原性强弱⑴利用氧化还原反应进行判断一个自发进行的氧化还原反应:氧化性:氧化剂>氧化产物还原性:还原剂>还原产物⑴金属单质的还原性越强,其简单阳离子的氧化性越弱,反之,亦然。⑵非金属单质的氧化性越强,其简单阴离子的还原性越弱,反之,亦然。1.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )A.Fe+CuSO4=FeSO4+Cu B.Fe2O3+3CO2Fe+3CO2C.AgNO3+NaCl=AgCl↓+NaNO3 D.2KMnO4K2MnO4+MnO2+O2↑\n2.下列属于氧化还原反应的是( )A.CaCO3CaO+CO2↑ B.Na2O+H2O=2NaOHC.Na2CO3+H2SO4=.Na2SO4+CO2↑+H2OD.MnO2+4HCl+Cl2↑+2H2O3.下列变化需要加入氧化剂才能实现的是( )A.NaOH→NaClB.H2SO4→H2C.HCl→Cl2D.CaCO3→CO24.在下列反应中,水既不作氧化剂,又不作还原剂的是( )A.2Na+2H2O=2NaOH+H2↑B.Na2O=2NaOHC.H2OH2↑+O2↑D.C+H2OCO+H25.下列变化过程一定属于还原反应的是( )A.HCl→MgCl2B.Na→Na+C.CO→CO2D.Fe3+→Fe2+6.下列反应氯元素只被氧化的是( )A.5Cl2+I2+6H2O=10HCl+2HIO3B.MnO2+4HClMnCl2+Cl2↑+H2OC.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2OD.2HClO2HCl+O2↑7.分析下列氧化还原反应中化合价的变化,指出氧化剂和还原剂(1)2Fe+3Cl22FeCl3 氧化剂_________ 还原剂___________(2)CuO+COCu+CO2 氧化剂_________ 还原剂___________(3)2Al+3H2SO4=Al2(SO4)3+3H2↑氧化剂_________ 还原剂___________(4)2KClO32KCl+3O2↑氧化剂_________ 还原剂___________备课参考1.练习答案:1.B 2.D 3.C 4.B 5.D 6.B 7.(1)Cl2Fe(2)CuOCO(3)H2SO4Al(4)KClO3KClO3