- 2.93 MB
- 2022-08-17 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
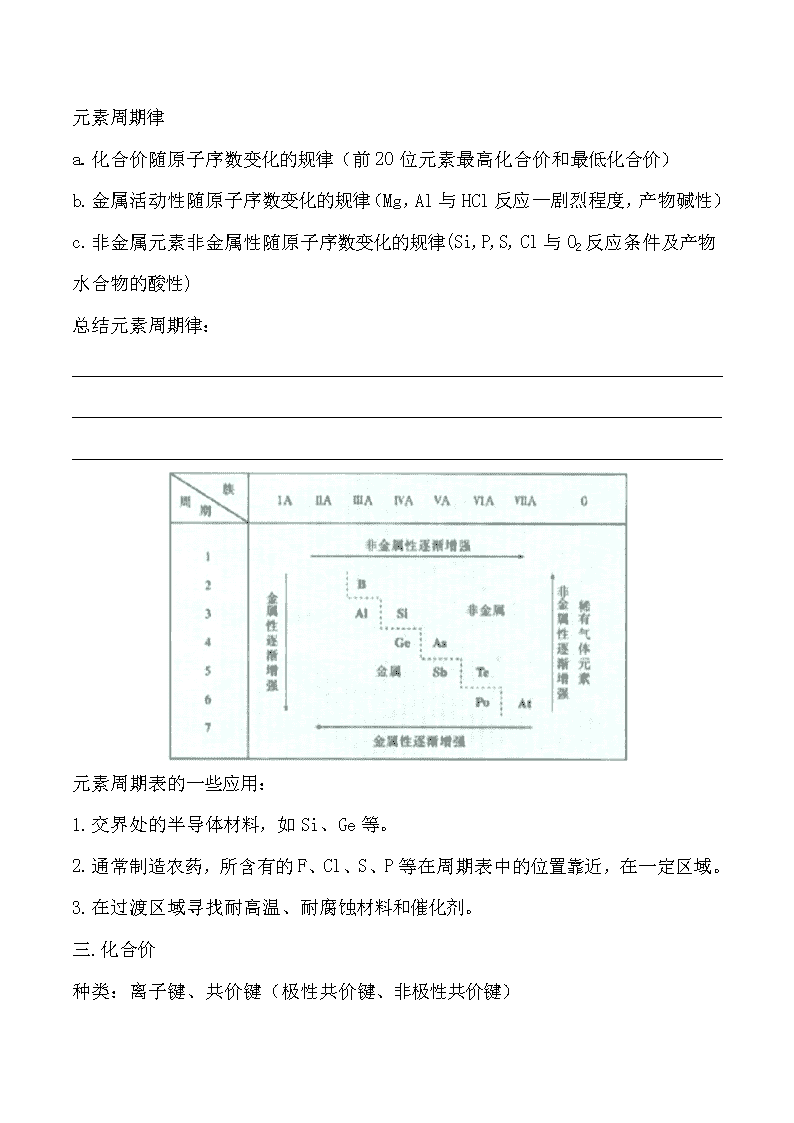
高中化学必修2—章节教案第一章物质结构元素周期律一.元素周期表1.门捷列夫元素周期表周期族(别名)长短周期化学性质与最外层电子数2.元素性质与原子结构1)碱金属元素物理性质结构特点化学性质规律及原因可参与反应:a.均可与水反应2Na+2H2O2NaOH+H2↑剧烈反应,发出滋滋声,在水面游弋;2K+2H2O2KOH+H2↑剧烈反应,迅速融化为液态金属小球,发出嘶嘶声,产生紫色火焰;b.均可与氧气发生反应Li+O2Li2ONa+O2Na2O2空气中燃烧,迅速融化,剧烈燃烧,黄色火焰,黄烟;K+O2KO2剧烈燃烧,紫色火焰(透钴玻璃),橙黄色晶体;\n2)卤族元素物理性质结构特点化学性质规律及内因可参与反应:a.与氢气反应卤族元素活动性顺序与生成产物稳定性关系b.卤族元素之间的置换反应NaBr+Cl2NaCl+Br2NaI+Br2NaBr+I2卤族元素的氧化性顺序3.核素核素同位素二.元素周期律1.原子核外电子排布电子层表示n=1,2,3,4,5,6,7或n=K,L,M,N,O,P,Q前20位元素核外电子排布2.元素周期律\n元素周期律a.化合价随原子序数变化的规律(前20位元素最高化合价和最低化合价)b.金属活动性随原子序数变化的规律(Mg,Al与HCl反应—剧烈程度,产物碱性)c.非金属元素非金属性随原子序数变化的规律(Si,P,S,Cl与O2反应条件及产物水合物的酸性)总结元素周期律:元素周期表的一些应用:1.交界处的半导体材料,如Si、Ge等。2.通常制造农药,所含有的F、Cl、S、P等在周期表中的位置靠近,在一定区域。3.在过渡区域寻找耐高温、耐腐蚀材料和催化剂。三.化合价种类:离子键、共价键(极性共价键、非极性共价键)\n1.离子键Na+ClNaCl黄色火焰,白色固体以此反应为例说明离子键的形成过程(通常活泼金属和活泼非金属形成离子键)离子化合物电子式短横线“—”代表一对共用电子对2.共价键以氯原子形成氯分子为例说明共价键形成过程共价化合物补充:其他类型的分子间作用—分子间作用力(又称为范德华力)和氢键,主要对物质的熔点、沸点产生影响。\n第二章化学反应与能量一.化学能与热能1.化学键与化学反应中的能量变化a.化学键的断裂与形成是化学变化中能量变化的主要原因。b.一个化学反应是放热还是吸热取决于反应物的总能量和生成物总能量的大小。c.化学反应的能量变化通常主要以吸热放热为表现方式。d.三个化学反应的能量变化2Al+6HCl2AlCl3+3H2↑Ba(OH)2+NH4ClBaCl2+NH3↑HCl+NaOHNaCl+H2O补充:人体能化学能转化二.化学能与电能发电机蒸汽燃烧1.化学能与电能的相互转化直接转化直接转化a.火力发电能量转换流程为:化学能热能机械能电能;b.化学能电能原电池模型变化过程表示如下锌片:Zn–2eZn2+(氧化反应)铜片:2H++2eH2(还原反应)像这样将化学能直接转化为电能的装置即原电池;化学电池化学电池的实质:氧化还原反应化学能电能\n兴趣实验:根据化学电池原理,利用以下物品设计一个原电池装置:镁条、铜片、铁片、导线、金属夹、手电筒用小灯泡(发光二极管)、果汁(橙汁、苹果汁、柠檬汁等),500ml烧杯。锂离子电池镍镉充电电池铅蓄电池2.发展中的化学电池干电池充电电池燃料电池(以H2\CH4等为原料)3.化学反应速率和限度1)化学反应速率mol/(L·s)mol/(L·min)生成物浓度的增加反应物浓度的减少a.化学反应速率—衡量化学反应进行快慢的标准。计量方式计量单位反应速率计算练习。b.影响反应速率的因素实验探究:温度影响:5%H2O2溶液水浴冰水 温水 热水 \n催化剂影响:5%H2O2溶液催化剂MnO2 1-2dFeCl3 无添加物 影响化学反应速率因素总结:1.温度2.催化剂3.浓度4.反应物状态5.压强2)化学反应限度—反应物的转化程度(转化率)a.化学反应限度的实验探究:3-4ml1mol/LCaCl2加入1mol/LNa2SO4至不再有沉淀产生加入1mol/LNa2CO3现象:结论:CaCl2并没有完全转化为CaSO4沉淀。很多反应具有可逆性,反应时正逆反应同时发生,在反应开始阶段,正>逆,随着反应进行,正与逆逐渐接近,直至两者相等时,该化学反应即达到“平衡”状态,也就是这个反应的限度。任何化学反应都有限度,只是限度不同而已。4.化学反应条件的控制—促进有利化学反应,抑制有害化学反应。\n第三章有机化合物一.最简单的有机化合物—CH4甲烷是天然气、沼气、有气体田和煤矿坑道气的主要成分。电子式和结构式空间结构1.甲烷性质a.物理性质—无色无味,密度0.717g/L,极难溶于水。点燃b.化学性质:光与O2发生氧化反应:CH4+2O2CO2+2H2O取代反应:CH4+Cl2CH3Cl+HCl,CH3Cl为气体,可进一步反应生成CH2Cl2/CHCl3/CCl4均为油状液体。定义:取代反应2.烷烃定义:烷烃(即饱和烃)烷烃物理性质随C的增加呈现规律性,戊烷前为气体。烷烃的分子式通式:CnH2n+2同系物烷烃命名:传统命名法(甲、乙、丙…壬、癸)同分异构现象/同分异构体二.来自石油和煤的两种基本化工原料1.乙烯—乙烯的产量是衡量一个国家石油化工水平的标准实验室制法:石蜡油在碎瓷片的作用下加热。烯烃概念\n乙烯化学性质:a.与O2反应C2H4+3O22CO2+2H2Ob.加成反应C2H4+Br2C2H2Br2c.与酸性高锰酸钾反应,使其褪色。d.与H2O/Cl2/H2发生加成反应,写出方程式:乙烯应用:催熟剂2.苯分子式C6H6结构式苯的物理性质:无色,特殊气味,有毒,不溶于水,密度小于水,熔点5.5℃,沸点80.1℃.点燃苯的化学性质:a.与O2反应2C6H6+15O212CO2+6H2Ob.不与溴水或酸性高锰酸钾反应c.取代反应e.加成反应三.生活中常见的两种有机物1.乙醇\n物理性质:无色,特殊气味,密度0.789g/ml,与水混溶,沸点78.5℃,易挥发。化学性质:a.与金属钠反应b.与O2反应—①燃烧;②Cu或Ag催化下氧化为乙醛;2.乙酸—俗称醋酸分子式:C2H4O2结构简式:CH3COOH官能团:-COOH(羧基)物理性质:无色有刺激气味液体,熔点16.6℃,沸点117.9℃,凝固时为类冰晶体,又称冰醋酸。易溶于水和乙醇化学性质:a.具有酸的通性。b.酯化反应四.基本营养物质营养物质:糖类、油脂、蛋白质、维生素、无机盐和水。习惯称糖类、油脂、蛋白质为基本营养物质。1.糖类、油脂、蛋白质的性质a.糖类和蛋白质的特征反应反应物实验操作实验现象\n葡萄糖2g葡萄糖溶于5ml水,加入新制的Cu(OH)2,加热制备好新鲜的银氨溶液,加入葡萄糖溶液加热淀粉面包片上滴一滴碘酒蛋白质一小块儿鸡皮,置于蒸发皿中,加几滴硝酸,酒精灯上微热皮毛燃烧b.糖类、油脂和蛋白质的水解反应1)蔗糖水解实验1ml20%的蔗糖溶液,加入3-5滴稀硫酸,水浴加热5min后,加入氢氧化钠溶液调至碱性,加入新制的Cu(OH)2实验现象:实验结论:2)油脂在酸或碱的催化下可以发生水解反应,水解为甘油和高级脂肪酸(或高级脂肪酸钠)。碱性水解称为皂化反应,可以制取肥皂。3)蛋白质可以在酶等催化下发生水解,生成氨基酸。2.糖类、油脂和蛋白质在生产和生活中的应用\n第四章化学与可持续发展一.开发利用金属矿物和海水资源1.金属矿物的开发利用除金、铂等极少数金属意外,绝大多数金属以化合物的形式存在于自然界。金属的冶炼方法:a.直接加热分解(不活泼金属氧化物)b.熔融电解法(活泼金属化合物)c.高温氧化还原法(大部分金属的冶炼利用焦炭、一氧化碳和氢气等高温还原)\n2.海水资源的开发利用a.海水淡化的方法—蒸馏法、电渗析法、离子交换法等b.海水中富含ClNaKMgCaSCFBBrSr等元素,总计80多种元素。\nc.海水制盐除食用外,还可以作为制取烧碱、纯碱、金属钠以及氯气、盐酸、漂白粉等化工产品的原料。还可以提取溴、碘等卤族元素。提取碘实验:二.化学与资源综合利用、环境保护1.煤、石油、天然气的综合利用a.煤的利用煤—主要成分为C元素,还有少量的HOSN等元素。煤利用手段—煤的干馏、煤的液化和煤的气化。煤的气化\n煤的液化—可以与氢气直接作用制取液体燃料。也可以先气化,然后再在催化剂的作用下生成甲醇。天然气用于合成氨和甲醇,或合成两个或多个碳的有机化合物。b.石油的综合利用石油分馏—制取汽油、煤油、柴油等含碳原子少的轻质油。重油裂解链状烃也可以经过催化和加热条件下生成环状烃。我们熟悉的塑料、合成纤维、合成橡胶也是以煤、石油、天然气为原料合成的。乙烯聚合:2.“原子化学”\n