- 107.50 KB
- 2022-08-17 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
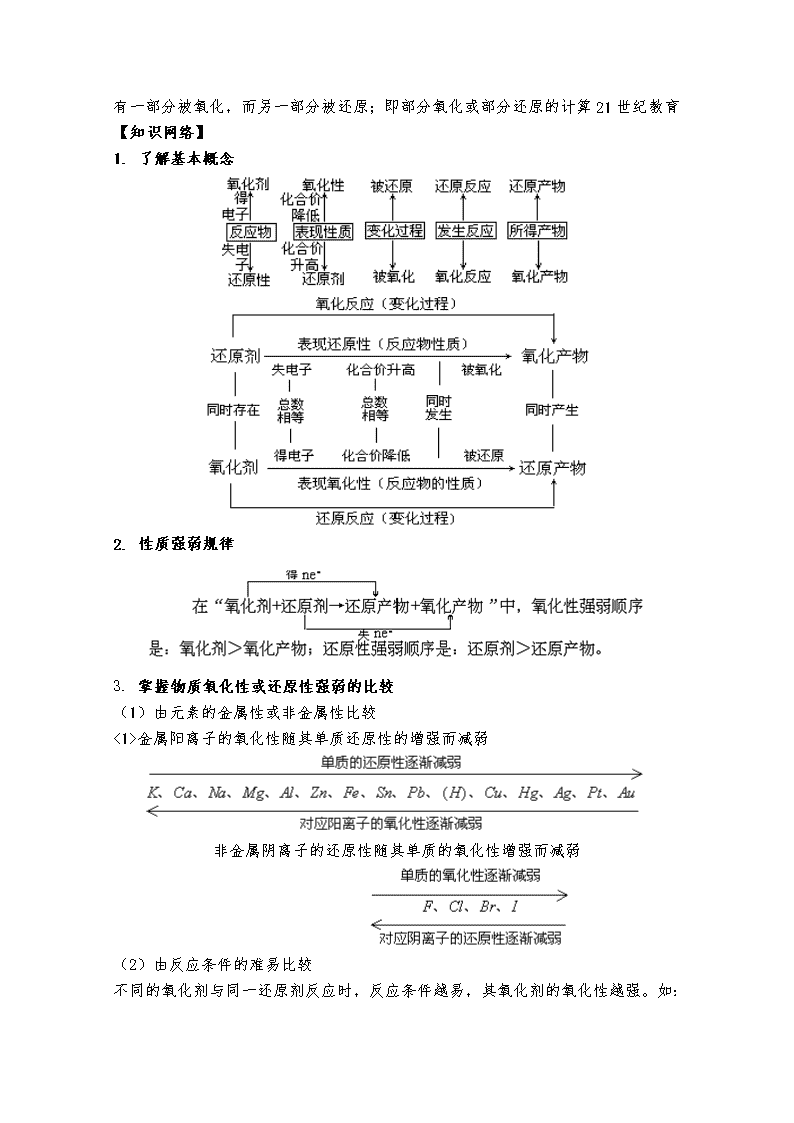
专题二氧化还原反应【专题要点】氧化还原反应是重要的化学反应类型之一,考试说明中要求学生从化学反应的本质角度来深入认识氧化还原反应的原理。能够从氧化还原反应的角度去分析认识元素化合物部分以及有机化学中的部分化学反应,达到巩固知识熟练运用的程度。正确书写化学方程式是化学学习的基本功,这在氧化还原反应的学习过程中显得尤为重要。有关依据氧化还原反应方程式设计的计算类型题仍然是掌握的重点以氧化还原反应为主线的知识贯穿于中学化学学习的始终,考查面广,不仅涉及无机物、有机物的化学性质,而且还与学科内的其他知识点密切联系,如阿伏伽德罗常数、离子共存、离子方程式、电化学、能源、工业生产等,甚至会出现学科间的综合,如与物理学中的电学方面知识进行综合。题型主要是选择题和填空题,形式新颖灵活分析近几年的高考试题,氧化还原反应主要从以下几个方面进行考查:考查氧化还原反应的概念以及概念之间的内在联系。如氧化剂、还原剂、氧化产物、还原产物、氧化反应、还原反应的判断;物质氧化性、还原性强弱的比较;氧化还原反应方程式的配平甚至是写出未学过的氧化还原反应方程式;氧化还原反应中电子转移方向和数目的标定;有关氧化还原反应的计算【考纲要求】1、了解化学反应的本质及变化过程中所遵循的原理和规律。2、认识氧化还原反应的本质。3、了解生产、生活中常见的氧化还原反应。4、能根据质量守恒定律正确书写化学方程式,并能进行有关计算。【教法指引】教师在教学过程中应从以下几个方面加强:1、理清几组重要概念及其之间的关系2、讲清氧化性和还原性强弱的比较以及判断强弱的方法。(要求学生掌握常见的氧化剂和还原剂)3、引导学生学会解决有关氧化还原反应的计算方法和技巧;①可根据电子守恒,依据氧化剂得电子总数等于还原剂失电子总数的关系,列出守恒关系式求解,从试题的变化趋势看,有一类题目是已知参加反应的氧化剂与还原剂的质量比,计算确定产物。计算公式如下:氧化剂物质的量×变价元素原子的个数×化合价的变化值=还原剂物质的量×变价元素原子的个数×化合价的变化值②\n要注意参加反应的量不一定完全是被氧化,或被还原;或一种物质由于歧化,有一部分被氧化,而另一部分被还原;即部分氧化或部分还原的计算21世纪教育【知识网络】1.了解基本概念2.性质强弱规律3.掌握物质氧化性或还原性强弱的比较(1)由元素的金属性或非金属性比较<1>金属阳离子的氧化性随其单质还原性的增强而减弱非金属阴离子的还原性随其单质的氧化性增强而减弱(2)由反应条件的难易比较不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强。如:\n前者比后者容易发生反应,可判断氧化性:。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。(3)根据被氧化或被还原的程度不同进行比较当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。如,根据铁被氧化程度的不同,可判断氧化性:。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强(4)根据反应方程式进行比较氧化剂+还原剂=还原产物+氧化产物氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物(5)根据元素周期律进行比较一般地,氧化性:上>下,右>左;还原性:下>上,左>右。(6)某些氧化剂的氧化性或还原剂的还原性与下列因素有关:温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。浓度:如浓硝酸的氧化性比稀硝酸的强。酸碱性:如中性环境中不显氧化性,酸性环境中显氧化性;又如溶液的氧化性随溶液的酸性增强而增强。注意:物质的氧化性或还原性的强弱只决定于得到或失去电子的难易,与得失电子的多少无关。如还原性:,氧化性:。专题二氧化还原反应1.下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是()A.CO2+H2OH2CO3B.2Na2O2+2H2O=4NaOH+O2↑C.3Fe+4H2O(g)Fe2O4+4H2D.2Na+2H2O=2NaOH+H2↑2.已知A2O可将B2-氧化为B单质,A2O则被还原为A3+,又知100mL的0.3mol/L的A2O与150mL的0.6mol/LB2-恰好完全反应,则A2O中的n值为()A.4B.5C.6D.73.F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。如XeF4与水可发生如下反应:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。下列判断中正确的是()A.XeF2分子中各原子均达到八电子结构\nB.XeF6分子中Xe的化合价为+6价C.上述反应中氧化剂和还原剂的物质的量之比为1∶2D.XeF4按已知方式水解,每生成4molXe,转移12mol电子4.下列环境下物质处于还原性氛围的是()①地球表面②沼气池③漂白粉溶液A.②③B.①②C.只有①D.只有②5.吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用Na2SeO3清除人体内活性氧,Na2SeO3的作用是()A.还原剂B.氧化剂C.既是氧化剂又是还原剂D.既不是氧化剂又不是还原剂6.Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO和NaClO3的物质的量比为4∶1,则溶液中NaCl和NaClO的物质的量之比为()A.9∶4B.5∶1C.11∶2D.1∶17.MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:⑴软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O。⑵除去反应混合物中的不溶物⑶电解混合液MnSO4+ZnSO4+2H2OMnO2+Zn+2H2SO4下列说法不正确的是()A.步骤⑴中MnO2和H2SO4都是氧化剂B.步骤⑴中每析出12.8gS沉淀共转移0.8mol电子C.电解时MnO2在阳极处产生D.硫酸在生产中可循环使用8.被称为万能还原剂的NaBH4溶于水并和水发生反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)()A.被氧化的元素与被还原的元素质量比为1︰1B.NaBH4是氧化剂,H2O是还原剂C.硼元素被氧化,氢元素被还原D.NaBH4既是氧化剂又是还原剂9.amolFeS与bmolFeO投入到VL、cmol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为()①(a+b)×63g②(a+b)×189g③(a+b)mol④Vc-(9a+b)/3molA.①④B.②③C.①③D.②④10.据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为:5KClO3+6P=3P2O5+\n5KCl,则下列有关叙述错误的是()A.上述反应是氧化还原反应B.白色烟雾是生成的P2O5白色固体小颗粒(烟)吸水性强,吸收空气中的水,生成磷酸小液滴(雾)C.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替D.上述反应中消耗3molP时,转移电子的物质的量为15mol11.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M关于该反应的说法中正确的组合是()①氧化剂是H3AsO3;②还原性:Cl->As;③每生成7.5gAs,还原剂失去的电子为0.3 mol;④M为OH-;⑤SnCl62-是氧化产物。A.①③⑤B.①②④⑤C.①②③④D.只有①③12.有Fe2+、、Fe3+、、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是()A.氧化剂与还原剂的物质的量之比为1︰8B.该过程说明Fe(NO3)2溶液不宜加酸酸化C.若有lmolNO3-发生氧化反应,则转移8mole-D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+13.已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+则下列说法正确的是()A.该反应中Fe2+是还原剂,O2是还原产物B.4molNa2O2在反应中共得到8NA的电子C.Fe(OH)3是氧化产物,每生成4molFe(OH)3反应过程中共转移电子6molD.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀14.CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如下图所示:请回答下列问题:(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的(填字母)。A.K2Cr2O7B.NaClOC.H2O2该反应的离子方程式为。(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的(填字母);A.NaOHB.CuC.Cu2(OH)2CO3\n②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生凝聚。将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是。(3)步骤Ⅲ应控制的实验条件是。15.某化学兴趣小组利用实验室提供的下列试剂:铁粉、0.1mol·L-1FeCl3溶液、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并对实验结果加于应用。(1)根据氧化还原的有关原理,兴趣小组对Fe2+、Fe3+的氧化性、还原性提出了如下2种假设:假设一:Fe2+既有还原性又有氧化性;假设二:Fe3+具有氧化性;探究内容实验方案实验现象探究Fe2+具有还原性取少量0.1mol·L-1FeCl2溶液,加入足量新制氯水后,再往溶液中加入少量KSCN溶液探究Fe3+具有氧化性(2)设计实验方案,进行实验并描述实验现象,完成下列表格。(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了一个反应事实:FeCl2+Zn=ZnCl2+Fe该反应的离子方程式为:(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是:16.(1)配平氧化还原反应方程式:__C2O42—+__MnO4—+__H+=__CO2+__Mn2++__H2O(2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。 ①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为mol;②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由变为。该溶液中还原剂的物质的量为mol;③原试样中H2C2O4·2H2O和KHC2O4的质量分数分别是多少?(请列式计算,写出运算过程)17.(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是;若反应过程中转移了0.3电子,则氧化产物的质量是。\n(2)将amolCl2通入含bmolFeBr2的溶液中,当0