- 594.50 KB
- 2022-08-18 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
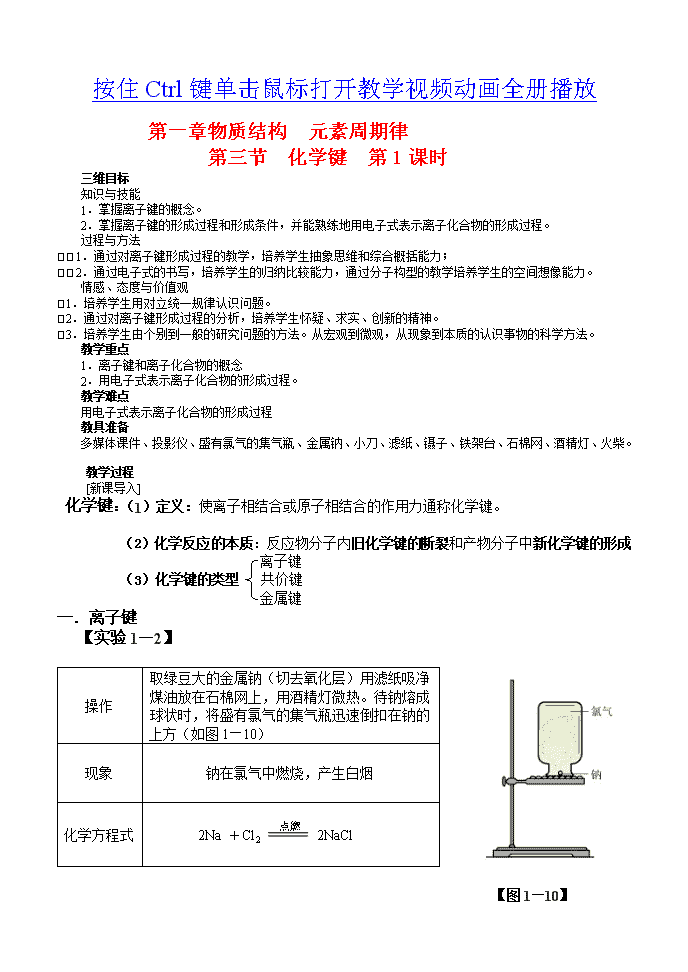
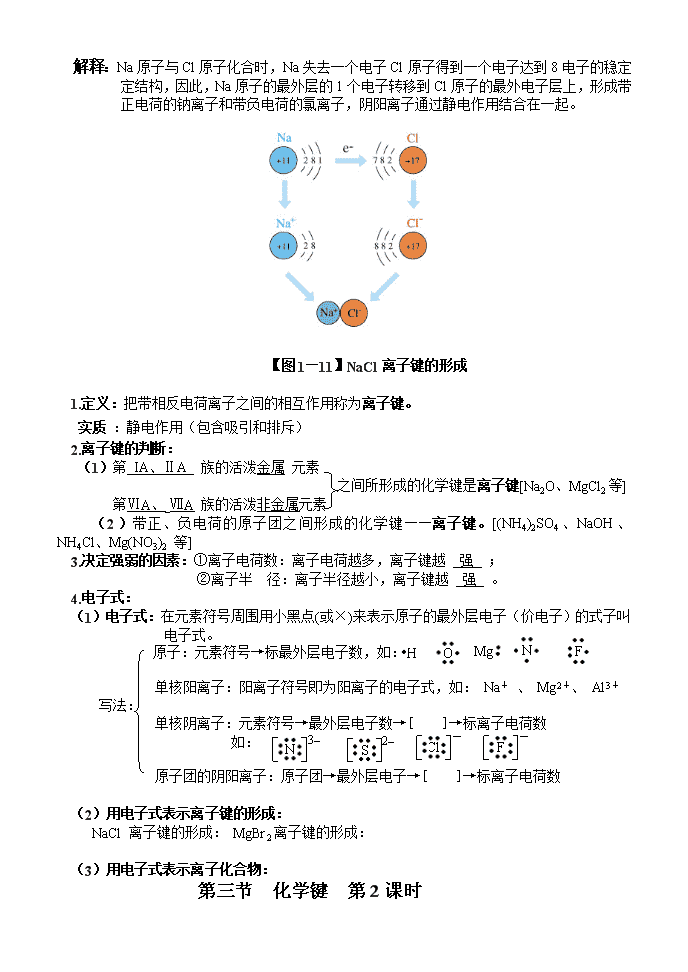
按住Ctrl键单击鼠标打开教学视频动画全册播放第一章物质结构元素周期律第三节化学键第1课时三维目标知识与技能1.掌握离子键的概念。 2.掌握离子键的形成过程和形成条件,并能熟练地用电子式表示离子化合物的形成过程。过程与方法1.通过对离子键形成过程的教学,培养学生抽象思维和综合概括能力;2.通过电子式的书写,培养学生的归纳比较能力,通过分子构型的教学培养学生的空间想像能力。情感、态度与价值观1.培养学生用对立统一规律认识问题。2.通过对离子键形成过程的分析,培养学生怀疑、求实、创新的精神。3.培养学生由个别到一般的研究问题的方法。从宏观到微观,从现象到本质的认识事物的科学方法。教学重点1.离子键和离子化合物的概念2.用电子式表示离子化合物的形成过程。教学难点用电子式表示离子化合物的形成过程教具准备多媒体课件、投影仪、盛有氯气的集气瓶、金属钠、小刀、滤纸、镊子、铁架台、石棉网、酒精灯、火柴。教学过程[新课导入]化学键:(1)定义:使离子相结合或原子相结合的作用力通称化学键。(2)化学反应的本质:反应物分子内旧化学键的断裂和产物分子中新化学键的形成离子键(3)化学键的类型共价键金属键一.离子键【实验1—2】操作取绿豆大的金属钠(切去氧化层)用滤纸吸净煤油放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方(如图1—10)现象钠在氯气中燃烧,产生白烟化学方程式2Na+Cl22NaCl【图1—10】\n解释:Na原子与Cl原子化合时,Na失去一个电子Cl原子得到一个电子达到8电子的稳定定结构,因此,Na原子的最外层的1个电子转移到Cl原子的最外电子层上,形成带正电荷的钠离子和带负电荷的氯离子,阴阳离子通过静电作用结合在一起。【图1—11】NaCl离子键的形成1.定义:把带相反电荷离子之间的相互作用称为离子键。实质:静电作用(包含吸引和排斥)2.离子键的判断:(1)第IA、ⅡA族的活泼金属元素之间所形成的化学键是离子键[Na2O、MgCl2等]第ⅥA、ⅦA族的活泼非金属元素(2)带正、负电荷的原子团之间形成的化学键——离子键。[(NH4)2SO4、NaOH、NH4Cl、Mg(NO3)2等]3.决定强弱的因素:①离子电荷数:离子电荷越多,离子键越强;②离子半径:离子半径越小,离子键越强。4.电子式:FNO(1)电子式:在元素符号周围用小黑点(或×)来表示原子的最外层电子(价电子)的式子叫电子式。MgH原子:元素符号→标最外层电子数,如:单核阳离子:阳离子符号即为阳离子的电子式,如:Na+、Mg2+、Al3+写法:单核阴离子:元素符号→最外层电子数→[]→标离子电荷数FClS2–N3–如:原子团的阴阳离子:原子团→最外层电子→[]→标离子电荷数(2)用电子式表示离子键的形成:NaCl离子键的形成:MgBr2离子键的形成:(3)用电子式表示离子化合物:第三节化学键第2课时\n三维目标知识与技能1.使学生理解共价键的概念,初步掌握共价键的形成,加深对电子配对法的理解。2.能较为熟练地用电子式表示共价分子的形成过程和分子结构。3.理解极性键、非极性键、化学键的概念。过程与方法1.通过对共价键形成过程的教学,培养学生抽象思维和综合概括能力。2.通过离子键和共价键的教学,培养学生对微观粒子运动的想象力。3.通过电子式的书写,培养学生的归纳比较能力,通过分子构型的教学培养学生的空间想像能力。情感、态度与价值观1.培养学生用对立统一规律认识问题。2.通过对共价键形成过程的分析,培养学生怀疑、求实、创新的精神。3.培养学生由个别到一般的研究问题的方法。从宏观到微观,从现象到本质的认识事物的科学方法。教学重点1.共价键和共价化合物的概念2.用电子式表示共价化合物的形成过程。教学难点1.用电子式表示共化合物的形成过程2.极性键与非极性键的判断教具准备多媒体课件、投影仪教学过程[新课导入]二.共价键1.定义:原子间通过共用电子对所形成的相互作用叫做共价键。2.共价键的判断:(1)同种非金属元素形成的单质中的化学键:如:H2、Cl2、N2、O2、O3、P4等。(稀有气体除外:稀有气体是单原子分子,属于无化学键分子)(2)不同种非金属元素之间形成的化学键:①非金属氧化物、氢化物等:H2O、CO2、SiO2、H2S、NH3等②酸中的化学键(全部是共价键):HNO3、H2CO3、H2SO4、HClO、CH3COOH等。3.决定共价键强弱的因素:成键原子的半径之和,之和越小,共价键越强。4.用电子式表示共价键的形成:Cl2、HCl分子的形成ClClClCl(1)Cl2的形成:+ClHCl(2)HCl的形成+H5.用电子式或结构式表示共价键的形成的分子(单质或化合物):电子式:元素符号周围→标最外层电子数。结构式:元素符号→用一根短线表示一对共用电子对(未参加成键的电子省略)H物质H2N2CO2H2OCH4CCl4HHCO电子式HHNNOCOHHH\nHHHHHHClH结构式H—H、NN、OCO、H—O—H、H—C—HClCClCl共价化合物:只含共价键的化合物※共价化合物与离子化合物离子化合物:含有离子键的化合物(可能含有共价键)大多数盐类:NaCl、K2SO4、NH4NO4、CaCO3、Na2S离子化合物较活泼的金属氧化物:Na2O、CaO、MgO、Al2O3判断强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2非金属氧化物、非金属氢化物等:SO2、、N2O5、NH3、H2S、SiC、CH4共价化合物酸类:HNO3、H2CO3、H2SO4、HClO、CH3COOH5.共价键的类型:非极性共价键(简称非极性键):共用电子对不发生偏移,成键的原子不显电性。共价键(在同种元素的原子间形成的共价键,如:H—H)极性共价键(简称极性键):共用电子对发生偏移,成键的原子显正或负电性。(在不同种元素的原子间形成的共价键,如:H—Cl)【随堂练习】1.下列说法中正确的是--------------------------------------------------------(AD)A.含有离子键的化合物必是离子化合物B.具有共价键的化合物就是共价化合物C.共价化合物可能含离子键D.离子化合物中可能含有共价键2.下列物质中含有共价键的离子化合物是----------------------------------------(A)A.Ba(OH)2B.CaCl2C.H2OD.H23.下列物质的电子式书写正确的是----------------------------------------------(C)4.下列物质中,含有非极性键的离子化合物是----------------------------------------------------(D)A.CaCl2B.Ba(OH)2C.H2O2D.Na2O25.下列化合物中,只存在离子键的是---------------------------------------------------------------(C)A.NaOHB.CO2C.NaClD.HCl第三节化学键第3课时三维目标知识与技能1.使学生理解共价键的概念,初步掌握共价键的形成,加深对电子配对法的理解。2.能较为熟练地用电子式表示共价分子的形成过程和分子结构。\n3.理解极性键、非极性键、化学键的概念。过程与方法1.通过对共价键形成过程的教学,培养学生抽象思维和综合概括能力。2.通过离子键和共价键的教学,培养学生对微观粒子运动的想象力。3.通过电子式的书写,培养学生的归纳比较能力,通过分子构型的教学培养学生的空间想像能力。情感、态度与价值观1.培养学生用对立统一规律认识问题。2.通过对共价键形成过程的分析,培养学生怀疑、求实、创新的精神。3.培养学生由个别到一般的研究问题的方法。从宏观到微观,从现象到本质的认识事物的科学方法。教学重点1.共价键和共价化合物的概念2.用电子式表示共价化合物的形成过程。教学难点1.用电子式表示共化合物的形成过程2.极性键与非极性键的判断教具准备多媒体课件、投影仪教学过程[新课导入]【知识拓展】两种分子两种力1.(两种分子)极性分子和非极性分子非极性分子:整个分子电荷分布对称(正负电荷重心重合,中心原子无孤对电子)(1)概念极性分子:整个分子电荷分布不对称(正负电荷重心不重合,中心原子有孤对电子)(2)常见分子的极性分子类型代表物质分子形状键的极性分子极性AHe、Ne球形非极性分子A2H2、O2直线形非极性键非极性分子ABHCl、NO直线形极性键极性分子AB2CO2、CS2直线形极性键非极性分子A2BH2O、SO2角形极性键极性分子AB3BF3、SO3平面正三角形极性键非极性分子AB3NH3三角锥形极性键极性分子AB4CH4、CCl4正四面体形极性键非极性分子※应用:“相似者相溶”规律:极性分子(非极性分子)组成的溶质易溶于极性分子(非极性分子)组成的溶剂。例如:HCl易溶于水,大多数盐类易溶于水,但是难溶于苯、汽油等有机溶剂;碘易溶于CCl4,难溶于水;大多数有机物互溶。2.(两种力)分子间作用力和氢键(1)分子间作用力(范德华力)\n①定义:产生于分子之间的比较弱的相互作用。②影响分子间作用力的因素:对于组成和结构相似的物质,随着相对分子质量的增大,分子间作用力增大。③分子间作用力对物质的物理性质的影响熔点、沸点越高;分子间作用力越大密度(一般)越大。[例1]单质F2Cl2Br2I2相对分子质量---------------------------------------→(↑)分子间作用力----------------------------------------→(↑)熔点、沸点----------------------------------------→(↑)状态(气)(气)(液)(固)密度-----------------------------------------→(↑)[例2]化合物CF4CCl4CBr4CI4相对分子质量-----------------------------------------→(↑)分子间作用力------------------------------------------→(↑)熔点、沸点------------------------------------------→(↑)密度------------------------------------------→(↑)(2)氢键①概念:某些含氢化合物分子间存在的一种比分之间作用力稍强的相互作用,叫做氢键。②氢键的形成条件:H—R------H—RR:半径小、吸引电子的能力强。③含有氢键的物质:HF、H2O、NH3(液态或固态)④分子间氢键的形成对物质的物理性质的影响:使物质的熔沸点升高、密度(一般)增大。\n图1—11一些氢化物的沸点图1—12水分子间的氢键※比较强弱:化学键>氢键>范德瓦耳斯力存在范围作用本质作用强弱决定键能大小因素影响性质范德华力分子间和分子晶体内静电作用弱结构相似的分子,其式量越大,分子间作用力越大。分子晶体的熔沸点、硬度等氢键分子间和分子晶体内静电作用弱(稍强)分子晶体的熔沸点【随堂练习】2.通常情况下极易溶于水的气体是--------------------------------------------------------------(C)A.CH4B.O2C.HClD.Cl23.下列过程中共价键被破坏的是------------------------------------------------------------------(D)A.碘升华B.溴蒸气被木炭吸附C.酒精溶于水D.HCl气体溶于水4.下列电子式书写错误的是------------------------------------------------(C)5.下列各组物质按沸点由低到高的顺序排列:①H2O、H2S、H2Se、H2Te:H2S、H2Se、H2Te、H2O;\n②HF、HCl、HBr、HI:HCl、HBr、HI、HF;③CH4、SiH4、GeH4、SnH4:CH4、SiH4、GeH4、SnH4。6.下列物质中:①CO2②H2O③CH4④N2⑤P4⑥H2S⑦C2H2⑧NH3(1)属于非极性分子的有:①③④⑤⑦;(2)含有极性键的非极性分子有:①③⑦。6.下列分子中所有原子都能满足最外层为8电子结构的是-------------------------------------(C)A.BF3B.H2OC.SiCl4D.PCl57.下列各组物质中,化学键类型都相同的是--------------------------------------------------------(C)A.HCl与NaOHB.H2S与MgSC.H2O和CO2D.H2SO4和NaNO38.下列化合物中:①CaCl2②NH4Cl③Cl2④H2O⑤H2SO4⑥NaOH⑦NH3⑧H2O2⑨Na2O2⑩HClO(1)只含离子键的是①;(2)只含共价键的是③④⑤⑦⑧⑩;(3)既含离子键又含共价键的是②⑥⑨;(3)属于离子化合物的是①②⑥⑨;(4)属于共价化合物的是④⑤⑦⑧⑩;(5)含有非极性键的离子化合物是⑨。【随堂练习】1.下列说法正确的是------------------------------------------------------------------------------------(D)A.金属元素与非金属元素形成的化学键一定是离子键B.ⅠA族和ⅦA族原子化合时,一定生成离子键C.仅非金属元素形成的化合物中一定不是离子键D.活泼金属与活泼非金属化合时,能形成离子键2.XY2是离子化合物,X和Y离子的电子层结构都与氖原子相同,则X、Y为-----------(D)A.Ca和ClB.K和SC.Ca和FD.Mg和F\n3.下列微粒电子式错误的是----------------------------------------------------(B)4.下列化合物电子式书写正确的是-----------------------------------------------(D)5、分别用电子式表示Na2S、MgBr2的形成过程:S2–S(1)Na2S的形成过程:Na++NaNa+Na+BrBrCaBrBr(2)CaBr2的形成过程:++Ca2+【课后作业】一、选择题1.具有下列价电子数的原子,最难形成离子的是-------------------------------------------------(B)A.L层6个B.L层4个C.M层2个D.M层7个2.XY2是离子化合物,X和Y离子的电子层结构都与氖原子相同,则X、Y为-----------(D)A.Ca和ClB.K和SC.Ca和FD.Mg和F3.下列离子化合物中,离子组成与Ne和Ar的电子层结构分别相同的是--------------------(A)A.NaClB.LiIC.NaFD.CsI4.下列关于离子化合物的叙述正确的是--------------------------------------------------------------(AC)A.离子化合物中都含有离子键B.离子化合物中的阳离子只能是金属离子C.离子化合物若能溶于水,其水溶液一定可以导电D.溶于水可以导电的化合物一定是离子化合物\n5下列物质中属于离子化合物的是---------------------------------------------------------------------(A)A.苛性钠B.碘化氢C.硫酸D.醋酸6.A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子数比A元素总电子数多5个,则A、B可形成----------------------------------------------------------------------------(D)A.共价化合物B2A3B.离子化合物B2A3C.共价化合物B3A2D.离子化合物B3A27.下列每组中各物质内既有离子键又有共价键的一组是-------------------------------------------(C)A.NaOH、H2SO4、(NH4)2SO4B.MgO、Na2SO4、NH4HCO3C.Na2O2、KOH、Na2SO4D.HCl、Al2O3、MgCl28.下列说法正确的是----------------------------------------------------------------------------------------(D)A.熔化状态下能导电的物质一定是离子化合物B.离子化合物不可能只由非金属元素组成C.离子化合物均能溶于水D.离子化合物在一定条件下可以转化为分子9.下列性质中,可以证明某化合物一定存在离子键的是-------------------------------------------(D)A.可溶于水B.具有较高熔点C.水溶液能导电D.熔融状态能导电10.下列4组原子序数的元素,彼此间能形成共价键的是-----------------------------------------(AC)A.6和16B.8和13C.15和17D.12和3511.下列化合物全部以共用电子对成键的是-----------------------------------------------------------(A)A.NH3B.Ba(OH)2C.MgCl2D.NH4Cl12.下列叙述中,不正确的是------------------------------------------------------------------------------(B)A.共价化合物中不可能含有离子键B.硫酸分子中有H+和SO两种离子C.某元素原子的最外层只有一个电子,它跟卤素可能形成离子键,也可能形成共价键D.离子键和共价键的实质都是电性的相互作用二、填空题1.在①CaCl2②KOH③CO2④H2SO4⑤Na2O2⑥Na2S中,只含有离子键的是①⑥_,只含有共价键的是_③④,既含有离子键又含有共价键的是_②⑤_,含有非极性键的是⑤,属于非极性分子的是③。\n2.A、B、C三种元素为短周期元素,A元素的阴离子不能被任何氧化剂氧化,则A为F,1molB单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同结构的离子,则B元素是Al,B的最高价氧化物对应水化物的化学式为Al(OH)3;C元素有三个电子层,且最外电子层比L电子层少2个电子,则C元素是S;C与Na反应后生成化合物的化学键是离子键。2-3.写出下列粒子的电子式:ClNHHHH(1)氮气NN,(2)过氧化钠Na+OONa+ClCl(3)氯化铵,(4)氯化镁Mg2+。第一章第3节化学键检测题(时间60分钟,满分100分)一、选择题(每小题5分,共45分)1.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是-----------------------------------------------------------------------------------------------------(A)A.X2YZ4B.XYZ3C.X3YZ4D.X4Y2Z72.下列说法中正确的是------------------------------------------------------------------------------------(D)A.分子中键能越大,键长越长,则分子越稳定B.失电子难的原子获得电子的能力一定强C.在化学反应中,某元素由化合态变成游离态,该元素被还原D.电子层结构相同的不同离子,其半径随核电荷数的增多而减小3.下列物质的晶体中,既含有离子键,又含有非极性共价键的是----------------------------(B)A.NaOHB.Na2O2C.CaCl2D.H2O2\n4.下列分子中,键角最大的是-------------------------------------------------------------------------(D)A.CH4B.NH3C.H2OD.CO25.下列叙述正确的是--------------------------------------------------------------------------------------(C)A.两个非金属原子间可能形成离子键B.非金属原子间不可能形成离子化合物C.离子化合物中可能有共价键D.共价化合物中可能有离子键6.1999年曾报道合成和分离了含高能量的正离子N的化合物N5AsF6,下列叙述错误的(C)A.N共有34个核外电子B.N中氮—氮原子间以共用电子对结合C.化合物N5AsF6中As化合价为+1D.化合物N5AsF6中F的化合价为-17.氢化铵(NH4H)与氯化铵的结构相似,已知NH4H与水反应有H2生成,下列叙述中不正确的是------------------------------------------------------------------------------------------------------------(C)A.NH4H是离子化合物,含有离子键和共价键B.NH4H溶于水,所形成的溶液显碱性C.NH4H与水反应时,NH4H是氧化剂D.将NH4H固体投入少量水中,有两种气体产生8.1998年中国十大科技成果之一是合成一维纳米氮化镓。已知镓是第三主族元素,则氮化镓的化学式可能是----------------------------------------------------------------------------------------------(C)A.Ga3N2.Ga2N3C.GaNGa3N9.三氯化氮NCl3在常温下是一种淡黄色气体,其分子呈三角锥型,以下关于NCl3叙述正确的是------------------------------------------------------------------------------------------------------------(D)A.NCl3分子中的电荷分布是均匀、对称的B.NCl3分子是非极性分子C.NCl3分子中不存在孤对电子D.分子中所有原子最外层都达到8个电子的稳定结构二、非选择题(共55分)10.(7分)写出下列粒子的电子式:S(1)硫原子(2)镁离子Mg2+HOClNHHHH(3)氢氧根离子(4)氮气NN2-(5)过氧化钠Na+OONa+(6)氯化铵:(7)二氧化碳OCO11.(6分)AB2离子化合物的阴、阳离子的电子层结构相同,1molAB2分子中含有54mol电子,根据下列反应:①H2+B2C②B2+XY+AB2+H2O③Y+CAB2+Z,Z有漂白作用(1)写出下列物质的化学式AB2CaCl2,XCa(OH)2,YCa(ClO)2,ZHClO。\nClClClClCa(2)用电子式表示AB2的形成过程:++Ca2+(3)写出反应②的化学方程式2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O。12.(6分)在白磷分子中每个磷原子以非极性键键与另外的3个磷原子相结合形成正四面体结构,键角为600,每1mol白磷中含有6molP——P键。如果把一个白磷分子的每个P—P都打开插入一个氧原子,则一共可结合6个氧原子,这样得到的化合物的分子式为P4O6。13.(7分)有A、B、C、D、E五种粒子,其组成均有氢元素,且电子总数为10个。A是双原子的阴离子,根据下列变化,写出粒子的化学式及B粒子的空间结构。①A+BC+D↑②2CA+E③D+E===B+C则AOH-,BNH4+,CH2O,DNH3,EH3O+。OB的形状是正四面体形,C的电子式是HH14.(7分)处于相邻三个周期的元素A、B、C,原子序数依次增大,三者原子序数之和为25,且知B、C处于同一主族,1.8gD与足量盐酸反应生成DCl3和2.24L氢气(标况),E和D处于同周期,且E+和D离子具有相同的电子层结构,元素F和C能形成FC型离子化合物,又知C离子比F离子多一个电子层,试推断:(1)六种元素的名称分别为A氢,B氧,C硫,D铝,E钠,F镁。SSH(2)用电子式表示A和C形成化合物的过程:H++HH15.(8分)1994年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图所示,呈V型,键角为116.5°。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)——三个O原子均等地享有这4个电子。请回答:(1)臭氧与氧气的关系是同素异形体。\n(2)下列分子与O3分子的结构最相似的是C.A.H2OB.CO2C.SO2D.BeCl2(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有5对孤对电子。(4)O3分子是否为极性分子是(是或否)。(5)O3与O2间的转化是否为氧化还原反应(若否,请回答A小题;若是,请回答B小题)。A.O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:1PbS+2O3==1PbSO4+1O2B.O3在催化剂作用下生成1molO2转移电子数mol16.(6分)已知A、B、C、D是中学化学中常见的四种粒子。它们之间存在下图的转化关系。(1)如果A、B、C、D均是10电子的粒子,请写出:OH+A的结构式H—N—H;D的电子HHH(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:①A与B在溶液中反应的离子方程式H2S+OH-===HS-+H2O;②根据上述离子方程式,可以判断C与B结合质子能力的大小是(用化学式或离子符号表示)OH->HS-。17.(8分)晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。NaCl的晶胞结构如下图所示。已知FexO晶体晶胞结构为NaCl形,由于晶体缺陷,X值小于1,测知FexO晶体密度ρ为5.71g·cm-3,晶胞边长为4.28×10-10m。(铁相对原子质量为55.9,氧相对原子质量为16)Na+Cl-\n求:(1)FexO中x值(精确到0.01)为0.92。(2)晶体中的铁分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占的分数(用小数表示精确到0.001)为:0.826。(3)此晶体的化学式(化学式中表示出Fe2+和Fe3+的个数)为:Fe2+0.76Fe3+0.16O。(4)在该晶体中,铁元素的离子间的最短距离为:3.03×10-8cm.解:(1)1mol晶胞中含FeXO4mol(按O原子计算)1mol晶胞的质量:(4.28×10-10×100cm)3×5.71g/cm3×6.02×1023==269.50gX==(269.50×1/4-16)÷55.9==0.92(2)设:Fe2+占的分数为Y,根据离子电荷守恒:0.92Y×2+0.92(1-Y)×3==2Y==0.826(3)N(Fe2+)==0.92×0.826==0.76N(Fe3+)==0.92-0.76==0.16(4)铁元素原子间最短距离(S):为最小正方形的对角线。S==4.28×10-8×1/2√2==3.03×10-8cm按住Ctrl键单击鼠标打开教学视频动画全册播放