- 75.00 KB
- 2022-08-30 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
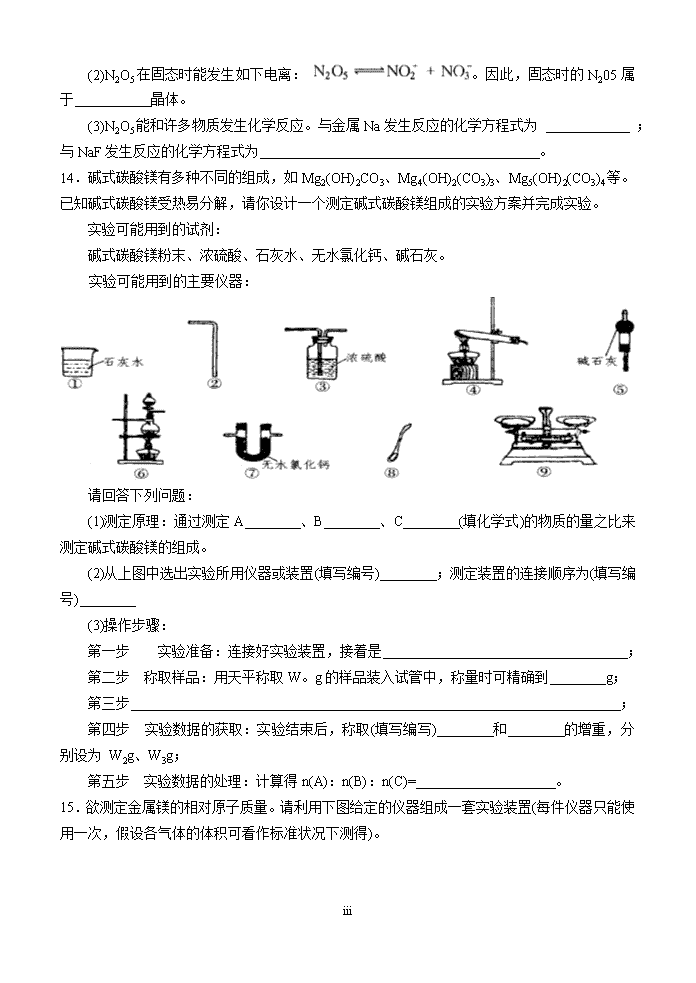
初中化学奥赛测试十四班级:姓名:分数:相对原子质量:H:1Mg:24Fe:56Cu:64S:32Zn:65C:12O:16Cl:35.5N:14P:31Ca:40Na:23Ag:108Ba:137K:39Br:80F:19Al:27I:127一、选择题1.原子的核电荷数小于18的某元素X,原子的电子层数为n,最外层电子数为2n+l,原子中的质子数是2n2-1。有关X的说法不正确的是(n为正整数)()A.X能形成化学式为X(OH)3的碱B.X肯定能形成化学式为NaXO3的含氧酸钠盐C.X原子的最外层电子数和核电荷数肯定为奇数D.X可能与元素Y形成Y3X2型化合物2.20℃时,将某盐R的溶液蒸发掉10g水,恢复到20℃,需在剩余溶液中加入6gR(无水)溶液即达饱和;若将原盐溶液蒸发掉30g水,则只需加入1gR(无水)就可以在20℃达到饱和,20℃时R的溶解度为()A.20gB.25gC.30gD.35g3.如果只有烧碱、盐酸、大理石、硝酸钠、铜片和蒸馏水。从欠缺试剂的角度看,下列无法完成的制备实验项目是()A.纯碱B.氯化铜C.氢气D.95%的浓硝酸4.下列物质①CaSiO3②H2CO3③CaCO3④Ca(HCO3)2,其稳定性由强到弱的排列顺序是()A.①②③④B.①③④②C.②④③①D.①④③②5.已知液态氧气、氮气和二氧化碳.在一个标准大气压下的沸点是-183℃、-196℃和-78.5℃,如果在一个标准大气压下用降温的办法,用空气来提取这些气体,那么温度下降时首先液化被分离出来的是()A.氧气B.氮气C.二氧化碳D.整个空气同时液化无法分离6.在温度保持t℃不变时,某物质M的溶液经过如下变化,下列结论正确的是()A.M溶液一定是不饱和溶液,Ml溶液一定是饱和溶液B.Ml溶液、M2溶液都一定是饱和溶液C.t℃时M的溶液度一定是50克D.M1可能是饱和溶液,M2一定是饱和溶液iv\n7.我国具有悠久的酿酒历史。某白酒的封签上标有”53°’字样,它表示()A.该酒是在53℃的条件下酿制的B.该酒的着火点是53℃C.100g该酒中含有53克酒精D.100mL该酒中含有53mL酒精8.“绿色化学”是当今社会提出的一个新概念,杜绝污染源,提高原子的利用率是“绿色化学”的重要,衡量指标。下列物质均可做氧化剂①O3;②KMnO4;③浓H2SO4;④H2O2;⑤浓HNO3;⑥Ca(ClO)2;⑦KCr2O7其中可称为绿色氧化剂的是()A.①④B.③⑤C.①②⑥⑦D.②⑦9.在测定液态BrF3导电性时发现,20℃时其导电性很强,说明该化合物在液态时发生了电离,存在阴阳离子。其他众多实验证实,存在一系列有明显离子化合物倾向的盐类,如KBrF4、(BrF2)2SnF6、ClF3·BrF3等。由此推断液态BrF3电离时的阴阳离子是()A.Br3+和F-B.Br2F-和F-C.BrF2+和BrF4D.BrF52-和BrF2+10.密度为0.91g/m3的氨水.质量分数为25%.该氨水用等体积的水稀释,所得溶液的质量分数为()A.等于12.5%B.大于12.5%C.小于12.5%D.无法确定11.氧化钙和碳酸钙的固体混合物为120g,将其高温煅烧至碳酸钙完全分解,称得剩余固体的质毽为84g,则原固体混合物中钙元素的质量分数为()A.70%B.20%C.40%D.50%12.某同学在实验报告中记录下列数据,其中正确的是()A.用25mL量筒取12.36mL盐酸B.用托盘天平称取8.75g食盐C.用标准的NaON溶液滴定未知浓度的盐酸,用去NaOH溶液23.10mLD.用广泛pH试纸测得某溶液的pH为3.5二、选择题13.化合物可分为离子化合物和共价化合物,其分类的依据就是看化合物中是否存在着阴、阳离子。共价化合物又可分为极性化合物和非极性化合物,若分子结构对称,则为非极性分子。反之。则为极性分子。在氮氧化物中,N2O5是一种比较有趣的合物。它在低温下呈固态,在温度稍高(如在夏天)就变成了气态,同时发生部分分解,生成氮的低价氧化物和氧气。(1)已知N2O5分子的经典结构为:,则气态时N2O5分子是(填“极性”或“非极性”)化合物,原因是.iv\n(2)N2O5在固态时能发生如下电离:。因此,固态时的N205属于晶体。(3)N2O5能和许多物质发生化学反应。与金属Na发生反应的化学方程式为;与NaF发生反应的化学方程式为。14.碱式碳酸镁有多种不同的组成,如Mg2(OH)2CO3、Mg4(OH)2(CO3)3、Mg5(OH)2(CO3)4等。已知碱式碳酸镁受热易分解,请你设计一个测定碱式碳酸镁组成的实验方案并完成实验。实验可能用到的试剂:碱式碳酸镁粉末、浓硫酸、石灰水、无水氯化钙、碱石灰。实验可能用到的主要仪器:请回答下列问题:(1)测定原理:通过测定A、B、C(填化学式)的物质的量之比来测定碱式碳酸镁的组成。(2)从上图中选出实验所用仪器或装置(填写编号);测定装置的连接顺序为(填写编号)(3)操作步骤:第一步实验准备:连接好实验装置,接着是;第二步称取样品:用天平称取W。g的样品装入试管中,称量时可精确到g;第三步;第四步实验数据的获取:实验结束后,称取(填写编写)和的增重,分别设为W2g、W3g;第五步实验数据的处理:计算得n(A):n(B):n(C)=。15.欲测定金属镁的相对原子质量。请利用下图给定的仪器组成一套实验装置(每件仪器只能使用一次,假设各气体的体积可看作标准状况下测得)。iv\n填写下列各项(气流从左到右):(1)各种仪器连接的先后顺序(用小写字母表示)应是。(2)连接好仪器后,要进行的操作有如下几步,其先后顺序是。①待仪器B中的物质恢复至适当的温度时,测得量筒C中水的体积为VmL;②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为mg,并将其投入试管B中有孔隔板上;③检查装置的气密性;④旋开装置A上分液漏斗的活塞,使其中的水顺利流下,当镁完全溶解时再关闭这个活塞,这时广口瓶A中共放入水VbmL。(3)根据实验数据可算出金属镁的相对原子质量,其数学表达式为。(4)若试管B的温度未冷却至室温,就读出量筒C中水的体积,这将会使所测相对原子质量数据(填“偏大”、“偏小”或“无影响”)。(5)若未擦净镁条表面的氧化膜就进行实验,这将使所测相对原子质量数据(填“偏大”、“偏小”或“无影响”)。16.氢元素除H原子外,还有一种原子D(重氢),其原子核内含有一个质子,一个中子由D、O构成的水D2O叫重水.通电分解水的反应简称电解水,重水电解时发生的反应与H2O相同。现有一重水(D2O)和水(H2O)的混合物,用电解法测定其中D2O的质量分数,当Wg这种混合物被电解时.与电源正极相连的试管内收集到气体W1g与电源负极相连的试管内收集到气体W2g(电解产物的溶解忽略不计)。实验装置如图:(1)若要求出重水的质量分数a,至少需要上述W、W1、W2等3个数据中的个。这样的数据共有几组.在下表中分别列出:(有多少填多少)①②③④⑤⑥(2)从上表中任取一组含W1的数据.计算D2O的质量分数。iv