- 94.19 KB
- 2022-08-31 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
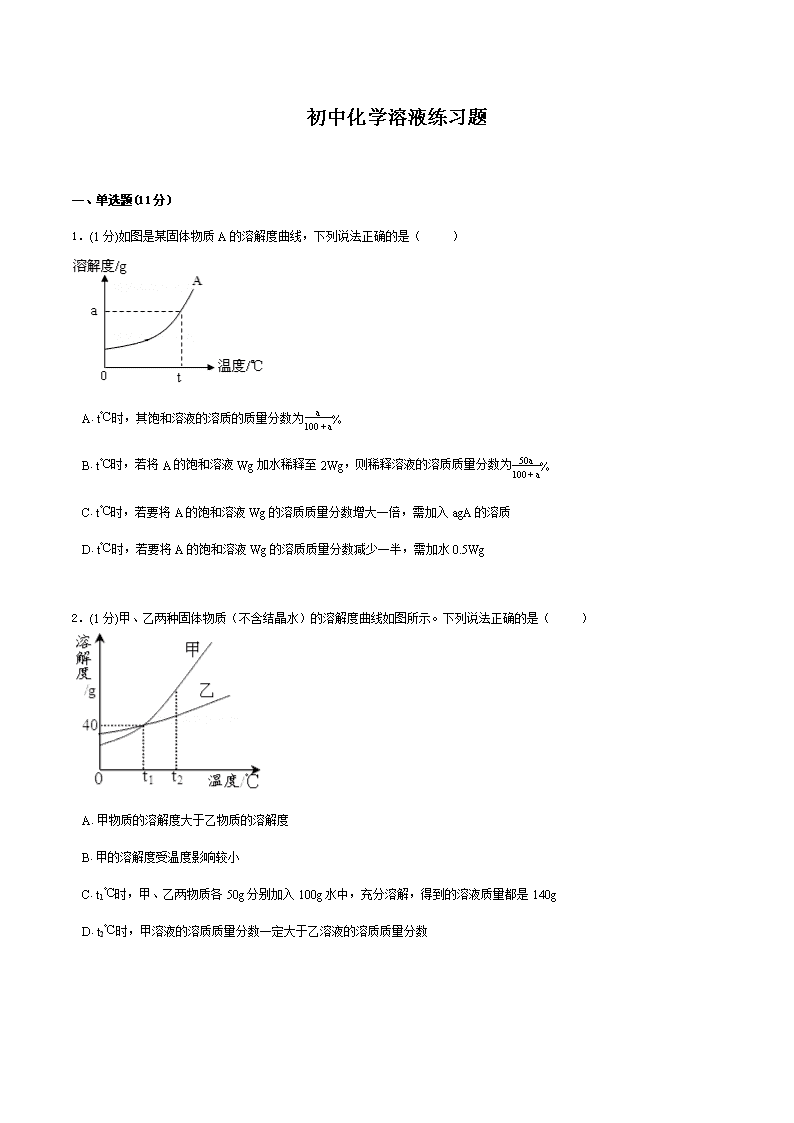
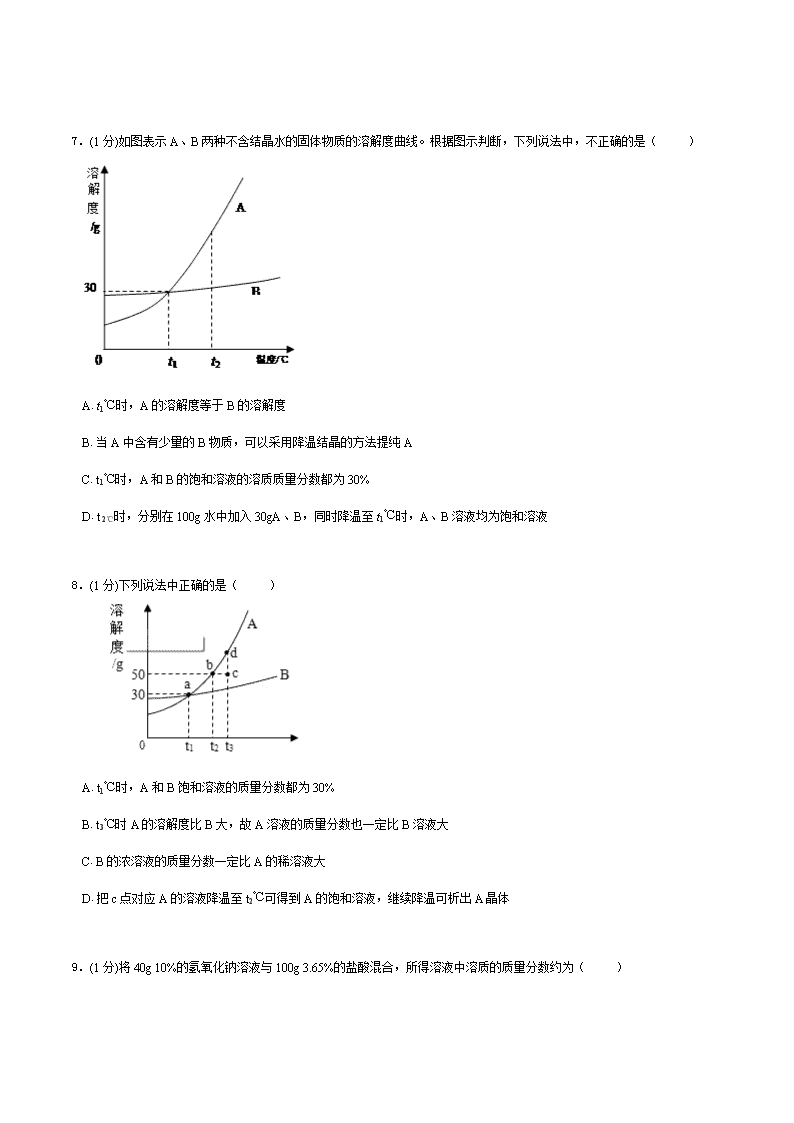
初中化学溶液练习题一、单选题(11分)1.(1分)如图是某固体物质A的溶解度曲线,下列说法正确的是( ) A.t℃时,其饱和溶液的溶质的质量分数为a100+a% B.t℃时,若将A的饱和溶液Wg加水稀释至2Wg,则稀释溶液的溶质质量分数为50a100+a% C.t℃时,若要将A的饱和溶液Wg的溶质质量分数增大一倍,需加入agA的溶质 D.t℃时,若要将A的饱和溶液Wg的溶质质量分数减少一半,需加水0.5Wg2.(1分)甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法正确的是( ) A.甲物质的溶解度大于乙物质的溶解度 B.甲的溶解度受温度影响较小 C.t1℃时,甲、乙两物质各50g分别加入100g水中,充分溶解,得到的溶液质量都是140g D.t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数\n3.(1分)t℃时,甲、乙两个烧杯中各盛有100g相同浓度的KCl溶液。现将甲烧杯中的溶液蒸发掉35.0gH2O,恢复到t℃时,析出KCl固体5.0g;乙烧杯中的溶液蒸发掉45.0gH2O,恢复到t℃时,析出KCl固体10.0g。下列说法正确的是( ) A.原溶液的质量分数为33.3% B.t℃时,KCl的溶解度为50.0g C.原溶液的质量分数为50% D.两烧杯中剩余溶液的质量分数不同4.(1分)双氧水是过氧化氢的水溶液,一定溶质质量分数的双氧水可用于医疗消毒。某瓶双氧水中氢元素与氧元素的质量比为1∶10,则该瓶双氧水中溶质的质量分数为( ) A.3.1% B.30% C.35.2% D.38.6%5.(1分)甲、乙两种固体的溶解度曲线如图所示。下列说法中,不正确的是( ) A.M点表示在20℃时,甲、乙的溶解度相同 B.20℃时,分别在50g水中加入50g甲、乙,加热到40℃时,二者均为饱和溶液 C.40℃时,分别在100g水中加入50g甲、乙,所得溶液中溶质的质量分数:甲大于乙 D.40℃时,分别在100g水中加入30g甲、乙,同时降温至20℃,析出固体的质量:甲大于乙6.(1分)下列图象不能正确反映其对应操作中各量变化关系的是( ) A.高温煅烧一定质量的石灰石 B.在密闭容器内加热一定质量的铜粉 C.将一定质量的KNO3饱和溶液恒温蒸发水分 D.向一定质量部分变质的NaOH溶液中滴加稀盐酸\n7.(1分)如图表示A、B两种不含结晶水的固体物质的溶解度曲线。根据图示判断,下列说法中,不正确的是( ) A.t1℃时,A的溶解度等于B的溶解度 B.当A中含有少量的B物质,可以采用降温结晶的方法提纯A C.t1℃时,A和B的饱和溶液的溶质质量分数都为30% D.t2℃时,分别在100g水中加入30gA、B,同时降温至t1℃时,A、B溶液均为饱和溶液8.(1分)下列说法中正确的是( ) A.t1℃时,A和B饱和溶液的质量分数都为30% B.t3℃时A的溶解度比B大,故A溶液的质量分数也一定比B溶液大 C.B的浓溶液的质量分数一定比A的稀溶液大 D.把c点对应A的溶液降温至t2℃可得到A的饱和溶液,继续降温可析出A晶体9.(1分)将40g10%的氢氧化钠溶液与100g3.65%的盐酸混合,所得溶液中溶质的质量分数约为( )\n A.14140×100% B.5.85140×100% C.×100% D.58.5140×100%10.(1分)20℃时,向ag食盐水中加入bg食盐,充分搅拌后,得mg食盐水,则a、b、m之间的关系为( ) A.a+b=m B.a+b≤m C.a+b≥m D.a+b<m11.(1分)标准状况下,aLHCl溶于1000g水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是( ) A.a22.4mol/L B.ab22400mol/L C.ab22400+36.5amol/L D.1000ab22400+36.5amol/L二、填空题(2分)12.(1分)下图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:(1)P点的含义是 。(2)t2℃时30ga物质加入到50g水中不断搅拌,形成的是 (填“饱和”或“不饱和”)溶液,所得溶液质量为 g。(3)a中混有少量的b,若要从混合液中分离出a可采用的方法是 。(4)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大到小的顺序是 。13.(1分)20℃时,将等质量的甲、乙两种固体物质,分别加人到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:(1)图1中一定为饱和溶液的是 。(2)图2中甲、乙两溶液中溶质质量分数的大小关系为 。(3)图3中表示乙的溶解度曲线是 ;\n三、简答题(1分)14.(1分)如图是a、b、c三种物质的溶解度曲线,请据图回答:(1)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是 (填序号,下同);(2)t2℃时,将100ga物质加入到100g水中并充分搅拌,形成溶液的质量为 g;(3)将t2℃时a、b、c三种物质的饱和溶液降低温度到t1℃时,这三种溶液中溶质质量分数的大小关系是 。四、计算题(1分)15.(1分)某地一辆满载浓硫酸的罐车翻到,导致25t溶质的质量分数为98%的浓硫酸泄漏,并向路基两边蔓延,接到报警后消防官兵立即赶来并用石灰浆(主要成分为氢氧化钙)中和硫酸解除了险情。请回答:(1)25t溶质的质量分数为98%的浓硫酸中含H2SO4的质量为_________;(2)计算:中和泄漏的硫酸,理论上需要多少吨氢氧化钙;(3)处理一定量的硫酸,理论上既可用m1吨的氢氧化钙粉末,也可选用m2吨的氧化钙粉末,还可用m3吨碳酸钙粉末,则m1、m2、m3的数值大小关系为____________。\n初中化学溶液练习题答案一、单选题1.【答案】B【解析】A项,由于在t℃时,A的溶解度是ag,即100g水中最多溶解agA,则其饱和溶液中溶质的质量分数为a100+a×100%=100a100+a%,故A错误;B项,由于在t℃时,A的饱和溶液中溶质的质量分数为为a100+a×100%=100a100+a%,若将A的饱和溶液Wg加水稀释至2Wg,则稀释溶液的溶质质量分数为W×a100+a2W×100%=50a100+a%,故B正确;C项,由于在t℃时,A的溶液是饱和溶液,不可能再通过加入溶质的方法使溶液中溶质的质量分数增大,故C错误;D项,由于在加水的过程中溶质的质量不变,可设加水的质量为x,则:W×a100+aW+x=12×50a100+a,x=w,故D错误;故答案为:B。2.【答案】C【解析】A、由于固体物质的溶解度会随温度的变化而变化,从图中可以看出,只有在高于t1℃时,甲的溶解度大于乙的溶解度,故错误;B、由图象可知甲的溶解度随温度变化的更明显一些,图象更陡,故错误;C、t1℃时,甲、乙两物质的溶解度相等,均为40g,甲、乙两物质各50g分别加入100g水中,充分溶解,得到的溶液质量都是140g,故正确D、由于不知两溶液是否饱和,故无法比较t2℃时,甲乙溶液的溶质质量分数的大小,故错误故选C。3.【答案】B【解析】两个烧杯中的溶液蒸发掉溶剂后都析出了晶体,所以可以判断出所得溶液均为饱和溶液,D选项错。第一次蒸发后得到的溶液即为饱和溶液,第二次蒸发相当于在第一次的基础上又蒸发掉10.0g水,也就是10.0g水中溶解5.0g氯化钾达到饱和。所以其溶解度为50.0g,B选项正确。其饱和溶液的浓度为33.3%,A、C选项错。答案:B。4.【答案】D【解析】设此溶液总质量为100g,该瓶双氧水中溶质的质量分数为a%,则过氧化氢的质量为ag,水的质量为100g-ag,过氧化氢中含氢元素质量为g,含氧元素质量为g,溶剂中含氢元素的质量为g,溶剂含氧元素的质量为g,则双氧水中氢元素与氧元素的质量比为,解得a=38.6%,所以该瓶双氧水中溶质的质量分数为38.6%。\n 5.【答案】D【解析】A、在M点是对应温度为20℃两物质溶解度曲线相交,所以含义为在20℃时甲乙的溶解度相同.正确.B、在20℃时在50g水中分别加入50g甲乙物质,加热到40℃时由于两者溶解度分别为50g、40g,所以50g水在40℃两者最多溶解分别为25g、20g,都有剩余,所以是饱和溶液.正确.C、在40℃时,分别在100g水中加入甲乙两物质50g,此时甲的溶解度为50g,而乙的溶解度为40g,所以两者都饱和,且乙有剩余.所以质量分数甲大于乙.正确.D、在40℃时,分别在100g水中加入30g甲乙物质时,当降温到20℃,需要按照20℃的溶解度来分析,由于该温度下溶解度都是30g,所以都饱和,且都无晶体析出.错误.故选D。6.【答案】C【解析】A、反应的化学方程式为CaCO3高温CaO+CO2↑,反应前固体为CaCO3,其相对分子质量为100,反应后固体只有CaO,其相对分子质量为56,可以得出所得固体质量逐渐减少且不为零,与图象所示吻合,故A对;B、由质量守恒定律的定义可知,反应前后物质总质量不发生改变,此反应在密闭容器中进行,无其他物质的进入或散失,故物质总质量不会改变,与图象所示吻合,故B对;C、对饱和溶液恒温蒸发溶剂时,由于溶剂减少,溶质也会析出,即溶液一直呈饱和状态.由于温度不变,其溶解度也不变,而饱和溶液中,溶质质量分数=溶解度/(100g+溶解度)×100%,溶解度不变则溶质质量分数不变,与图象所示不相吻合,故C错;D、氢氧化钠变质会生成碳酸钠,加入盐酸后发生两个反应:盐酸与氢氧化钠发生中和反应、盐酸与碳酸钠发生复分解反应,而中和反应发生于另一反应之前,故开始无气体产生,当中和反应完毕后,盐酸与碳酸钠才反应生成二氧化碳气体,与图象所示吻合,故D对.故选C。7.【答案】C【解析】A、t1℃时,A的溶解度等于B的溶解度,正确;B、由于A溶解度随着温度变化比较大,B溶解度随着温度变化比较小所以可以采用降温结晶的方法提纯A的方法,故说法正确;C、t1℃时,A的溶解度等于B的溶解度=30g,A和B的饱和溶液的溶质质量分数=30g/130 100%23%,故错误;D、t1℃时,A、B物质的溶解度等于30g,100g水中加入30g,A、B溶液均为饱和溶液,故正确。故选C。8.【答案】D【解析】A.错误,溶解度都是30g,溶质质量分数是30/(30+100)*100%=23%B.错误,只有饱和溶液才成立.C.错误,温度高于t3时,A稀溶液的质量分数是大于B的浓溶液的.D.正确,由曲线可以看出。9.【答案】B【解析】40g10%的氢氧化钠溶液中含氢氧化钠质量40g×10%=4g,100g3.65%的盐酸中含HCl的质量=100g×3.65%=3.65g,根据反应的化学方程式,两溶液混合时恰好完全反应,反应后得到氯化钠溶液;设反应生成氯化钠的质量为x。NaOH+HClNaCl+H2O 40 36.5 58.5 4g 3.65g x404g=58.5xx=5.85g\n所得溶液中溶质的质量分数=5.85g40g+100g×100%=5.85140×100%;故答案为:B。10.【答案】C【解析】若ag食盐水不饱和,加入食盐会溶解,得到的食盐水的质量增大,若全溶解,a+b=m;若不能全溶只能溶解其中一部分,a+b>m;若ag食盐水饱和,加入食盐不溶解所得溶液质量与原溶液质量相等,a+b>m,故答案为:C。11.【答案】D【解析】将标准状况下的aLHCl(气)的物质的量为aL22.4L/mol=a22.4mol;氯化氢的质量为a22.4mol×36.5g/mol=36.5a22.4g所以溶液质量为1000g+36.5a22.4g=1000+36.5a22.4g;所以溶液的体积为(1000+36.5a22.4)gbg/mL=22400+36.5a22.4bmL=22400+36.5a22.4b×10−3L;所以溶液浓度为a22.4mol22400+36.5a22.4b×10−3L=1000ab22400+36.5amol/L;故答案为:D。二、填空题12.【答案】(1)t1℃时,a、c的溶解度相等,均为20g 饱和 75g 降温结晶 b>a>c【解析】(1)P点两曲线相交表示t1℃时,a、c的溶解度相等,均为20g,(2)t2℃时,a物质的溶解度为50克,指的是在100克水中最多只能溶解50克,在50克水中只能溶解25克,所以加入30克,不能完全溶解,所以是饱和溶液,所得溶液质量为25+50=75克(3)a的溶解度随温度的升高而增大,且受温度影响很大,而b物质受温度变化较小,所以a中混有少量的b,若要从混合液中分离出a可采用的方法是降温结晶(4)a、b的溶解度随温度的升高而增大,c的溶解度随温度的升高而减小,将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,a、b都变成了不饱和溶液,其溶质质量分数还是b>a,而c要析出晶体,其质量分数变小,所以c最小。13.【答案】(1)甲 相等 N【解析】图1的甲中还有未溶解的固体存在,故为饱和溶液;从图2可以看出,50℃时,甲、乙两种物质都已完全溶解,且它们的溶质和溶剂的质量都相等,所以它们所得到的溶质的质量分数也相等;对比图1和图2的信息可知,甲的溶解度受温度影响较大,所以受温度影响较小的N表示的是乙物质的溶解度曲线。 三、简答题14.【答案】(1)a>b>c(2)150(3)b>a>c【解析】(1)由溶解度曲线图可以看出,在t2℃时abc的溶解度关系为a>b>c;故答案为:a>b>c\n(2)由溶解度曲线图可以看出在t2℃时,a物质的溶解度为50g,所以在t2℃时,100g水最多能溶解50ga物质,故形成溶液的质量为100g+50g═150g故答案为:150(3)由溶解度曲线图可以看出,在t2℃时abc的溶解度关系为a>b>c,根据饱和溶液中溶质质量分数的计算公式,可以判断此时其质量分数关系为a>b>c,降温后a、b溶液中均有晶体析出,还是饱和溶液,但在t1℃时,a的溶解度比b小,所以此时溶质质量分数为:b>a,c的溶解度随温度降低而升高变为不饱和溶液,则溶质质量分数将不变,故所得溶液的溶质质量分数由大到小的顺序是bac.故答案为:b>a>c。 四、计算题15.【答案】(1)24.5t (2)18.5t(3)m3>m1>m2【解析】(1)25t质量分数为98%的浓硫酸中硫酸的质量=25t×98%=24.5t;(2)设理论上需要氢氧化钙的质量为X。Ca(OH)2+H2SO4CaSO4+2H2O 74 98 X 24.5t74:98=X:24.5t解之得X=18.5t答:中和泄漏的硫酸,理论上需要约18.5吨氢氧化钙;(3)设一定量硫酸的质量为m,分别与m1吨氢氧化钙粉末、m2吨氧化钙粉末、m3吨碳酸钙粉末恰好完全反应。Ca(OH)2+H2SO4=CaSO4+2H2O CaO+H2SO4=CaSO4+H2O CaCO3+H2SO4=CaSO4+H2O+CO2↑ 74 98 56 98 100 98 m1t m m2t m m3t m74:98=m1t:m 56:98=m2t:m 100:98=m3t:m解之得m1= t 解之得m2= t 解之得m3= t则m1、m2、m3的数值大小关系为:m3>m1>m2答:m1、m2、m3的数值大小关系为:m3>m1>m2。