- 382.35 KB
- 2022-09-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
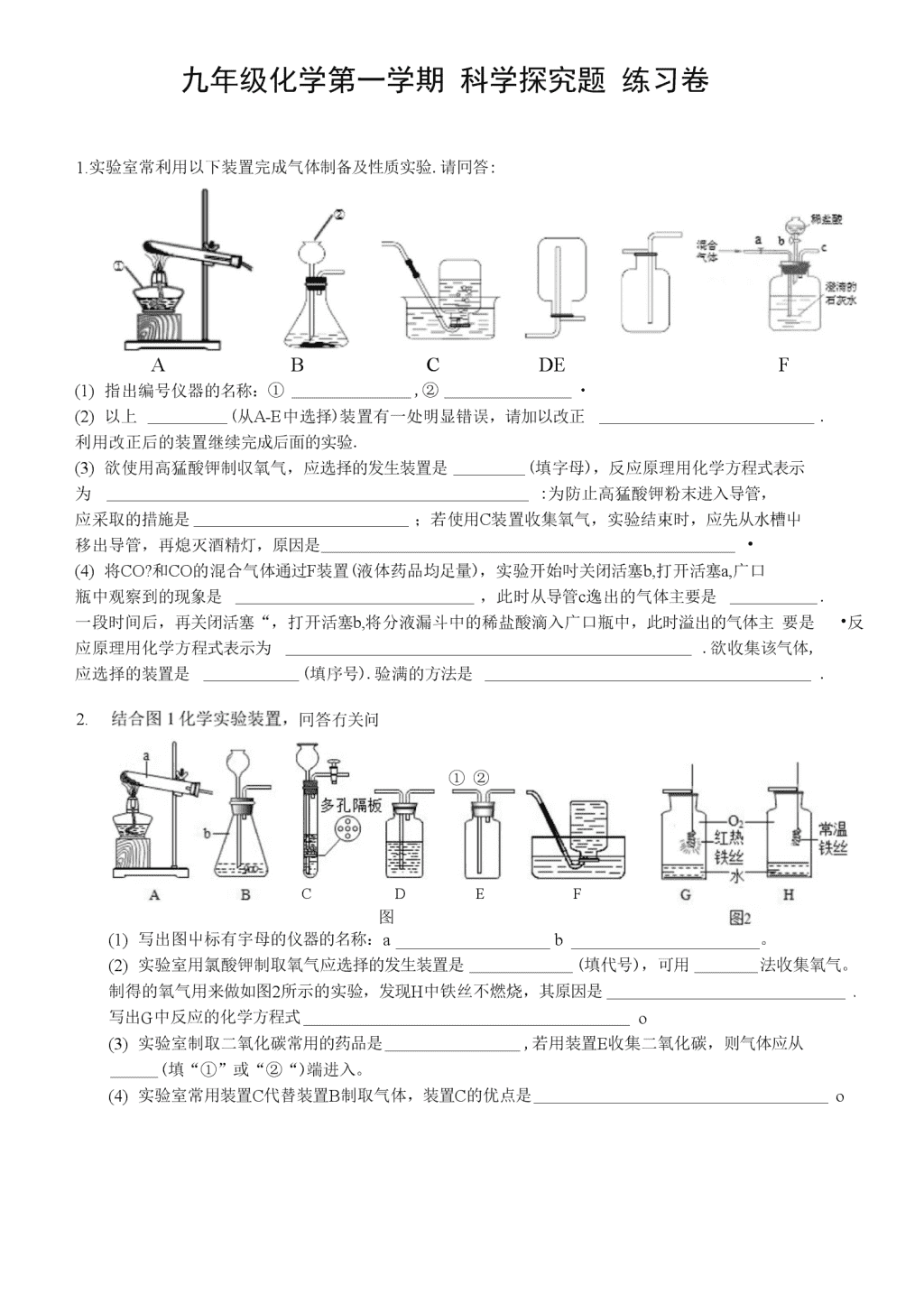
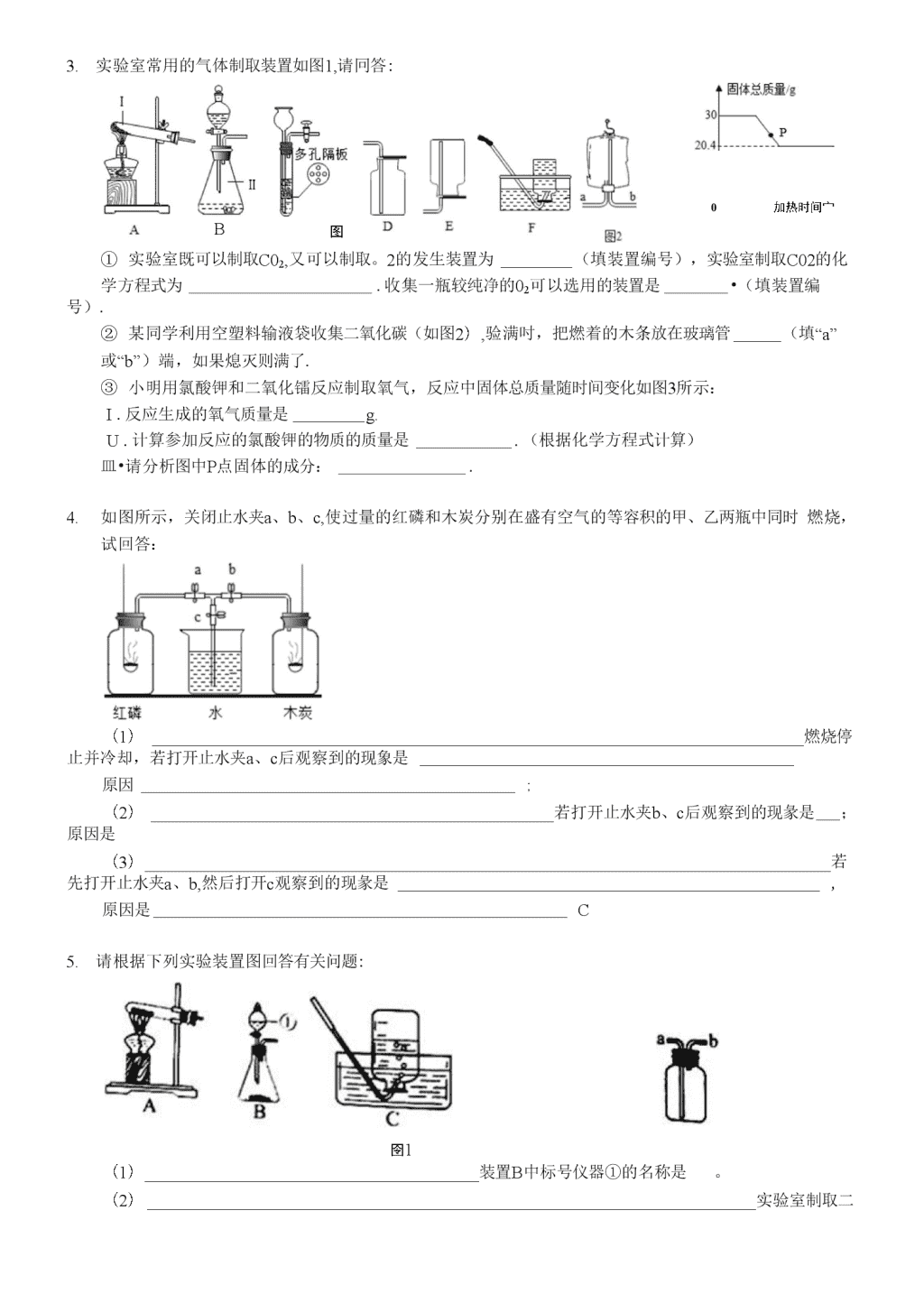
九年级化学第一学期科学探究题练习卷1.实验室常利用以下装置完成气体制备及性质实验.请冋答:ABCDEF(1)指出编号仪器的名称:①,②・(2)以上(从A-E中选择)装置有一处明显错误,请加以改正.利用改正后的装置继续完成后面的实验.(3)欲使用高猛酸钾制収氧气,应选择的发生装置是(填字母),反应原理用化学方程式表示为:为防止高猛酸钾粉末进入导管,应采取的措施是;若使用C装置收集氧气,实验结束时,应先从水槽屮移出导管,再熄灭酒精灯,原因是•(4)将CO?和CO的混合气体通过F装置(液体药品均足量),实验开始吋关闭活塞b,打开活塞a,广口瓶中观察到的现象是,此时从导管c逸出的气体主要是.一段时间后,再关闭活塞“,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时溢出的气体主要是•反应原理用化学方程式表示为.欲收集该气体,应选择的装置是(填序号).验满的方法是.2.冋答冇关问题。CD图1①②EF(1)写出图屮标有宇母的仪器的名称:ab。(2)实验室用氯酸钾制取氧气应选择的发生装置是(填代号),可用法收集氧气。制得的氧气用来做如图2所示的实验,发现H中铁丝不燃烧,其原因是、写出G中反应的化学方程式o(3)实验室制取二氧化碳常用的药品是,若用装置E收集二氧化碳,则气体应从(填“①”或“②“)端进入。(4)实验室常用装置C代替装置B制取气体,装置C的优点是o\n3.实验室常用的气体制取装置如图1,请冋答:B图10加热时间宀①实验室既可以制取C02,又可以制取。2的发生装置为(填装置编号),实验室制取C02的化学方程式为.收集一瓶较纯净的02可以选用的装置是•(填装置编号).②某同学利用空塑料输液袋收集二氧化碳(如图2),验满吋,把燃着的木条放在玻璃管(填“a”或“b”)端,如果熄灭则满了.③小明用氯酸钾和二氧化镭反应制取氧气,反应中固体总质量随时间变化如图3所示:I.反应生成的氧气质量是g.U.计算参加反应的氯酸钾的物质的质量是.(根据化学方程式计算)皿•请分析图中P点固体的成分:.4.如图所示,关闭止水夹a、b、c,使过量的红磷和木炭分别在盛有空气的等容积的甲、乙两瓶中同时燃烧,试回答:(1)燃烧停止并冷却,若打开止水夹a、c后观察到的现象是原因;(2)若打开止水夹b、c后观察到的现彖是;原因是(3)若先打开止水夹a、b,然后打开c观察到的现彖是,原因是C5.请根据下列实验装置图回答有关问题:囹1(1)装置B中标号仪器①的名称是。(2)\n实验室制取二氧化碳的化学方程式为。选择的发生装置是(填字母编号)o(3)用双氧水和二氧化鎰制取氧气的化学方程式为,反应后过滤、干燥,所得到的二氧化猛(填“能”或不能”)继续作为双氧水分解的催化剂。\n(4)装置C、D、E、F在实验室中都可收集气体,其中不能用来收集氧气的是(填字母编号)。若用F装置收集二氧化碳,气体应从(填“a”或“b”)端通入。(5)某化学兴趣小组借助氧气传感器探究微粒的运动,数据处理软件可实时绘出氧气体积分数随时间变化的曲线。收集一塑料瓶氧气进行以下三步实验:①敞口放置;②双手贴在塑料瓶外壁上;③将塑料瓶的瓶口朝下,三步实验中测得氧气的体积分数随时间变化的曲线依次为图2中的MN段、NP段和PQ段。允浏W(散II时何①能够说明氧分子不断运动的曲线是A.MN段B.NP段C.PQ段②MN段和NP段相比较,说明-③随着实验的进行,传感器测出氧气的体积分数约为时儿乎不再变化。3.某化学兴趣小组完成了如图所示的化学实验(装置气密性良好),证明了二氧化碳的组成.探究过程如下:I•称量装有干燥块状木炭的试管D总质量为50.7g,装有碱石灰的干燥管C总质量为112.3g,连接A、B、D装置;II.从从长颈漏斗中加入3%的过氧化氢溶液,连接C装置,点燃酒精灯;III.待D屮发生反应,熄灭酒精灯,冷却;IV.称量试管D及剩余固体质量为50.1g,装置C及剩余固体质量为114.5g.已知:碱石灰和生石灰能够吸收水蒸气和二氧化碳,木炭中的杂质不参加反应,B、C中所装药品是足量的能够完全吸收相关物质•请冋答下列问题:(1)装置A中发生反应的化学方程式为,该反应属于反应;(2)酒精灯的作用是;(3)为减少误差,步骤III冷却过程中需要注意的问题是;(4)根据实验数据计算参加反应的氧气质量为;从而计算出二氧化碳屮碳、氧元素质量之比.(列式并计算计算结果)\n3.根据下列装置图冋答问题.(1)写出图屮标示仪器的名称:①,②•(2)用A装置制取。2的化学方程式为,收集纯净的。2可以用法收集•该装置还可以用来制取气体.(3)若按BtCtDtE顺序连接装置,制取。2并进行碳及其氧化物的部分性质实验.正确的接口顺序为atbtctdtet,实验中C装置处观察到的现象为•(4)实验结束,应先撤离g处导管,再熄灭酒精灯.如果先熄灭B、C两处酒精灯,则D屮观察到的现彖有:、石蕊试纸变蓝.8.化学来源于生活、化学与生活密切相关.(1)食品包装中充2以防腐,是由于2的化学性质(2)“合理膳食,均衡营养”会让我们更健康.①下列食品中富含钙质的是(填序号,下同).A.鸡蛋B.馒头②为了预防大脖子病,幼儿及青少年可以补充一些含元素的食品.(3)生活中的下列做法,有利于人体健康的是.A.食用霉变的花生B.倡导不吸烟C.食用甲醛溶液浸泡的海产品(4)已知石蜡的着火点约为190°C,蜡烛的火焰由气态石蜡燃烧形成,如杲所示,在温度计示数为280弋以上时,快速推动活塞,会观察蜡烛立即熄灭.蜡烛熄灭的主要原因是(填序号).A.移动可燃物B.隔绝氧气C.降低温度至着火点以下C巌菜9.某研究小组对过氧化氢溶液制取干燥的氧气进行如下探究:实验一:氧气制取和性质实验。(1)现有如图1装置①实验室用过氧化氢溶液制氧气的化学方程式为,应选择的发生装置和收集装置分别是(填标号,下同)和0②检查B装置气密性的操作是③用收集的氧气进行“铁丝在氧气中燃烧”的实验,观察到的现象是反应的化学方程式为C\n实验二:探究出。2质量分数、温度对反应速率的影响(2)设计如下表实验方案:实验序号出。2质量分数/%温度/©C每分钟气泡数13010(不填)23020(不填)33030(不填)41530(不填)5ab(不填)①实验1〜3的实验目的是(^2^3=;b=o实验三:探究制取氧气的适宜催化剂(3)实验方案如下:I.用MnO2、CuO、Fe2O3.CRO3四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。II.取30粒含Mn02的海藻酸钠微球,采用图2装置进行实验。改用其他三种微球,分别重复上述实验,得到图3的锥形瓶内压强随时间变化的曲线图。①每次实验时,海藻酸钠微球数应相同的原因,②用含Mil。?的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因可能是③从实验曲线看,催化效果较好、反应温和的催化剂是=10.实验室常用的制备气体的部分装置如图所示,请根据要求完成问题.,若用装置F收集①写出图中编号仪器的名称:a,b②用装置A制取氧气的化学方程式氧气,判断氧气集满的方法是;若在反应结束时未及时将导管移出水面而先熄灭酒精灯,可能发生的后果是\n③某班级学生通过实验确定制収二氧化碳的原料.试管编号实验步骤现象结论甲稀盐酸中放入粉末状碳酸钠反应剧烈产生大量气泡选择为原料最合适,该反应的化学方程式是乙稀盐酸中放入粉末状碳酸钙丙稀盐酸中放入块状碳酸钙反应上图中均可用于控制实验制取与停止的发主装置是(填写上图字母序号).检验C02气体常用澄清石灰水,有关化学方程式是.①实验室用锌粒和稀硫酸可以在装置E中制取氢气,反应中关闭活塞K,反应就会自行停止的原因是②装置A〜E中导气管都只伸出橡皮塞一点点的原因是.③某同学把足量蜡烛在如图密闭的集气瓶内燃烧至熄灭•用仪器测出瓶内氧气含量的变化如图所示•判断正确的是.A.蜡烛熄灭后瓶内只剩二氧化碳气体C.该过程中瓶内物质总质量不断减少B.实验过程中既有物理变化,又有化学变化D.氧气浓度小于一定值时,蜡烛无法燃烧.10.化学教材“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣.【提出问题】(1)氧化铁能否作过氧化氢溶液分解的催化剂?(2)氧化铁与二氧化镭催化效果哪个好?(3)催化剂的质量是否对过氧化氢溶液分解的速率产生影响?【实验探究】实验步骤实验现象①分别量取5mL5%过氧化盘溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管屮插入带火星的木条,观察现象.A试管中产生大量气泡,带火星木条复燃,B试管中的现象:②待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条仲入试管内,如此反复多次实验,观察现象.试管中均产生大量气泡,带火星木条均复燃③将实验②中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag・/④分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化镒粉末,观察现象./(1)A中产生的气体是;B试管中的现象.(2)实验②、③证明:氧化铁的和在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;\n⑶实验设计④的目的是,若实验④观察到D试管中产生气泡的速率更快,由此你可以得到的结论是.(2)兴趣小组同学设计了如图1实验装置,利用压强传感器测不同质量二氧化猛对双氧水分解快慢的影响.在8mL3%的双氧水中分别加入T0.03g,0.06g,0.08g,0.12g,0.24gMn02.'»J得容器内压强的变化曲线如图2所示(曲线的斜率表征催化反应的速率).请观察图,冋答问题:压强传感器100—0102030405060708090时间s(I)根据图2可发现:该实验条件下,30s内催化分解浓度为3%的双氧水,MnO?的最小用量为g.(U)根据图2,下列说法正确的是.a.—定范围内,二氧化猛用量越多,双氧水分解越快;b.反应容器的气密性,对实验所测数据的精确度有影响;c.称量的二氧化镒质量的精确度对实验装置屮最终的压强大小没有影响.10.为了比较氧化铜和二氧化鎰对过氧化氢分解的催化效果,安妮同学用如图1所示的装置进行了两次实验,在试管中分别加入等质量的氧化铜和二氧化镭,分别将注射器内盛有的3mL5%的双氧水注入试管中,利用注射器收集氧气,收集到氧气的体积和时间的关系如图2所示。氣气体积(1)装入药品前检查该装置气密性的方法是开始实验时注入双氧水的方法是(填字母),A、快速推注射器活塞B、缓慢推注射器活塞另一种方法除了误差较大,还可能造成的后果是。实验中造成U形管内红墨水液面左低右高的原因是O(2)根据氧气的体积不同,可比较两种催化剂的催化效果,通过图象除了能得出二氧化猛催化效果比氧化铜好,还能得出的结论是0⑶由氧化铜催化的反应,5〜垃时间段反应速率逐渐变(填“快”或“慢”),原因是;E〜t2吋I'可段反应速率又逐渐变(填“快”或“慢”),原因是