- 2.85 MB
- 2022-09-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
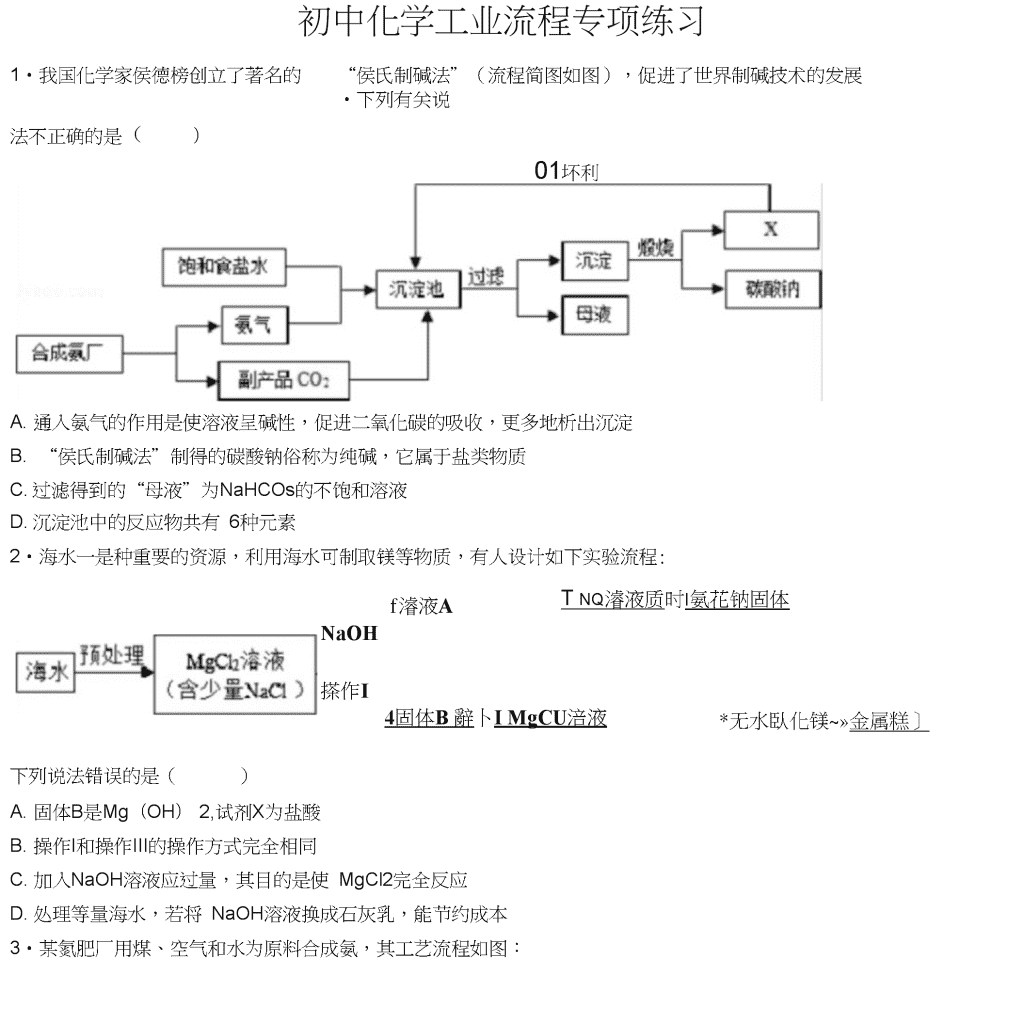
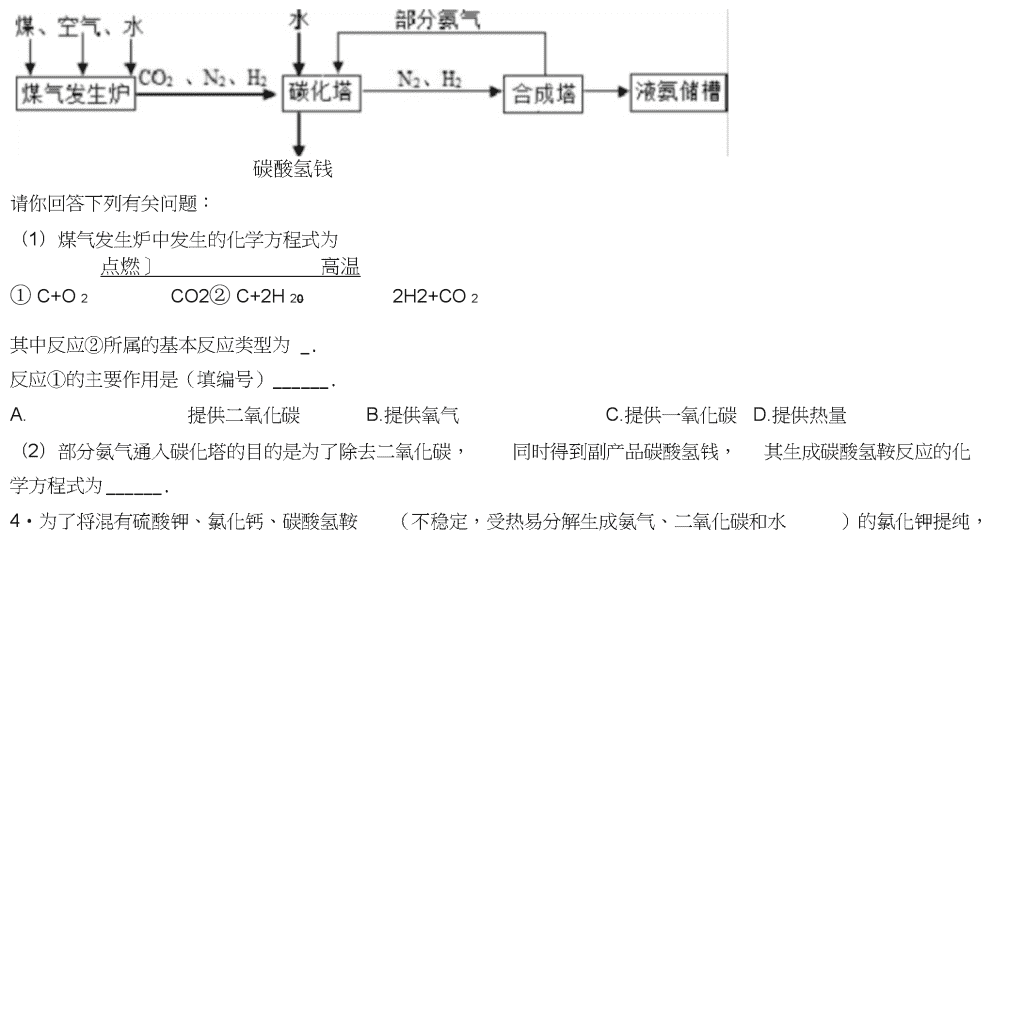
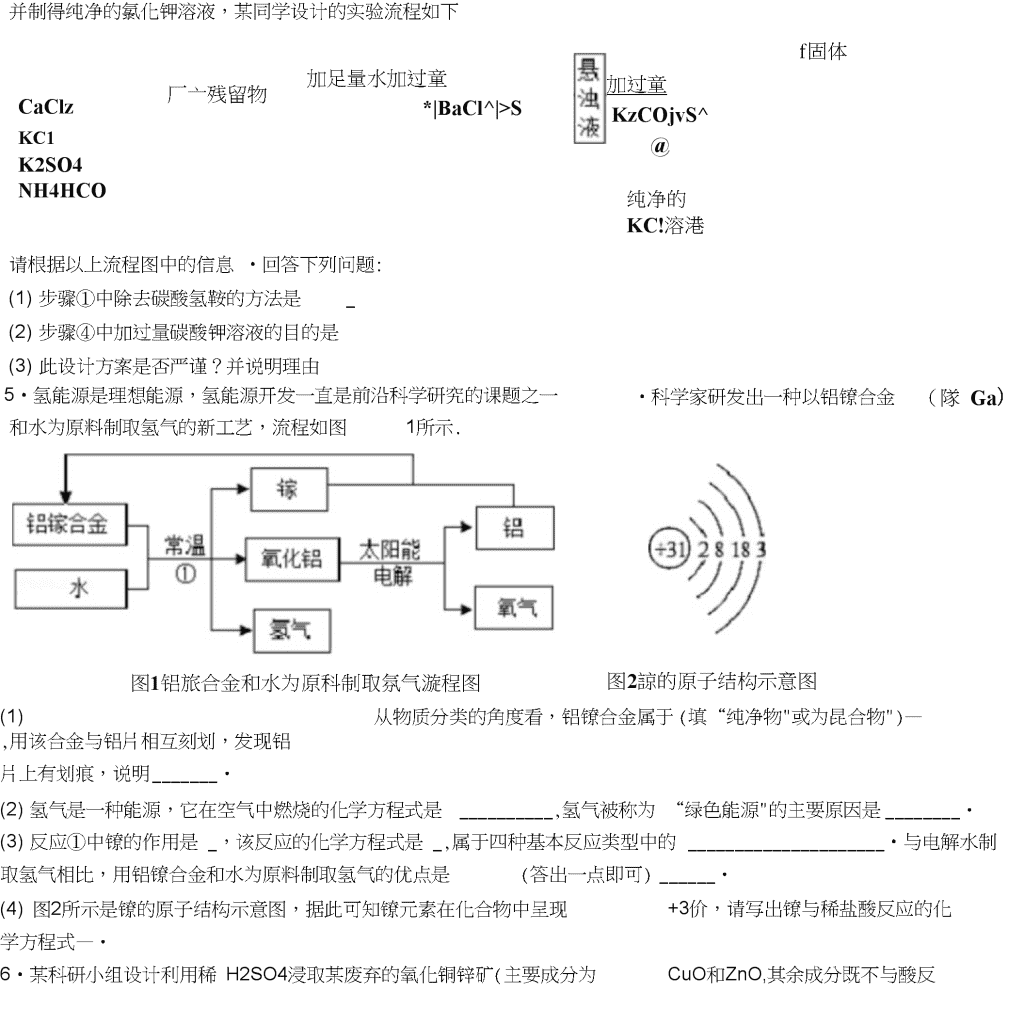
初中化学工业流程专项练习1•我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),促进了世界制碱技术的发展•下列有关说法不正确的是()01坏利用A.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀B.“侯氏制碱法”制得的碳酸钠俗称为纯碱,它属于盐类物质C.过滤得到的“母液”为NaHCOs的不饱和溶液D.沉淀池中的反应物共有6种元素2•海水一是种重要的资源,利用海水可制取镁等物质,有人设计如下实验流程:f濬液ATnq濬液质时I氨花钠固体NaOH搽作I4固体B辭卜IMgCU涪液*无水臥化镁~»金属糕]下列说法错误的是()A.固体B是Mg(OH)2,试剂X为盐酸B.操作I和操作III的操作方式完全相同C.加入NaOH溶液应过量,其目的是使MgCl2完全反应D.处理等量海水,若将NaOH溶液换成石灰乳,能节约成本3•某氮肥厂用煤、空气和水为原料合成氨,其工艺流程如图:\n碳酸氢钱请你回答下列有关问题:(1)煤气发生炉中发生的化学方程式为点燃]高温①C+O2CO2②C+2H202H2+CO2其中反应②所属的基本反应类型为_.反应①的主要作用是(填编号).A.提供二氧化碳B.提供氧气C.提供一氧化碳D.提供热量(2)部分氨气通入碳化塔的目的是为了除去二氧化碳,同时得到副产品碳酸氢钱,其生成碳酸氢鞍反应的化学方程式为.4•为了将混有硫酸钾、氯化钙、碳酸氢鞍(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钾提纯,\n并制得纯净的氯化钾溶液,某同学设计的实验流程如下CaClzKC1K2SO4NH4HCO3厂亠残留物加足量水加过童*|BaCl^|>S加过童KzCOjvS^@f固体纯净的KC!溶港请根据以上流程图中的信息•回答下列问题:(1)步骤①中除去碳酸氢鞍的方法是_(2)步骤④中加过量碳酸钾溶液的目的是(3)此设计方案是否严谨?并说明理由5•氢能源是理想能源,氢能源开发一直是前沿科学研究的课题之一•科学家研发出一种以铝镣合金(隊Ga)和水为原料制取氢气的新工艺,流程如图1所示.图1铝旅合金和水为原科制取氛气漩程图图2諒的原子结构示意图(1)从物质分类的角度看,铝镣合金属于(填“纯净物"或为昆合物")—,用该合金与铝片相互刻划,发现铝片上有划痕,说明・(2)氢气是一种能源,它在空气中燃烧的化学方程式是,氢气被称为“绿色能源"的主要原因是・(3)反应①中镣的作用是_,该反应的化学方程式是_,属于四种基本反应类型中的•与电解水制取氢气相比,用铝镣合金和水为原料制取氢气的优点是(答出一点即可)・+3价,请写出镣与稀盐酸反应的化(4)图2所示是镣的原子结构示意图,据此可知镣元素在化合物中呈现学方程式—・CuO和ZnO,其余成分既不与酸反6•某科研小组设计利用稀H2SO4浸取某废弃的氧化铜锌矿(主要成分为\n应,也不溶解于水)的方案,实现废物综合利用。部分实验流程如下:过重稀硫酸过量铁粉双氯水氢水氢化钢鋅矿—.活性ZnO请根据上述实验流程回答下列问题:(1)操作1的名称是0(2)在氧化铜锌矿中加入过量稀硫酸,主要成分发生反应的化学方程式为,o(3)加过量铁粉后,发生反应的基本反应类型是,得到滤渣1的成分为(填化学式)。(4)在实验过程中,双氧水会与Fe2+反应生成Fe3+和水,以便在后续的操作中将溶液中铁元素除去。高镒酸钾溶液也能将Fe2+氧化成Fe3+,选用双氧水的优点是。7•为了除去铜粉中混有的铁粉,并用提纯的铜粉制取胆矶(CuSO4?5H2O)•某课外活动小组的同学按如下流程进行实验.(反应中部分生成物已略去)\n途径II:稀H1S04,并通入6、△已知:Cu+2H2SO4(浓)△-C11SO4+SO2f+2H2O回答下列有关问题:(1)操作a的名称是;除去铜粉中的铁粉,最简便的实验方法是・(2)FeCI2溶液中通入Cb发生化合反应,写出该反应的化学方程式•⑶由Cu制CuSCU溶液的途径II中,若不通入02,反应将不会发生,原因是•途径II与途径I相比较,其显著的优点是(回答一点即可).(1)FeCI3溶液可腐蚀铜以制作印刷线路板,反应只生成两种常见的盐,则该反应的化学方程式为•8•我市著名的纸面石膏板企业,用热电厂燃烧煤产生的炉渣来生产石膏板•原理是:发电过程中产生的烟气中含有大量的S02,热电厂用“碱-石灰-石膏(CaSO4?2H2O)“的方法使烟气脱硫从而生成石膏・烧祕溶港一—怒熟石灰氧气I操作a1150:—►口則“莒—Na^SO;—制粧釜_►CaSO?—►氢化塔—CaSO<•2H;O(1)工业烟气没经处理直接排放到空气中易形成,会污染、破坏环境;(2)写出吸收塔内发生反应的化学方程式;工业上用分离液态空气法制氧气,是利用空气中各成分的不同进行分离的;(3)化学反应类型有不同的分法,其中反应前后,有元素化合价变化的化学反应是氧化还原反应•有元素化合价升高的反应物是还原剂,有元素化合价降低的反应物是氧化剂•化学反应前后元素化合价没有变化的化学反应是非氧化还原反应•则下列说法正确的是A、吸收塔、制碱釜中发生反应属于氧化还原反应B、制碱釜中的反应物Na2SO3作氧化剂\nC、氧化塔中发生的反应属于氧化还原反应D、氧化塔中的反应物CaSOs作还原剂(1)生产流程中生成的_可循环利用,节约成本・9•氢氧化镁是一种重要的化工原料,某矿石由MgO、FezOs、CuO和SQ2组成,用它制备氢氧化镁的流程(1)请写出步骤一中发生反应的化学方程式:75意图如图:(任写一个)(2)溶液A中所含的阳离子有(填离子符号)(3)已知:部分金属阳离子以氢氧化物形成沉淀吋溶液的pH见表沉淀物Fe(OH)3Cu(OH)2Mg(OH)2\n开始沉淀1.94.29.1完全沉淀3.26.711.1步骤二中加入熟石灰,调节溶液的pH范围为(4)3个步骤中均用到的操作是(5)步骤三中生成产品的化学方程式为。10.实验室利用反应所得CuSO,稀H2SO4混合液制备CuSO4?5H2O,其主要流程如下:混合液—除較f操作Af標作B(1)试剂X应选用(选填序号).a.Cub.CuOc.Fe写出混合液中加入过量X后发生的反应方程式.(2)操作A中,所用玻璃仪器有、玻璃棒、烧杯.(3)操作B为蒸发浓缩、、过滤.(4)操作C为洗涤、低温干燥,其中洗涤剂不可选用(选填序号).a.热水b.冰水c.饱和CuSO4溶液."•人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属•硅钢可用于制造变压器的铁芯,某化学兴趣小组的同学为了验证硅钢(主要含有Fe、C、Si),设计了如图的实验流程(有些反应的部分反应物和生成物已省略).查阅资料发现:常温下,单质硅(Si)不能与盐酸反应,但能与氢氧化钠溶液反应(Si+2NaOH+H20=\nNa2SiO3+2H2f).根据以上信息,回答下列问题:(1)固体A的成分为,E的化学式为;(2)滤液B中的金属阳离子为;(3)在过滤操作时,若发现滤液浑浊,应;(4)步骤⑤中发生的是化合反应,尝试写出其化学方程式.12•侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:\n(1)上述流程中,用到的原料有空气、焦炭、水、、饱和的氯钠溶等(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则⑤的反应条件是(3)上述流程中,可循环利用的物质是二氧化碳和(4)上述流程中,“一种氮I巴"中阴离子的符号是13•柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:过犁粉血g柠朋稀硫鹼f反应1操作1fFeSO禱液一>反应2—►过溢fFe€O2f反应3柠樓酸亚铁(1)写出反应1的化学方程式,该反应是否属于复分解反应(填“是’或’否’);(2)操作1的名称为;(3)写出反应2的化学方程式;(4)反应3中会有气体生成,该气体是;(5)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为,铁元素化合价为14•保险粉(化学式为Na2S2O4)在工农业生产中有广泛的用途,NazSzCU在碱性溶液中稳定,在中性和酸性溶液中极不稳定,在NaCI存在下,NazSzCU在水中溶解度显著下降•制备流程如图:\nZnSO:NaOHNaG少噫门OH⑴反应I的原理为:Zn+2SO2=ZnS2O4,该反应类型为.(2)反应II为复分解反应,该反应的化学方程式为.⑶操作a的名称为.(4)滤液中含有Na2S2O4,为使Na29Ck结品析出还需要加入少量NaOH的原因是,加入NaCI的原因是.(5)198gZn(OH)2理论上能得到Zn的质量为g.15•粗盐中MgCb、CaCh等杂质,提纯粗盐的工艺流程如图所示。\n相盐水(MgChCaCb)过重的氢氧过重的碳化钠诸溝酸钠濬液Ok回答下列问题:(1)氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要用大量的水冲洗,再涂上(2)步骤②加入过量的碳酸钠溶液的作用是;(3)操作a的名称是;(4)步骤④中,要用玻璃棒不断搅拌,其目的是o代・高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌。(1)反应①的化学方程式为—0(2)反应②的基本反应类型是o(3)反应②后进行的分离操作名称是,若得到的NH4CI溶液有浑浊,原因可能是(写出一种即可)。(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为、。17•工业上合成NH3的工艺流程可简化为:\n(1)工业上制取N2时所用的廉价、易得的原料是;高温CO+H2,CO+H2OCO2+H2⑵用焦炭和水蒸气制取氢气的反应过程为:C+H20其中发生还原反应的物质是;(2)在高温、高压、催化剂存在的条件下,生成NH3的化学方程式为(3)将降温分离出的N2、H2送回合成塔的目的是;A.充分利用原料B.防止氮气污染空气.18•天然水净化为自来水的主要流程如下:天然水•(1)下列说法不正确的是(填字母)\nA.过滤池可以除去难溶性杂质B.活性炭吸附池可以除去水中的色素和臭味C.清水池中一定是软水(1)明矶[KAI(SO4)m?12H2O]能作絮凝剂,是因为明矶溶于水后生成具有吸附作用的胶状物氢氧化铝.m=,氢氧化铝的化学式为(2)目前不少自来水用液氯(CI2)作为消毒剂,液氯注入水后发生反应的示意图:ABCD其中0”•司原子,用D为次氯酸(HCIO),有杀菌消毒作用(DC物质的水溶液能使紫色的石蕊溶液变成色,取c物质的水溶液少许,向其中加入稀硝酸和硝酸银溶液,观察到有白色沉淀产生,发生反应的化学方程式是,利用此法可检验自来水中是否含有CI②液氯与水反应的化学方程式是——・(4)天然水中微生物使有机物(以CeHwOs表示)转化为CO2和H2中所需。2的量叫做生化需氧量(BOD,单位为mg?L-1b反应的化学方程式九C6H40O5+6O2■6CO2+5H20,测得20°C时1L某天然水样中含有机物(C6H20O5)的质量为10.8mg,则该水样的BOD值是多少?(写岀计算过程)19•工业烟气脱硫就是将烟气中含有的二氧化硫除去•一种采用“砂法"脱硫的工业流程示意图如图:除去S6后的烟气•几肚至含SO:烟气O1>氧化至CaSO-(1)吸收塔中,用NaOH溶液吸收SO2,生成和HzO.NaOH溶液喷成雾状能充分吸收SO2的原因是(2)沉淀室中,发生反应的化学方程式为——.\n(1)氧化室中,化学反应的基本类型是反应.(2)上述流程中,可以循环利用的物质是,有利于节约成本・20•白铜(Cu、Ni合金)因为光泽好、耐腐蚀、容易加工等优点,常代替银做饰品。如图所示是某实验室分离废弃白铜饰品成分的流程(部分反应产物在图中己略去)。L固体A固体C白铜隔加強适量祥粉II己知溶液B中含有一种二价金属化合物,溶液D中只有一种溶质。分析该流程,回答下列问题:(1)过程II中的实验操作名称是—,其中用到的玻璃仪器除了玻璃棒、烧杯外,还有(2)固体A的化学式为,溶液B中含有的溶质是。(3)过程II中反应的化学方程式为(任写一个)。证明溶液B中稀硫酸过量的现象是\n(1)Cu、Ni、Zn的金属活动性由强到弱的顺序是_(含有AI2O3和SiO2,不考虑其它杂质)制取金属铝21.铝和铝合金是一类重要的金属材料,工业上用铝土矿的基本流程如图:已知:①SiO2是一种难溶于水,也不与盐酸、硫酸反应的物质②铝盐与氨水反应,生成氢氧化铝沉淀和鞍盐请回答下列问题:(1)AI2O3与稀硫酸反应的化学方程式为•(2)电解熔融的AbQ,除得到金属铝之外,还可得到的气体产物是(填化学式)•工业上电解熔融的AI2O3时,还加入了冰晶石(Na3AIF6)作熔剂,其作用是降低AI2O3的熔点,冰晶石在物质中的分类属于(填字母).A.氧化物B.酸C.碱D.盐.22.高氯酸钠晶体(NaCIO4?H2O)可用于制备高氯酸•粗盐除去泥沙等不溶性杂质后得到’精盐”(只含MgCb、CaCl2两种杂质),以’精盐”为原料制备高氯酸钠晶体的流程如下:【资料】高氯酸钠在较高温度下容易分解•\n精盐CXOH):溶液Na:CO3■过诫OO:(气体〉请回答下列问题:(1)滤液中溶质除NaCI外还含有.盐酸调节pH发生的化学反应方程式有.(2)CI02中氯元素的化合价是•⑶通入S02是为了除去NaCICU溶液中少量的NaCIO3,该反应的化学方程式为⑷“气流干燥”时温度应控制在75〜95°C之间,其原因是23•海水晒盐得到粗盐,剩余的母液称为苦卤,粗盐和苦卤用途广泛(1)利用苦卤制取镁,主要流程如图・古卤石灰乳-氢氧化镁iXffla氯化镁通电・IIIni镁步骤II中的试剂a是(写名称)•步骤I中反应的化学方程式是\n(1)为了除去粗盐溶液中的Ca2+>Mg2+、SO42+,可按照下列实验步骤进行・①加过量BaCh溶液②加过量NaOH溶液③加过量Na2CO3溶液④过滤⑤加入适量盐酸■其中步骤③加过量Na2CO3溶液的目的是涉骤⑤加入适量盐酸的目的是.(2)采用氨碱法生产纯碱,主要流程如图①在加压条件下,向饱和氨盐水不断通入二氧化碳反应的化学方程式是②从过滤后的滤液中可获得氨态氮肥,检验固态氨态氮肥的方法是24•有一工业过程:C12冼昼上^煌_别KQCh晶体洗涤干燥•以贝壳为原料制备CaCO:固体XH^Cl物质Ca(CIO3)2CaCI2KCIOsKCI溶解度/g209.074.57.334.2该过程得到KCIOs晶上述流程中加入了KCI粉末,KCI与(填化学式)发生了复分解反应得KCIOs晶体,体的原因是(3)写出向CaCI2溶液中通入两种气体生成CaCCh的化学方程式:.25•过氧化钙晶体(CaO2?8H2O)较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒CaO2流程如下:按要求回答下列问题:(1)请将电石与水反应的化学方程式补充完整:CaC2+2H2O-Ca(OH)2+t(2)有关物质常温下的溶解度如表:\n气体X水过氧化氢贝壳(含CqCO?90%左右)—►懒烧—>反应YCaOz■8H2O—>(1)气体X是CO2,其名称是;将过氧化钙晶体与溶液分离的方法是・(2)反应丫需控制温度在0〜5°C,可将反应容器放在中,该反应是化合反应,反应产物是CaO2?8H2O,请写出化学方程式•获得的过氧化钙晶体中常含有~_Ca(OH)2杂质,原因是⑶CaCh的相对分子両另,过氧化钙晶体(CaO2?8H2O)中H、O元素的质魚E为.(1)为测定制得的过氧化钙晶体中CaO2?8H20的质量分数,设计的实验如下:称取晶体样品50g,加热到2CaO+O2f+16H2OI,杂质不发生变化),测得生成氧气的质220°C充分反应(方程式为2CaO2?8H2O=^量为3.2g,请计算样品中CaO2?8H2O的质量分数(CaO2?8H20相对分子质量为216),写出必要的计算过程・\n26•钛和钛合金被认为是21世纪的重要金属材料,被广泛用于火箭、导弹、航天飞机、船舶等,如图为某化工企业生成钛流程示意图:钛酸亚铁(TrTiCh)焦炭HiCl:请回答下列问题:⑴钛酸亚铁(FeTO3)中钛元素的化合价为⑵②中化学方程式为2FeTiO3+6C+7CI2—定条件-2X+2TiCI4+6CO则X为(填化学式)。(1)③中CO和H2以化学计量数1:2恰好完全反应,写出该反应的化学反应方程式该反应的基本反应类型为0(2)③反应中用到了稀有气体氮气,其中氮气的作用是。27•实验室以MnO2为原料制备少量高纯MnCCh的流程如下:MnO:H:O亠SO:JNaHCO.■I反应I反应II操作f芝衣T卿T干煤高纯NtaCChIco:1Na:SOi和H:O已知:①反应I的化学方程式:MriO2+SO2=MnSO4;②MnCCh、Mn(OH)2均难溶于水,MnCCh在100°C时开始分解・(1)反应I属于基本反应类型中的反应.(2)流程中’操作”的名称为,所需要的主要玻璃仪器有.⑶反应II的化学方程式为•反应II需控制溶液的酸碱性,若碱性过强,MnCOs粗产品中将混有(填化学式).⑷验证MnCCh粗产品表面附着有Na2S04杂质:取样品少许,向其中加入水,搅拌、过滤,向滤液中加入适量的(填化学式)溶液,有白色沉淀产生•(3)为获得高纯MnCCh,需选择’低温”干燥的原因是•\n28•常温下,氯酸钾的溶解度较小,在工业上可通过如下转化制得KQ濬诫誉習里IN2CO溶港产遅,J|KC103固体(1)实验室用KCIOs制取氧气的化学方程式为・通电⑵反应I中,通电吋发生的反应方程式为NaCI+3X■■NaCIQ3+3H2则X的化学式为・(1)反应II的基本反应类型为・⑷该转化中可以循环利用的物质是(填名称).29•以下为制备纳米CaCOs的一种流程:\n优质石灰石(含少量SQJCO:xNHs纳米CdCO?co;S心固体(1)实验室中进行操作仁2吋,所用玻璃仪器有、玻璃棒和烧杯・(2)过程中的生成物可直接应用于流程的是_.⑶为了提高’转化”速率,可采取的措施有(选填序号).a、搅拌溶液b、适当增大通入气体的速率c、加热溶液至100°C(1)操作2所得固体用蒸憎水洗涤•检验固体已洗净的方法是・30•五氧化二帆(V2O5)是一种工业催化剂,如图是制取V2O5的工艺流程。(1)写出反应①的化学方程式O(2)操作a的名称是,实验室进行该操作所需的玻璃仪器有烧杯、玻璃棒和⑶反应②的反应类型是,物质X中一定含有的元素是o(1)写出副产物KCI的一种用途o31•工业上以纯碱和石灰石为原料制备烧碱的简要工艺流程如图所示,请回答:(1)石灰石、生石灰、熟石灰均能与下列(填字母)发生化学反应・A.水B.盐酸C.二氧化碳(2)步骤④发生反应的化学方程式是—.\n(1)某研究性学习小组的同学想检验上述工艺中的烧碱溶液里是否含有纯碱,甲同学选择了一种酸溶液,乙同学选择了一种碱溶液,丙同学也选择了一种溶液,该溶液中溶质与甲、乙同学所用溶液中溶质的物质类别不同,他们都能达到检验目的,你认为丙同学所选溶液中的溶质可能是(填一种物质的化学式).32•氯化亚铜(CuCI)T泛应用于冶金、电镀、医药等行业。已知CuCI难溶于水和乙醇,在潮湿空气中易变质。CuCI的制备流程如下:址NaClNa^SOaCuSCU—»⑴’滤夜T中除了Na+、SO42外’还存在较多的禺子是、(写禺子符号)⑵“反应"中发生的化学变化是2CuCI2+Na2SO3=2CuCI|+2NaCI+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为——O\n(1)'操作a”的名称是o本流程中可以循环利用的物质(水除外)—。(写化学式)(2)可用的原因是,,醇洗”的目的是o(3)160gCuSCU与足量NaCI经上述制备流程,可生成的CuCh最多是g。33•某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiCh)可用于制备七水合硫酸亚铁晶体(FeSO4?7H2O),其工艺流程如下:fFeSCu溶港fFeSOi-7H;0S1O2查阅资料:Si02不溶于水,也不与稀硫酸反应。(1)'浸取”步骤中,FeO>FezOa和稀硫酸发生反应的化学方程式分别为FsO+H2SO4—FeSO4+H2O、(2)为提高(3)“还附①若试剂②若试剂34•硅酸钠(NazSiOa)是我国优先发展的精细化学品,Na2SO4、NazCOs)制备硅酸钠(NazSiOs)的流程如下:盐酸NzOH濬液石英砂矿石水研匿Na;S1O3晶体O'浸取”步骤的反应速率,可采取的具体措施有(写2条,不考虑’搠半”和“使用催化剂”)。步骤的目的是将Fe3+转化为Fe2+,试剂X可用SO2或Fe。X是S02,转化原理为SO2+Fe2(SO4)s+2Y=2FeSO4+2H2SO4,贝U丫的化学式是。X是Fe,转化原理为Fe+Fe2(SO4)3=3FeSO4测得“还原”后溶液的pH明显增大,其原因是。用某种石英砂矿石(主要成分是Si02,还含有少量的CuO、浸出港A浸出淞\n资料:Si02既不溶于水,也不与盐酸反应•请回答下列问题:(1)細磨”的目的是.⑵检验枕条a”已洗净的方法是.⑶W*的化学方程式为.⑷W*的化学方程式为.⑸’操作a”包含蒸发浓缩、、过滤、洗涤、干燥等一系列操作35•目前,农业上使用最多的氮肥主要有尿素、硝酸钱和碳酸氢鞍等,其中硝酸鞍的生产原理是利用氨催化氧化得到的硝酸,再跟氨反应生产硝酸鞍,基本流程如下:\n已知:①上述流程图中A、B、C均为气体,其中A、B为单质且A的相对分子质量为28,C为含有A组成元素的化合物;氨与氧气反应的条件是高温、催化剂②在化学反应中,只要有物质所含元素的化合价发生了变化的反应就是氧化还原反应•例如:2Na+2H20=2Na0H+H2f,反应前后,Na元素、H元素的化合价分别发生了变化,该反应是氧化还原反应请回答下列问题:(1)写岀A、C两种物质的化学式:A为;C_.(2)NH3和02反应的化学方程式为(3)上述流程图的5个反应中有个属于氧化还原反应.36•我国每年报废的手机超过1亿部•废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体•化学兴趣小组为回收其中的铜,设计并进行了如下实验:电路板粉末703稀硫酸过滤步理①yCD过里铁粉j泯渣步張②步骡③过重稀硫酸过庭步靠④fCu已知:Cu+H2O2+H2SO4—CuSO4+2H2O;不考虑金、银发生类似反应(1)将电路板粉碎成粉末的目的是.(2)步骤①所得滤液中的溶质除硫酸外,还有.(3)步骤②中的实验现象是:固体部分溶解,.(4)步骤④中反应的化学方程式是.37•工业上利用生产钛白的副产品硫酸亚铁制备还原铁粉的流程如图过量2♦(NH4)2CO3Ic►|转化|~►|过:虑|—►[洗涤|~~►干燥|~~焙烧—还原铁粉\n滤液(1)'转化"吋在溶液中生成了FeCOs沉淀,从四种基本反应类型来看,该反应的类型是;“过滤”后得到的滤液中的溶质有和(填化学式)⑵“干燥”过程中有少量的FeCCh转化为FeOOH和C02,此时与FeCOs反应的物质有(填化学式);FeCOs和FeOOH在空气中焙烧转化为FezOs,写出FezQ在高温条件下与C反应生成Fe和CO2的化学方程式.(1)制得的还原铁粉中含有Fe和少量FexC.为确定FexC的化学式,进行了如下实验:①取14.06g还原铁粉在氧气流中充分加热,得到0.22gCO2;②另取相同质量的还原铁粉与足量稀硫酸充分反应(FexC与稀硫酸不反应),得到0.48gH2.FexC的化学式是.38•钛和钛合金被认为是21世纪的重要金属材料,他们具有很多优良的性能,如熔点高,密度小,可塑性好等•以钛铁矿(主要成分为FeTiOs,同时含有少量的Fe2O3、FeO等)为原料制TiO2,再由TiO2制金属Ti的工艺流程如下:\nMgCbC【查阅资料】钛、镁在高温下与空气中的氧气、二氧化碳等反应(1)写出工艺流程中生成硫酸铁的化学方程式,该反应的基本类型是—反应.(2)操作2的名称是.(3)工艺流程中,水解属于变化.(4)工业上常在高温和氮气氛围中,用金属镁和TiCh反应的方法制备Ti,氮气的作用是r(5)TiO2可与焦炭、氯气在高温下反应,该反应中氯气和碳的质量按71:12的比例参加反应,反应的化学方程式为.39•醋酸钙[Ca(Ac)2]是国家允许使用的补钙制剂之一•以蛋壳为原料回收膜并制备醋酸钙的一种工艺流程如图.盐匪酯釀(HAc)co;、滤液(1)写出锻烧吋的化学方程式.C02的任意排放会引发的环境问题是.C02与CH4—定条件下化合可生成甲醛(HCHO),则此反应中C02与CH4的】佳质量比是•下列做法能减少二氧化碳排放的是序号)a.焚烧秸杆b.发展火力发电c.发展太阳能(1)在反应I中制备石灰乳,而不是制备澄清石灰水的目的是•写出熟石灰的一种用途\n(1)在反应II中醋酸过量的目的是—•写出反应II的化学方程式—.(2)膜分离时,盐酸不能过量的主要原因是_.40•小明取酸性锌镒干电池进行探究,他发现电池内部结构如图1所示.操作I】-黒色糊状埴充物!■«黑色糊状操作】埴充物姿发浓维、冷却熱饱和落液MnO2【查阅资料】(1)锌皮为金属锌(含有少量的铁)⑵黑色糊状填充物由炭黑、MnO2、ZnC12和NHQI等组成\n(3)有关数据见下表温度/C020406080100溶解度/gNH4CI29.337.245.855.365.677.3ZnCb343395452488541614【实验探究一】小明取适量黑色糊状填充物,按如图2所示实验流程进行探究・(1)溶液A中溶质主要有(填化学式),操作II中采用冷却热饱和溶液的方法实现两者分离的依据是.(2)欲从固体M中得到较纯的MnO2,操作III可采用的简便方法是.【实验探究二】小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验(1)取一块锌皮放入盛有适量稀盐酸的烧杯中,可观察到的现象是;该反应属于基本反应类型中的_反应.⑵另取一块锌皮放入盛有一定量CuS04溶液的烧杯中,充分反应后得到溶液E和固体F.当溶液E中只含一种溶质时,该溶质是(填化学式);当固体F中只含一种物质时,溶液E中最少含有种溶质.41•高纯硅可用于制备硅半导体材料•制备高纯硅的主要生产流程如图所示•Tj-.'B信息:石英砂的主要成分是SiO2,反应①化学方程式SQ2+2G冋诬Si+2C0f石英砂反应①II⑴石英砂属于(填“纯净物"或’混合物)SiCl4中硅元素的化合价为;写出合理处理中间产物co的一种方法.(1)反应③反应除生成高纯硅外,同时还生成一种化合物•请写出此过程的化学方程式;(2)反应③如果H2中混入02,从安全角度考虑,可能引起的后果是•(3)若杂质不参加反应,利用反应①生产含硅质量分数为90%的粗硅2.8吨,计算至少需要焦炭多少吨?\n42•工业上用硫铁矿’烧查”(主要成分是FesO4,Fe20s,还有一定量的Si02)、煤粉作原料制备FeCOs的主要流程如下:\n(1)焙烧炉中发生的主要反应为:\n44•二氧化镒因在工业生产中应用广泛而备受关注,制备二氧化镒是一项有意义的工作,某研究性小组对此展开了系列研究.I•用高镒酸钾制备资料一:(1)3K2MnO4+2H2SO4—2KMnCU+MnO21+2K2SO4+H20(2)K2MnO4易溶于水实验室加热高猛酸钾制氧气,反应的化学方程式为•其反应类型是•将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2,用稀硫酸而不用水浸取丽因是•II•用硫酸镒制备:电解MnSCU溶液可制得活性MnO2,同时生成氢气和硫酸,该反应的化学方程式为,一段时间后溶液的pH将(填“变大”、’变小”或环变”)III•用废锂电池制备资料二:2AI+2NaOH+2H2O—2NaAIO2+3H2f用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂资源回收,流程如下:请回答下列问题:>纳米\lnCh(1)R虑夜"中溶质的主要成分是(填化学式).⑵在实验室进行“过滤"操作时,需要的玻璃仪器有烧杯、漏斗和(3)MnO2与碳粉经下列三步反应制得纳米MnO2:①2MnO2+C2MnO+CO2\n②MnO+H2SO4=MnSO4+H2O③3MnSO4+2KMnO4+2H2O—5MnO2J+K2SO4+2H2SO4上述涉及元素化合价变化的反应有(填序号).IV.用碳酸镒制备控制一定的温度,焙烧MnCCh制取MnO2的装置如下:石英琶MnCO,02004006008001000Tt(1)实验中观察到澄清石灰水变浑浊,写出石英管中发生反应的化学方程式・(2)MnC03在空气中加热易转化为猛的不同氧化物,其残留固体质量随温度的变化亦丽示固体成分的化学式为(请写出计算过程)•图中B点对应\n45•某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程见如图:资料仁垃圾焚烧产生的烟气中含有S02等有害气体•资料2:FeSCU容易被空气中的02氧化.回答下列问题:(1)石灰浆吸收S02(性质与C02相似)的化学反应方程式为.⑵溶解步骤中同时发生的三个化学反应方程式为:Fe+Fe2(SCU)3—3FeSO4、(2)将所得FeS04溶液在氮气环境中蒸发浓缩、、过滤,得到FeS04晶体,其中氮气的作用是_(3)政府倡导垃圾分类,其好处是(写一点):.46•治理污染、保护环境,事关人民群众的身体健康和社会的可持续发展(1)下列环境问题与燃煤有直接关系的是(填字母序号).a.酸雨b.温室效应c.可吸入颗粒物增加(2)烟气脱硫是目前控制燃煤污染的重要途径•如钠碱循环法是利用亚硫酸钠(Na2SO3)溶液脱除烟气中的S02,生成亚硫酸氢钠(NaHSOs),反应的化学方程式为.(3)烟道气中含有大量C02,经’捕捉”可用于生产尿素、甲醇等产晶•①尿素[CO(NH2)2]属于化学肥料中的肥.②生产甲醇(CHsOH).“捕捉”Q3在高压时将烟道气中的C02溶解于甲醇,得到C02的甲醇溶液.所得溶液中溶质是.该反应的化学方程式为用’捕捉”C0生产甲醇,反应的微观示意图如下:\n°氢原子•碳博子•氧原子③还可以利用NaOH溶液来’捕捉’CQ并将CO?储存或利用,流程如下:的气体’下列有关该过程的叙述正确的有a.该过程可实现C02零排放\nb.该过程中至少有2种物质可以循环利用C.反应分离室中分离物质的操作是蒸发、Bd.该过程中至少发生了4个化学反应.某校研究性学习小组的同学为了除瓏47•实验室中有一包KCI、MgS04和CaCI2组成的固体混合物,的MgS04和CaCI2,得到纯的KCI,设计如下实验方案HONaClNazSOsC11SO4.外,还存在较多的离子是(写离子符号)⑵反应冲发生的化学变化是酸,该反应的化学方程式为2CuCI2+Na2SO3=2CuCII+2NaCI+SO3,产生的S03迅速与水化合生成一种请你回答下列題(1)X溶液与Ba(OH)2溶液反应的化学方程式是,该反应的基本反应裂(2)Y溶液中溶质的化学式是.(3)该实验中盐酸的作用是.48•氯化輕uCI)广泛应用于冶金、电镀、医药等行业錨CuCI难溶于水和乙醇,在潮湿空气中菱质。CuCI的制备流程如下:\n(1)W1”中除了Na+、SO42⑶操作a”的名称是■^本流程中可以循环利用的物质(水除外)是「^写化学式)⑷可用W”的原因是一―醇洗啲目的是-—⑸160gCuSO4与足量NaCl经上述制备流程,可生成的CuCh最多是——g。49•氯化顿是一种可溶性重金属盐,广泛应用于化工领域,用毒重石(主要成分为BaCOa)制备氯化顿晶体工艺流程如下:(1)毒重石要进行粉碎的目的是,增大反应的接触面积,加快反应的进行…气体X的化学式为(2)操作丫的名称是——,滤液2中可循环利用的物质除水外还有氯化顿;洗涤氯化顿晶体最适宜的洗涤剤—填字母);A.30°C水B.30°C饱和氯化錮液C.30°C饱和氯化顿溶液(3)滤渣水洗的目的是50•控制化学反应的条件可以促进或抑制化学反应,更好使化学反应为人类造福(1)如图是科学家正在研究的二氧化碳循环利用技术:分离、浓缩①二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物,写出反应的化学方程式,甲醇中碳元素的化合价为.②从图中分析得出的下列结论中,正确的是(填序号)A.该技术符合低碳经济的理念•B.水生成氢气的过程中所用的催化剂一定是二氧化猛\nA.该技术有助于缓解全球面临的能源危机•B.液化石油气、汽油、甲醇均有碳、氢、氧三种元素组成(2)汽油燃烧时氧气浓度越大,燃烧越剧烈,试从微观角度解释这是因为_•(3)尿素[CO(NH2)2]对提高粮食产量具有重要的作用•人们控制条件可以使CO2和物质M发生反应:CO2+2M=CO(NH2)2+H2O,物质M的化学式为.(4)向滴有紫色石蕊试液的蒸憾水中通入CO2气体,液体变为红色,是CO2气体使它变成红色吗?,原因是(写出化学方程式):_;再把上述液体加热,发现液体最终呈现紫色,用化学方程式写出原因:_.(5)检验CO2气体常用澄清石灰水,反应的化学方程式为•