- 959.61 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题二 物质构成的奥妙
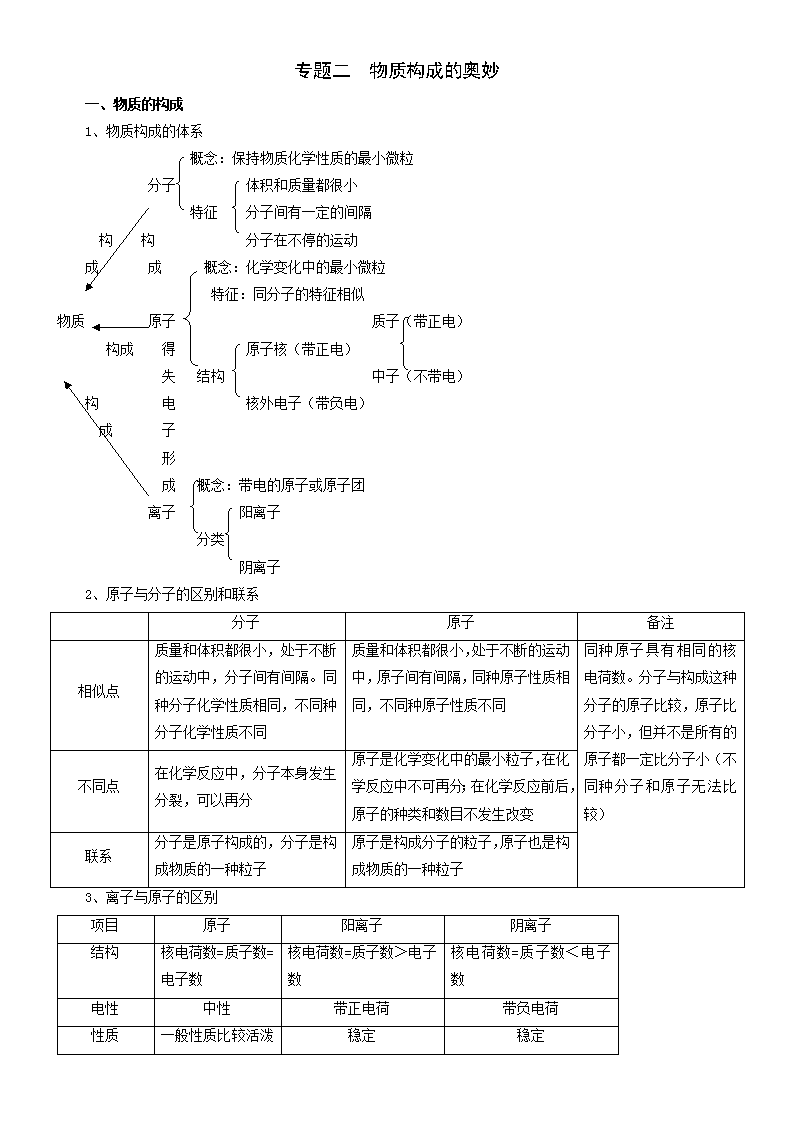
一、物质的构成
1、物质构成的体系
概念:保持物质化学性质的最小微粒
分子 体积和质量都很小
特征 分子间有一定的间隔
构 构 分子在不停的运动
成 成 概念:化学变化中的最小微粒
特征:同分子的特征相似
物质 原子 质子(带正电)
构成 得 原子核(带正电)
失 结构 中子(不带电)
构 电 核外电子(带负电)
成 子
形
成 概念:带电的原子或原子团
离子 阳离子
分类
阴离子
2、原子与分子的区别和联系
分子
原子
备注
相似点
质量和体积都很小,处于不断的运动中,分子间有间隔。同种分子化学性质相同,不同种分子化学性质不同
质量和体积都很小,处于不断的运动中,原子间有间隔,同种原子性质相同,不同种原子性质不同
同种原子具有相同的核电荷数。分子与构成这种分子的原子比较,原子比分子小,但并不是所有的原子都一定比分子小(不同种分子和原子无法比较)
不同点
在化学反应中,分子本身发生分裂,可以再分
原子是化学变化中的最小粒子,在化学反应中不可再分;在化学反应前后,原子的种类和数目不发生改变
联系
分子是原子构成的,分子是构成物质的一种粒子
原子是构成分子的粒子,原子也是构成物质的一种粒子
3、离子与原子的区别
项目
原子
阳离子
阴离子
结构
核电荷数=质子数=电子数
核电荷数=质子数>电子数
核电荷数=质子数<电子数
电性
中性
带正电荷
带负电荷
性质
一般性质比较活泼
稳定
稳定
(除稀有气体原子外)
符号(举例)
H、O、Al
H+ Al3+
O2- Cl-
【例1】(2008·盐城)下列对分子、原子、离子的认识,正确的是( )
A、分子是保持物质的最小粒子 B、原子是最小的粒子,不可再分
C、原子得到或失去电子后形成离子
D、CO2和CO性质的差异主要是由于分子间的间隔不同
【答案】C
【解析】分子是保持物质化学性质的最小粒子,不能保持物质的物理性质,故A错。原子是化学变化中最小的粒,它由原子核和电子构成,所以B错。原子得到电子带负电,失去电子带正电,形成离子,所以C正确。CO2和CO性质的差异是因为分子结构不同,所以D错。
【规律小结】分子、原子和离子都可以直接构成物质,分子有原子构成,原子得失电子形成离子,不同种分子,性质不同
变式训练一
1、(2009·晋江)夏日的校园,百花盛开,阵阵花香,沁人心脾。花香四溢的现象说明( )
A.分子是不断运动的 B.分子是由原子构成的
2
8
+11
C.分子具有一定的质量 D.分子之间有一定的间隔
2、(2009·泰州)结构示意图 表示的微粒是( )
A.原子 B.分子 C.阳离子 D.阴离子
3、(2009·潍坊)下表呈现的是部分元素的原子结构示意图、主要化合价等信息。
下列叙述错误的是( )
A.铝原子结构示意图的最外层有3个电子
B.元素的正化合价数一定等于原子的最外层电子数
C.核电荷数分别为8和14的元素,组成化合物的化学式为SiO2
D.同一周期中,原子的核外电子层数相同,最外层电子数从左向右逐渐增多
二、物质的组成
1、元素的概念
元素是指具有相同核电荷数(即质子数)的同一类原子的总称。例如:氯
O +1 +3 +5 +7
元素包括C1-、Cl、Cl、C1、Cl、Cl…不同形式的粒子和Cl一35、Cl一37(指相对原子质量分别为35和37的两种氯原子)等粒子,因为它们的核电荷数均为17。
2、理解元素的概念应把握“同质子,类原子”六个字。
(1)“同质子”即指元素的种类是由核电荷数(即核内质子数)决定的,与原子中的中子数、电子数无关。同种元素原子的质子数一定相同,不同种元素的原子的质子数一定不相同。
(2)“类原子”是指一种元素可能不止一种原子。它包括质子数相同、中子数不同的原子(如:氢元素有三种原子:氕、氘、氚,它们的质子数相同,但中子数不同);也包括质子数相同,而电子数不同的原子和离子(如:铁原子通常有三种存在形式即Fe、Fe2+、Fe3+,它们都属于铁元素)。
3、理解元素概念时的注意事项
(1)元素是以核电荷数(即质子数)为标准对原子分类。只论种类,不讲个数。
(2)质子数是划分元素种类的标准。质子数相同的原子和单核离子都属同一种元素。如Na+与Na都属钠元素,但Na+与NH4+不属于同一种元素。
(3)同种元素可以有不同的存在状态。如单质中和化合物中。
(4)同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
(5)自然界中目前已知的元素有112种,可分为金属元素、非金属元素、稀有气体元素。
4、元素与原子的比较
元素
原子
区别
是宏观概念,只表示种类不表示个数
是微观概念,既分种类,又表示个数
适用
范围
表示物质的宏观组成。
常用来表示物质由哪几种元素组成
表示物质的微观构成。
常用来表示物质的分子由哪些及几个原子构成
联系
只要核电荷数相同的一类原子就是同一种元素,原子是元素的最小单位,而元素是原子的一个归类“集体”。
【例2】(2009·福州)海水是重要的资源,每千克海水中约含有钠10.62 g、镁1.28 g、钙0.40 g等。这里的“钠、镁、钙”指的是( )
A.原子 B.分子 C.元素 D.单质
【答案】C
【解析】此题是元素概念在实际生活中的应用。生活中的物质成分比较复杂,我们通常所说的物质组成都是指物质的元素组成,是通过元素组成来说明其成分或比较其含量的。
【规律小结】物质是由分子、原子或离子构成,由元素组成。
变式训练二
1、(2009·东营)运用2008年诺贝尔化学奖的研究成果,可依据生物发光现象检测超微量钙的存在。这里的“钙”是指( )
A.分子 B.原子 C.元素 D.单质
2、(2009·南京)根据下表中相关信息,判断出的元素名称不一定合理的
3、(2008·苏州)由种类相同的元素组成的一组物质是( )
A、冰和干冰 B、银和水银 C、烧碱和纯碱 D、水和双氧水
三、物质的分类
混合物
金属
分类 单质 非金属
稀有气体
纯净物 氧化物
酸
无机化合物 碱
化合物 盐
有机化合物
1、纯净物和混合物
区别纯净物和混合物的关键点:是否由同一单质或化合物组成。
混合物的特点:①混合物是多种物质组成,各成分均是纯净物,这些纯净物彼此不发生
化学反应,仍能保持各自的化学性质;②混合物无固定的组成,纯净物构成混合物时没有一定的比例,所以通常不以其中某一成分名称命名,而且混合物的物理性质也不同定;③从微观角度看,混合物是由多种彼此间不反应的分子、原子或离子构成,而纯净物是由同种分子、原子或离子构成。
2、单质和化合物
单质
化合物
概念
由同一种元素组成的纯净物
由两种或两种以上的元素组成的纯净物
元素形态
元素处于游离态
元素处于化合态
性质
不能发生分解反应和复分解反应
大部分能发生分解反应和复分解反应
联系
值得注意的是:①组成单质的虽是同一种元素,但在单质分子中,有单原子分子(一个原子构成一个分子),如稀有气体;有双原子分子(两个原子构成一个分子),如氢气、氧气;有多原子分子,如白磷,臭氧(O4),巴基球(C60)等。
②同种元素可以形成不同种单质,如白磷和红磷、氧气和臭氧,它们互为同素异形体。同素异形体在一定条件下能互相转化,这种转化是化学变化,如石墨转化为金刚石。
3、氧化物和酸、碱、盐
(1)氧化物:由两种元素组成,其中一种是氧元素的化合物。通常氧化物可分为碱性氧化物(如Na2O)和酸性氧化物(如CO2)。但有一些氧化物不属于这两类氧化物如H2O、CO、NO等。碱性氧化物都是金属氧化物,大多数非金属氧化物是酸性氧化物,也有一些金属氧化物是酸性氧化物,如Mn2O7。
(2)酸:由氢和酸根组成,电离时生成的阳离子必须全部是氢离子(H+),阴离子则是酸根。酸按所含的酸根可分为无氧酸如HCl和含氧酸如H2SO4;按能电离出H+的多少可分为一元酸如HCl、二元酸如H2SO4、多元酸如H3PO4。
(3)碱:由金属离子(含NH+)和氢氧根离子构成化合物。
(4)盐:由金属离子(含NH+)和酸根离子构成。
【例3】(2009·东营)分类是学习和研究化学物质及其变化的一种常用的基本方法。现有药品硫酸铁,它与下列哪组属于同一类物质( )
A. 盐酸、硫酸 B. 氢氧化铝、氢氧化铜
C. 氯化镁、碳酸氢钠 D. 二氧化碳、四氧化三铁
【答案】C
【解析】硫酸铁属于盐,盐酸和硫酸属于酸,氢氧化铝和氢氧化铜属于碱,氯化镁和碳酸氢钠属于盐,二氧化碳和四氧化三铁属于氧化物,所以选C
【规律小结】化合物分为酸、碱、盐、氧化物,在判断物质的类别时,可以借助一些规律:酸中含有氢元素,碱中含有氢氧根,氧化物中含有氧元素。
变式训练三
1、(2009·临沂)在下列物质中,属于纯净物的是( )
A.矿泉水 B.空气 C.氯酸钾 D.氯化铜溶液
2、(2009·潍坊)目前,国家食品监督检验部门检出某“返青粽叶”包装的粽子中含有硫酸铜,若食用这样的粽子会有害健康。硫酸铜属于( )
A.有机物 B.混合物 C.金属单质 D.盐
3、(2009·南京)下列各图中“○”和“●”分别表示两种质子数不同的原子,其中能表示由两种化合物组成的混合物的图是( )
4、(2009·兰州)人们可以对物质从不同的角度进行分类。请根据示例将酒精、醋酸、水、食盐四种物质进行分类,并写出分类依据。
不同类的物质
分 类 依 据
示 例
食 盐
常温下食盐是固体,其余是液体
分类一
分类二
综合检测
一、选择题(每小题3分,共45分)
1、(2009·潍坊)榴莲被誉为“果中之王”。切开榴莲时可闻到特殊香味,这说明( )
A.分子在不断运动 B.分子质量很小
C.分子体积很小 D.分子间有间隔
2、(2009·烟台)下列对一些事实的解释不正确的是( )
事 实
解 释
A
物质的热胀冷缩
分子或原子间的间隔随温度的改变而改变。
B
一氧化碳有可燃性,而二氧化碳不具有可燃性
物质组成元素不同,分子结构也不同
C
0℃时水结成冰,而海水在-1.9℃才会结冰
海水中含有盐,是混合物,其凝固点比水低
D
盐酸和稀硫酸都能使紫色石蕊试液变红色
盐酸和稀硫酸中都含有大量的氢离子
3、(2009·苏州)用分子的相关知识解释下列生活中的现象,其中错误的是( )
A.热胀冷缩,说明分子的大小随温度升降而改娈
B.“酒香不怕巷子深”,说明分子在不停地运动
C.10mL酒精和10mL水混合后,体积小于20mL,说明分子间有空隙
D.湿衣服在夏天比冬天容易晾干,说明分子的运动速率随温度升高而加快
4、(2009·安徽)我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”。铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是( )
A.原子序数是58 B.相对原子质量是140.1
C.质子数为58 D.铈元素是非金属元素
5、(2009·福州)右图是钠元素的原子结构示意图,下列
有关钠原子的叙述不正确的是( )
A.质子数是11 B.最外层电子数为1
C.核外有3个电子层 D.核外电子总数为10
6、(2008·南京)宁宁在学习“化学元素与人体健康”后,查阅到如下资料,请你给下表的“ ”处选择恰当的选项
种类
主要食物来源
钙
奶类、绿色蔬菜、水产品、肉类、豆类
铁
肝脏、瘦肉、蛋、鱼、豆类、芹菜
锌
海产品、瘦肉、肝脏、奶类、豆类、小米
碘
海产品、加碘盐
A、元素 D、分子 C、原子 D、离子
7、(2009·青岛)下图是元素周期表中的一格,依据图中的信息得到的下列认识错误的是( )
14 Si
硅
28.09
A.该元素原子的质子数为14
B.该元素属于非金属元素
C.该元素一个原子的原子核外有14个电子
D.该元素的相对原子质量为28.09
8、(2009·苏州)参考下列物质的微观结构图示,其中由阴,阳离子构成的物质是( )
A.铜 B.干冰 C.氯化钠 D.金刚石
9、(2009·雅安)结构示意图 所表示的粒子是( )
A.原子 B.分子 C. 阴离子 D.阳离子
10、(2009·南京)原子序数为94的钚(Pu)是一种核原料,该元素一种原子的质子数和中子数之和为239,下列关于该原子的说法不正确的是( )
A.中子数为145 B.核外电子数为94
C.质子数为94 D.核电荷数为239
11、(2008·北京)决定元素种类的是( )
A、质子数 B、中子数 C、电子数 D、最外层电子数
12、(2009·重庆)下列物质中属于化合物的是( )
A.二氧化硫 B.空气 C.磷 D.碘盐
13、(2009·青岛)下列常见的物质中,属于纯净物的是( )
A.啤酒 B.食醋 C.加碘食盐 D.蒸馏水
14、(2009·黔东南州)分类学习是化学重要的学习思想,下列物质分类错误的一组是( )中.考.资.源.网
A. H2、O2、N2 B. HCl、H2SO4、NaHSO4学
C. NaOH、KOH、NH3·H2O D. NaCl、NaHCO3、NH4Cl
15、(2009·广州)下列各组各有两种物质,它们的化学式和所属的物质类别都正确的一组是( )
物质1
物质2
名称
化学式
物质类别
名称
化学式
物质类别
A
氮气
N
非金属单质
氧化亚铁
Fe2O2
碱
B
碳酸氢钠
NaHCO3
盐
硝酸
HNO3
酸
C
硫酸钾
K2SO4
盐
五氧化二磷
P2O5
金属氧化物
D
锰
Mm
金属单质
氢氧化镁
Mg(OH)2
碱
二、填空题
2
8
2
+12
16、(6分)(2009·重庆)(1)用数字和化学符号表示:2个氧原子 ,3个钠离子 。
(2)镁的原子结构示意图为 ,Mg原子在化学反应中容
易 (填“得到”或“失去”)2个电子。
17、(8分)(2009·苏州)形态各异的物质可按一定规律分类。现有以下八种物质,请选用各物质名称前的字母序号填涂在答题卡相应位置。
A.盐酸 B.氯化钾 C.氧化铜 D.淀粉
E.五氧化二磷 F.氮气 G.氢氧化钙 H.甲烷
题号
物质分类标准
字母序号
题号
物质分类标准
字母序号
(1)
金属氧化物
(5)
非金属单质
(2)
非金属氧化物
(6)
挥发性酸
(3)
易溶性盐
(7)
最简单的有机物
(4)
微溶性碱
(8)
糖类
18、(10分)(2008·西安)(1)向容积为250ml的细颈玻璃仪器(如下图所示)中加水至虚线处,再滴几滴红墨水,一段时间后,玻璃仪器中的现象是 ,说明 。
(2)继续向玻璃仪器中加酒精至凹液面最低处正好与刻线相切。塞紧玻璃塞,将玻璃仪器中液体倒转摇匀,重复2次。静置一段时间后,玻璃仪器中的现象为 ,说 明 。仪器细颈部分的作用是 。
19、(9分)(2009·眉山)化学是研究物质的结构、性质以及变化规律的科学,研究元素知识是学好化学的基础。下表包含部分元素的相关信息,完成以下填空:
(1)1869年,科学家 发现了元素周期律和元素周期表。
(2)请画出17号元素原子结构示意图 ,该元素在化学反应中比较容易 (填“得到”或“失去”)电子变成离子。
(3)上表中最活泼的金属元素与地壳中含量最多的元素组成的化合物是
(填化学式)。
20、(10分)(2008·江西)下图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图。
请你回答:
(1)氟元素的相对原子质量为 ,钙元素的原子序数为 ;
(2)X= ;
(3)A、B、C、D属于同种元素的粒子是 (填序号);
(4)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似 (填序号)。
三、信息题
21、(12分)1977年8月,国际化学会无机化学分会做出一项决议:从104号元素以后,不再以人名、国名来命名,一律以新元素的原子序数(即核电荷数)的拉丁文缩写来命名,即nil—0,un—1,bi—2,tri—3,quad—4,pent—5,hex— 6,sept—7,dct—8,enn—9,照此规定,第104号元素的拉丁文名称按“un—nil+quad+ium(词缀)”应为“unnilquadium”,其元素符号定为“Unq”,第105号元素的拉丁文名称为“Unnilpentium”,元素符号为“Unp”,依次类推,请分别给下列元素命名:
(1)109号元素拉丁文名称为_______,元素符号为______。
(2)111号元素拉丁文名称为_______,元素符号为______。
(3)116号元素拉丁文名称为_______,元素符号为______。
专题二 物质构成的奥妙
变式训练一
1、A 解析:花中含有带有香味的分子不停的运动,使人接触后感觉到花香。
2、C 解析:原子核内有11个质子,带11个单位的正电荷,核外有2+8=10个电子,带10个单位的负电荷,则该微粒带一个单位的正电荷,所以 选C
3、B 解析:P的化合价有+3和+5价,不一定等于原子的最外层电子数。
变式训练二
1、C 解析:物质的组成指的是元素
2、B 解析:粒子的种类有分子、原子、离子,钠离子有2个电子层,最外层有8个电子,化学性质不活泼。
3、D 解析:冰是固态的水,由氢元素和氧元素组成,干冰是指固态的二氧化碳,有氧元素和碳元素组成,两者所含元素种类不同,所以A错误;银是由银元素组成的金属单质,而水银指的是汞,由汞元素组成,所以B
也不正确;烧碱是指氢氧化钠,由钠、氢、氧、氢三种元素组成,纯碱指的是碳酸钠,由钠、碳、氧三种元素组成,故C错误;水是由氢、氧两种元素组成,而双氧水也是有由氢、氧两种元素组成,所以D正确。
变式训练三
1、C 解析:矿泉水中含有矿物质,空气中主要含有氮气和氧气,氯化铜溶液中有氯化铜和水。
2、D 解析:硫酸铜由金属离子(Cu2+)和硫酸根离子(SO42-)构成.
3、B 解析:A是由两种单质组成的,C中只有一种物质,D是由一种单质和一种化合物组成的。
4、
不同类的物质
分类依据
分类一
水
水是氧化物,其余不是氧化物
分类二
醋酸
醋酸是酸,其余的不是酸
(或其他合理答案)
综合检测
1、A 解析:由于分子不断的运动,才能被人接触闻到
2、B 解析:一氧化碳和二氧化碳都是由碳元素和氧元素组成。
3、A 解析:热胀冷缩是由于分子间的间隔变大引起的,分子的大小是不变的。
4、D 解析:金属元素的名称都有“钅”字旁,铈属于金属元素。
5、D 解析:从结构示意图中可知核外电子总数为2+8+1=11个。
6、A 解析:生活中的物质成分比较复杂,我们通常所说的物质组成都是指物质的元素组成,是通过元素组成来说明其成分或比较其含量的。
7、D 解析:相对原子质量是针对原子而言的,不能理解成元素的相对原子质量。
8、C 解析:铜和金刚石由原子构成,干冰由分子构成。
9、D 解析:原子核外由18个电子,核内由17个质子,所以其带一个单位的负电荷,属于阴离子。
10、D 解析:原子中原子序数=质子数=电子数=核电荷数。
11、A 解析:元素是指具有相同核电荷数(即质子数)的同一类原子的总称。可见一种元素与另一种元素的本质区别是核电荷数或质子数不同,即决定元素种类的是核电荷数或质子数。
12、A 解析:化合物是含有多种元素的纯净物,BD为混合物,C只含有磷元素。
13、D 解析:啤酒中含有二氧化碳和乙醇,食醋中含有乙酸和水,加碘食盐中含有碘和氯化钠。
14、B 解析:HCl和H2SO4属于酸,NaHSO4属于盐
15、B 解析:氮气的化学式为N2; 氧化亚铁的化学式为FeO,属于金属氧化物;P2O5属于非金属氧化物;锰的化学式为Mn。
16、(1)2O 3Na+ (2)失去
解析:镁原子的最外层电子数为2,小于4个,易失去电子形成稳定结构。
17、(1)C (2)E (3)B (4)G (5)F (6)A (7)H (8)D
18、(1)整瓶水变红;分子在不断运动
(2)液面低于刻线;分子间有间隔;便于观察液面变化
解析:分子是在不断运动的,当向水中滴几滴红墨水后,红墨水分子会运动的水分子中,是整瓶水变红;由于分子间有间隔,当两种不同的液体相互混合时,它们的分子相互渗透,彼此充满在分子间隔中,所以其体积会小于两者的体积之和,但这个差值不大,使用细颈仪器会便于观察。
19、(1)门捷列夫 (2) 得到 (3)Na2O(Na2O2)
20、(1)19.00;20 (2)8 (3) B C (4) B
解析:元素周期表中原子最下面部分为其相对原子质量,元素符合前面的数字为原子序数;D中的质子数为18,其原子中核外电子数为18,具有稳定结构,最外层电子数为8;决定元素种类的是核电荷数(即质子数),B和C的质子数都为17,所以为同种元素;元素的化学性质取决于最外层电子数,A的最外层电子数为7与B的最外层电子数相同,所以两种的化学性质相似。
21、(1)Unnilennium Une (2)Unununium Uuu (3)Ununhexium Uuh