- 3.38 MB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2012年广东省广州市初中毕业升学考试化学试题
一、选择题(40分)
1.空气是一种宝贵的自然资源,下列气体不可直接从空气分离获得的是( )
A.用作医疗急救的氧气 B.用作焊接保护气的稀有气体
C.用作食品防腐剂的氮气 D.用作清洁燃料的氢气
2.下列物质性质的描述中,属于化学性质的是( )
A.甲烷可以在空气中燃烧 B.金属汞常温下是液体
C.高锰酸钾是紫黑色固体 D.银具有良好的延展性
3.下列物质中属于氧化物的是( )
A.Ca(C1O3)2 B.Zn(OH)2 C.MnO2 D.O2
4.下列服装面料中属于有机合成材料的是( )
A.蚕丝 B.棉布 C.羊毛 D.涤纶
5.下列说法正确的是( )
A.铝是人类最早利用的金属材料
B.铜是目前世界年产量最高的金属
C.大多数金属元素在自然界中以单质形式存在
D.日常使用的金属材料大多数是合金
6.化石燃料是不可再生的能源,下列不属于化石燃料的是( )
A.煤 B.石油 C.乙醇 D.天然气
7.有一些物质,它们中的一些原子集团常作为一个整体参加反应,下列物质中含有原子集团的是( )
A.NaCl B.NaNO3 C.CaCl2 D.KCl
8.下列各种物质中,氯元素化合价最高的是( )
A.NaClO4 B.HCl C.NaClO D.ClO2
9.下列关于碳和碳的氧化物的说法正确的是( )
A.金刚石和石墨硬度都很大
B.二氧化碳和一氧化碳都能灭火
C.二氧化碳可作为大棚种植农作物的气体肥料
D.一氧化碳可使澄清石灰水变浑浊
10.下列处理事故的方法中不正确的是( )
A.电器着火,迅速切断电源
B.室内起火,迅速打开所有门窗通风
C.厨房煤气管道漏气,迅速关闭阀门并开窗通风
D.洒在实验桌上的少量酒精着火,迅速用湿布盖灭
11.下列物质不可作为钾肥施放于土壤中的是( )
A.氢氧化钾 B.硫酸钾 C.硝酸钾 D.草木灰
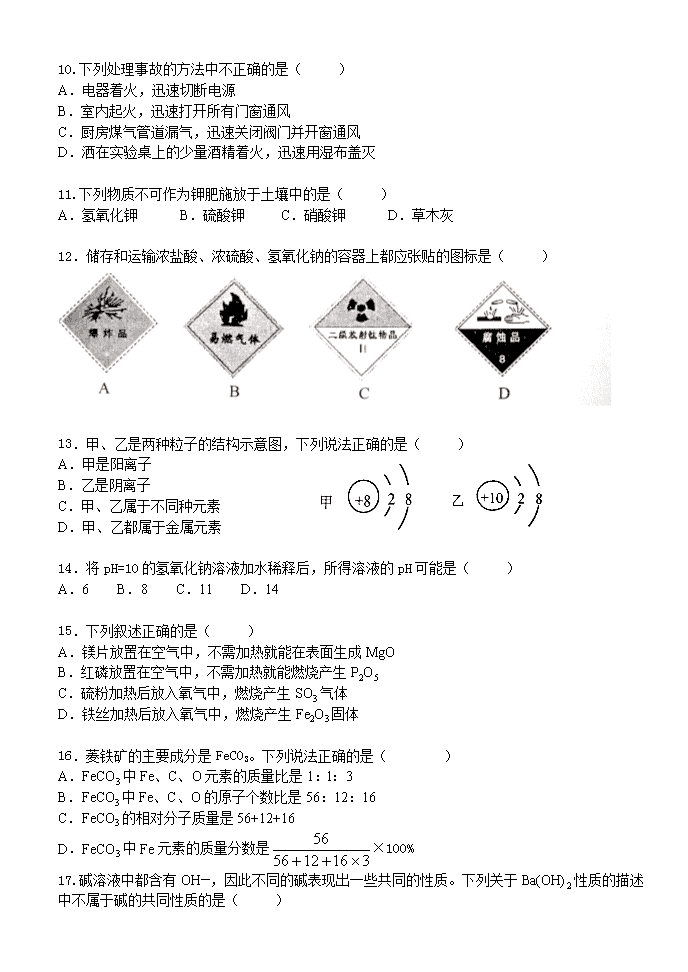
12.储存和运输浓盐酸、浓硫酸、氢氧化钠的容器上都应张贴的图标是( )
13.甲、乙是两种粒子的结构示意图,下列说法正确的是( )
A.甲是阳离子
B.乙是阴离子
C.甲、乙属于不同种元素
D.甲、乙都属于金属元素
14.将pH=10的氢氧化钠溶液加水稀释后,所得溶液的pH可能是( )
A.6 B.8 C.11 D.14
15.下列叙述正确的是( )
A.镁片放置在空气中,不需加热就能在表面生成MgO
B.红磷放置在空气中,不需加热就能燃烧产生P2O5
C.硫粉加热后放入氧气中,燃烧产生SO3气体
D.铁丝加热后放入氧气中,燃烧产生Fe2O3固体
16.菱铁矿的主要成分是FeCO3。下列说法正确的是( )
A.FeCO3中Fe、C、O元素的质量比是1:l:3
B.FeCO3中Fe、C、O的原子个数比是56:12:16
C.FeCO3的相对分子质量是56+12+16
D.FeCO3中Fe元素的质量分数是×100%
17.碱溶液中都含有OH—,因此不同的碱表现出一些共同的性质。下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )
A.能使紫色石蕊溶液变蓝色 B.能与盐酸反应生成水
C.能与Na2SO4溶液反应生成BaSO4沉淀 D.能与CO2反应生成水
18.区别下列各组物质的方法可行的是( )
A.用盐酸区别澄清石灰水和氢氧化钠稀溶液
B.用二氧化锰区别过氧化氢溶液和纯水
C.用蒸馏水区别四氧化三铁粉末和铁粉
D.用铜片区别稀盐酸和稀硫酸
19.AgNO3固体见光或受热易分解,故用棕色试剂瓶保存。AgNO3受热分解,放出的有刺激性气味的气体可能是( )
A.SO2 B.NO2 C.NH3 D.N2
20.下列各组对比实验,能达到实验目的的是( )
实验目的
实验方案
实验
实验
A
研究温度对反应剧烈程度的影响
B
研究CO2气体是否与水发生反应
C
研究SO2是否能形成酸雨
D
研究白磷燃烧是否需要O2
二、本题包括5小题,共30分。
21.(6分)用化学方程式描述下列事实:
(1)常温下,铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式是__________________________;
(2)氢氧化钙、黏土和沙子掺水混合而成的建筑材料俗称“三合土”,在空气中会生成碳酸钙而变得坚硬,反应的化学方程式是________________________________;
(3)高温条件下一氧化碳能把铁从磁铁矿石(主要成分为Fe3O4)中还原出来,反应的化学方程式是___________________________________。
22.(4分)下图为氯化钠和碳酸钠的溶解度曲线,请回答:
(1)20℃时向lOOg水中加入30g氯化钠,所得溶液为 溶液(填“饱和”或“不饱和”);将上述溶液蒸发掉50g水后恢复到20℃,析出的固体质量是______g。
(2)向A、B两个烧杯中各加入100g水,分别配成60℃的氯化钠和碳酸钠饱和溶液,再冷却到10℃,________(填“A”或“B”)烧杯中析出固体较多。
23. (6分)金属钴(Co)与铁具有相似的化学性质。
(1)钴可形成化合价为+2和+3的两种氧化物,其化学式分别是_________、____________。
(2)已知CoCl2固体是蓝色的,CoCl2·6H2O固体和CoCl2溶液都是粉红色的。将滤纸放入CoCl2溶液中浸泡,取出晾干。将干燥的粉红色滤纸用酒精灯小心烘烤,滤纸由粉红色逐渐变成蓝色,烘烤时反应的化学方程式是___________________________________
(3)将金属钴投入稀硫酸中,发生化学反应Co+H2SO4=CoSO4+H2↑。预测可观察到的现象是________________。
(3)固体溶解,有无色气泡产生,溶液由无色变为粉红色。
24.(7分)水是一种重要的自然资源,是生活、生产必不可少的物质。请回答下列问题:
(1)水是一种良好的溶剂,下列物质在水中能配成溶液的是(填字母)________。
A.氢氧化镁 B.氯化镁 C.植物油 D.金属镁
(2)水能与多种物质发生化学反应,试举一例,写出化学方程式_____________________。
(3)如图所示,实验I是制备蒸馏水的装置,实验Il是电解水的装置。
①实验I中水从A经B转移到C的过程中,水分子的组成没有发生变化,发生变化的是水分子的______________。
②实验II中反应的化学方程式为________________________。
B试管中产生的气体可以使带火星的木条复燃,当B中气体的分子数目为n时,A中气体分子数为 _______________。
25.(7分)实验室有盐酸、白醋、柠檬酸三种溶液,回答下列问题:
(1)向三氧化二铁中放入足量盐酸,充分反应后,观察到的现象是_______________,
反应的化学方程式是________________________。
(2)白醋、柠檬酸溶液也能与三氧化二铁发生类似反应,说明白醋、柠檬酸溶液和盐酸中都含有的离子是________。
(3)理论上溶解3.2g三氧化二铁,需要36.5%的盐酸___________g。
三、本题包括4小题,共30分。
26.(4分)实验室用如图所示的装置制取氧气,回答下列问题:
(1)往试管中装入固体粉末时,可先使试管倾斜,用_______把药品小心地送至试管底部
(2)组装该装置时,下列仪器用品的组装顺序是(填序号)________ ___
① 试管 ②铁架台 ⑧酒精灯 ④木块
27.(7分)用下图装置在实验室收集一瓶C02进行性质实验,据图回答问题:
(1)写出图中标号仪器的名称:
A是___________,B是____________。
(2)检查装置气密性的操作和现象是:先用夹子夹住导气管中的橡皮管,再向A中加入水至形成一段水柱,静置,若观察到______________,说明气密性良好。
(3)检验C02是否收集满的操作和现象是:将燃着的木条放在__________,
若火焰熄灭,说明已经收集满。
(4)Na、Mg等活泼金属可以在CO2中燃烧。某同学收集到一瓶CO2后,通过实验验证Mg条能够在CO2中燃烧。下列物品中他需要使用的有______。
①酒精灯 ②铁架台 ③坩埚钳 ④砂纸 ⑤试管夹 ⑥蒸发皿
28.(11分)木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下:
(1)写出下列反应的化学方程式:
反应①:_____________________________________________________;
反应②:___________________________________________________。
(2)反应①所用的硫酸的质量分数为24.5%。现要配制40g 24.5%的硫酸,需________g 98%的硫酸和_______g水。实际操作时,用lOml量筒取98%的硫酸(密度为1.84g/cm3),
请在答题卡图中画出所取硫酸的液面。
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入__________中(填仪器名称),然后__________ (填操作名称),使反应充分进行。
(4)试剂A可选用___________溶液(填一种物质的化学式)。
(5)为了从混合粉末中回收更多的铜,可对实验方案进行修改和完善,你的建议是(提出一条即可)______________________________________________________。
29.(8分)某校科技节的实验比赛中,老师先向大家展示了KNO3、CaCO3和CaCl2三瓶白色粉末,然后取一些KNO3固体于研钵中,接着用一纸板挡住同学们的视线,告诉大家打算继续取CaCO3、CaCl2在研钵中混合。过一会儿老师拿开纸板,向同学们展示研钵中的白色粉末。
请设计一个实验方案,判断老师是否取了CaCO3、CaCl2于上述研钵中。叙述实验操作、预期现象和结论。
提供的试剂有:稀HNO3、蒸馏水、Na2CO3溶液、AgNO3溶液
实验操作
预期现象与结论
_________________,说明老师取了CaCO3
_________________,说明老师取了CaCl2