- 309.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2011年黄埔区初中毕业班综合测试
化学试题
本试卷分第一部分(选择题)和第二部分(非选择题)。第一部分1至4页,第二部分4至8页,共8页。总分100分。考试时间80分钟。
注意事项:
1.答卷前,考生务必在答卷上用黑色钢笔或签字笔填写自己的学校、班级、姓名,同时填写考生号、座位号,再用2B铅笔把对应这两个号码的标号涂黑。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案;不能答在试卷上。
3.非选择题答案必须写在答题卡各题目指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案,改动的答案也不能超出指定的区域;除作图可用2B铅笔外,其他都必须用黑色字迹钢笔或签字笔作答。不准使用涂改液。不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁。考试结束后,将本试卷和答题卡一并交回。
5.全卷共29小题,请考生检查题数。
6.本卷可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Ca 40 Se 79
第一部分 选择题 (共40分)
一、选择题(本题包括20小题,每小题2分,共40分)
注意:每道选择题有四个选项,其中只有一项符合题意。请用铅笔在答题卡上作答。选错、不选、多选或涂改不清的,均不给分。
1.下列生活中的变化有一种与其它三种存在本质的区别,这种变化是
A.衣服晾干 B.菜刀生锈 C.天然气燃烧 D.蔬菜腐烂
2.下列关于分子和原子的说法,正确的是
A.分子是由原子构成的
B.原子不能直接构成物质
C.分子之间没有间隔
D.原子在化学变化中可以再分
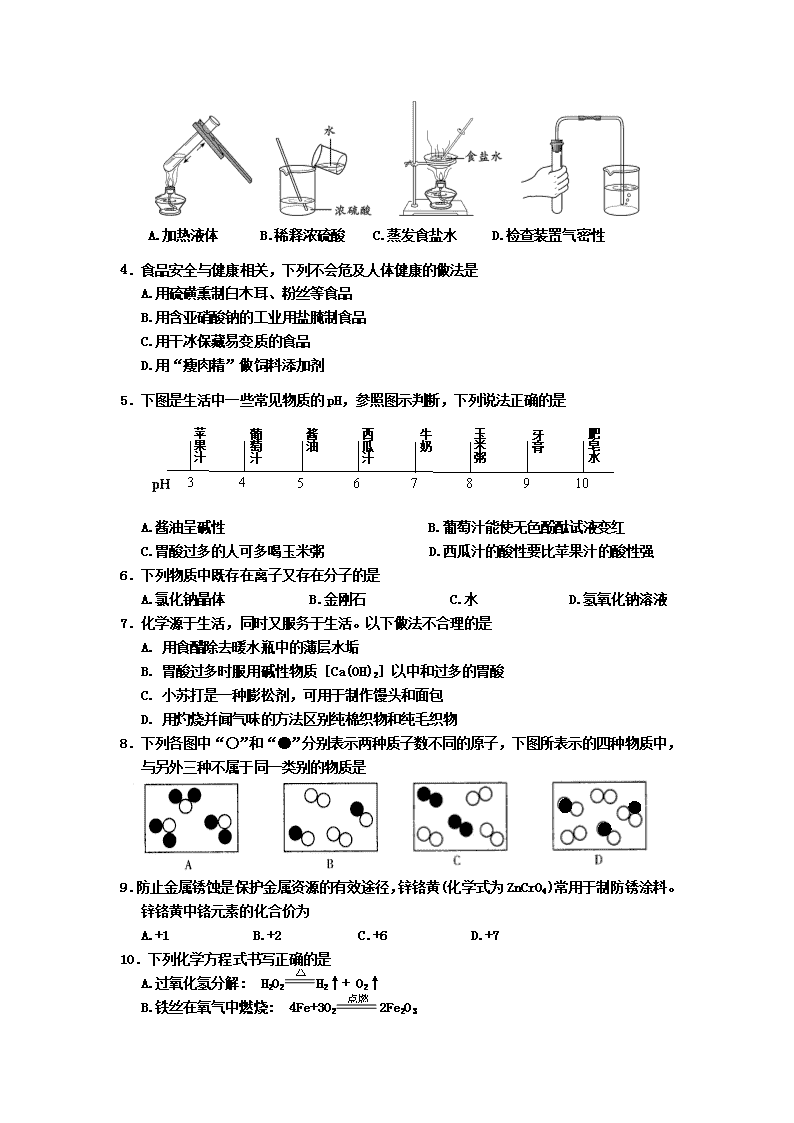
3.下列实验操作中,不正确的是
A.加热液体 B.稀释浓硫酸 C.蒸发食盐水 D.检查装置气密性
4.食品安全与健康相关,下列不会危及人体健康的做法是
A.用硫磺熏制白木耳、粉丝等食品
B.用含亚硝酸钠的工业用盐腌制食品
C.用干冰保藏易变质的食品
D.用“瘦肉精”做饲料添加剂
5.下图是生活中一些常见物质的pH,参照图示判断,下列说法正确的是
苹果汁
葡萄汁
西瓜汁
玉米粥
牛奶
牙膏
肥皂水
酱油
3
4
5
6
7
8
9
10
pH
A.酱油呈碱性 B.葡萄汁能使无色酚酞试液变红
C.胃酸过多的人可多喝玉米粥 D.西瓜汁的酸性要比苹果汁的酸性强
6.下列物质中既存在离子又存在分子的是
A.氯化钠晶体 B.金刚石 C.水 D.氢氧化钠溶液
7.化学源于生活,同时又服务于生活。以下做法不合理的是
A. 用食醋除去暖水瓶中的薄层水垢
B. 胃酸过多时服用碱性物质[Ca(OH)2]以中和过多的胃酸
C. 小苏打是一种膨松剂,可用于制作馒头和面包
D. 用灼烧并闻气味的方法区别纯棉织物和纯毛织物
8.下列各图中“○”和“●”分别表示两种质子数不同的原子,下图所表示的四种物质中,与另外三种不属于同一类别的物质是
9.防止金属锈蚀是保护金属资源的有效途径,锌铬黄 (化学式为ZnCrO4)常用于制防锈涂料。锌铬黄中铬元素的化合价为
A.+1 B.+2 C.+6 D.+7
10.下列化学方程式书写正确的是
A.过氧化氢分解: H2O2H2↑+ O2↑
B.铁丝在氧气中燃烧: 4Fe+3O22Fe2O3
C.铜片投入盐酸溶液中: Cu + 2HC1 === CuC12 + H2↑
D.用烧碱溶液吸收二氧化硫: SO2 + 2NaOH === Na2SO3 + H2O
2
8
+x
11.某粒子的结构示意图为 ,该粒子可能是
A.阳离子 B.阴离子 C.原子 D.以上三种都可能
12.将100g20%氯化钾溶液稀释到500g,稀释后所得溶液中溶剂的质量是
A.100g B.400g C.480 g D.500 g
13.如右图所示,试管中盛有无色液体A,气球中装有固体B,将气球中的固体B倒人液体A中,观察到装置中的小气球鼓起来,则使用的固体和液体可以是
①石灰石和稀盐酸 ②镁和稀硫酸 ③氯化钠固体和水
④生石灰和水
A.①②③ B.①③④ C.①②④ D.②③④
14.下列方法不能将饱和石灰水和氢氧化钠溶液区别开的是
A.分别升高温度 B.分别通入CO2
C.分别滴加碳酸钠溶液 D.分别滴加稀盐酸
15.已知某两种物质在一定条件下能发生化学反应,其反应的微观示意图如下,则下列说法中,正确的是
+
+
(说明:一种小球代表一种元素的原子)
A.图中的反应物都是化合物 B.该反应属于置换反应
C.该反应属于复分解反应 D.该反应不符合质量守恒定律
16.用括号中的试剂除去下列物质中所含杂质,所用药品错误的是
A.NaOH溶液中混有Na2CO3(稀硫酸)
B.NaCl溶液中混有Na2SO4 (BaC12溶液)
C.KCl溶液中混有K2CO3(稀盐酸)
D. CO2 中混有少量CO(灼热的氧化铜)
17.下列操作中,正确的是
A.为了节约药品,将实验用剩余的药品放回原试剂瓶
B.把氢氧化钠固体放在天平左盘的玻璃器皿中称量
C.将pH试纸湿润后用的玻璃棒蘸取待测液测其pH
D.浓硫酸沾到皮肤上,要立即用大量水冲洗,再涂上3%~5%的氢氧化钠溶液
18.下列物质存放在烧杯中一段时间后,质量增大且变质的是
①浓盐酸 ②浓硫酸 ③烧碱 ④食盐 ⑤生石灰 ⑥稀硫酸
A.①⑥ B.②③⑤ C.③⑤ D.②③④
19.对下列实验过程的评价,正确的是
A.向某无色溶液中滴入酚酞试液,溶液不变色,证明该溶液是酸性溶液
B.向某无色溶液中滴入氯化钡溶液,产生白色沉淀,该沉淀一定是BaSO4
C.某白色固体与熟石灰混合后产生使紫色石蕊溶液变蓝色的气体,证明该固体是铵盐
D.把燃着的木条伸入装有无色气体的集气瓶中,火焰熄灭,证明该气体是二氧化碳
20.在常温下,与NaOH溶液、BaCl2溶液、H2O、Zn、Na2CO3五种物质均不能发生反应的是
A.硝酸铜 B.氧化铜 C.稀硫酸 D.二氧化硫
第二部分 非选择题 (共60分)
二、本题包括5小题,共33分
21.(5分)用化学用语填空:
⑴ 碱溶液中的阴离子____________,2个氢原子_____________,二硫化碳_____________
⑵ 硒元素(Se)具有抗衰老、抑制癌细胞生长的功能。硒的一种化合物叫硒酸钠,其中硒元素的化合价是+6,该化合物的化学式为 ,计算硒酸钠的相对分子质量为 。
22.(4分)请写出生产和生活中符合下列要求的物质:
⑴ 常用作食品干燥剂的氧化物是 ;
⑵ 一种有毒气体,可用于铁的冶炼 ;
⑶ 少量存在于人体胃液中,可帮助消化的物质 ;
⑷ 生活中常用于调味和腌渍蔬菜、鱼、肉等食物的盐 。
23.(4分)右图是甲、乙两物质的溶解度曲线图:
⑴ 在温度为_______℃时,甲、乙两物质的溶解度相等。
⑵ 20℃时含有少量未溶解的乙物质的饱和溶液中,若要使乙物
质完全溶解,可以采用的方法是 。
⑶ 40℃时,向100g水中加入 60g甲物质,充分溶解后所得
溶液中溶质的质量分数为 (精确到0.1%)。
24.(11分)通过一年的化学学习,我们认识了“酸”和“碱”,请回答下列问题:
⑴ 常见的酸有硫酸、盐酸等,在它们的水溶液里由于存在有相同的 离子(填符号),因此,它们有很多相似的化学性质,如:① 、
② ……
等(举二例);稀硫酸和稀盐酸还有某些不同的化学性质,如 (举一例)。
⑵ 碱有氢氧化钠、氢氧化钙等,氢氧化钠可作某些气体的干燥剂,如:干燥 等气体(举一例),氢氧化钙可由生石灰与水反应制得,化学方程式为: 。
⑶ 酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用,如硫酸厂的污水中含有硫酸等杂质,可用熟石灰进行处理,反应的化学方程式为:
,现有一硫酸厂每日排放2000t含硫酸0.01%的污水,若要用熟石灰中和污水中的硫酸,每日需熟石灰的质量是 t(精确到0.01)。
⑷ 地震等灾害发生后,为了灾区人民群众的饮用水安全,卫生防疫部门要经常对灾区水源进行监测,获得可靠的科学依据。若现有一瓶水样,要获取它的酸碱度,应如何操作:
。
25.(9分)实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下:
请回答:
⑴ 操作1是 ,固体A的成分 。
⑵ 固体C是 。滤液1和滤液2中溶质相同,该溶质是 。
⑶ 加入过量锌粉的目的是 ,加入过量锌粉的其中一个反应
的化学方程式 ;加入足量稀硫酸发生反应的化学方程式 。
三、本题包括4小题,共27分
26.(4分)现有下列仪器:
①
②
③
④
⑤
⑥
⑦
⑴在过滤操作中需要玻璃棒、 、 等玻璃仪器 (填仪器的名称);
⑵用氯化钠固体配制50g质量分数为5%氯化钠溶液,除了需要用到①和④仪器外,还需要用到的仪器是 、 (用序号填空)。
27.(9分)通过一年的化学学习,你已经掌握了实验室制取气体的有关规律。请结合下图提供的一些实验装置回答问题:
⑴应用A、B装置制气体时在加入药品之前应对实验装置进行 。
⑵实验室若选用B装置来制氧气,加入药品通常采用“把过氧化氢溶液缓缓加入盛有少量MnO2的反应容器中”,优点是_________________________________________________;
100g溶质质量分数为6.8%的过氧化氢溶液加入1.6g二氧化锰反应完全后,生成氧气的质量为_____________ g。
⑶实验室制取并收集到较纯净的H2,可选用装置是 (填写装置序号)。判断H2已收集满的方法是 。
⑷
乙炔又称电石气,是一种无色、无味、密度比空气略小,不溶于水的气体;工业上常用它燃烧产生的高温来切割和焊接金属;实验室用电石(固体)与水反应制取乙炔。你认为制取乙炔应选择的发生装置是 (填写装置序号); 收集装置是 (填写装置序号)。
28.(6分)颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”。实验室制备的方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2发生置换反应,生成“纳米铁”。请回答以下问题:
⑴ 写出生成“纳米铁”的化学方程式_____________________________________________。
⑵ 反应中需要保护气的原因是__________________________________________________。
⑶ 某化学探究小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:①将大小一样的铁片和镁片分别加入到溶质质量分数相同的稀盐酸中;②将铜片加入到硝酸汞溶液中,铜片上出现银白色物质;③将金属片A加入到溶液B中。根据实验①判断出镁的金属活动性比铁强,依据的现象是
;
根据实验②的现象得出的结论是 ;如果实验③中的B是蓝色溶液,则金属A是 。
29.(8分)实验室有四瓶没有标签的无色液体,分别是氢氧化钠溶液、氯化钠溶液、氯化镁溶液和稀盐酸,请选用一种试剂,设计一个实验方案进行鉴别,并完成实验报告。
实验操作
预期现象与结论
2011年黄埔区初中毕业班综合测试化学试题
参考答案和评分标准
一、选择题(本题包括20小题,每小题2分,共40分)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
A
B
C
C
D
B
A
C
D
题号
11
12
13
14
15
16
17
18
19
20
答案
D
C
C
D
B
A
B
C
C
B
二、本题包括5小题,共33分
21.(共5分,每空1分)
⑴ OH- 、 2H 、 CS2 ⑵ Na2SeO4 、 189
22.(共4分,每空1分)
⑴ CaO ⑵ CO ⑶ HCl ⑷ NaCl
23. (共4分)
⑴ t (1分) ⑵ 向溶液加水或降低温度 (1分)⑶ 33.3% (2分,其他答案不给分)
24.(共11分)
⑴ H+ ① 都能使紫色石蕊溶液变红 ② 都能跟碱发生中和反应、
稀硫酸能和氯化钡溶液反应而稀盐酸不能(以上答案合理给分)(各1分,共4分)
⑵ O2 , CaO+H2O=Ca(OH)2 (各1分)
⑶ Ca(OH)2 + H2SO4= CaSO4 +2H2O (1分) 0.15 (2分)
⑷ 把小块pH试纸放在表面皿(或玻璃片)上,用蘸有水样的玻璃棒点在试纸
的中部,试纸变色后,与标准比色卡比较来确定水样的pH。 (2分)
25. (共9分)
⑴ 过滤 (1分) Cu、Zn、Fe(3分)
⑵ Fe ZnSO4 (各1分)
⑶ 把废液中铜离子和铁离子全部置换出来。(1分)
⑷ CuSO4 + Zn == ZnSO4 + Cu (或Fe SO4 + Zn == ZnSO4 + Fe) (1分)
Zn + H2SO4 == ZnSO4 + H2↑(1分)
二、本题包括4小题,共27分
26.(共4分,每空1分) ⑴ 烧杯、漏斗 ⑵ ⑤、⑥
27.(共9分)
⑴ 检查装置的气密性(1分)
⑵ 可以得到平稳的氧气流(1分) 3.2g (2分)
⑶ B、D (各1分) 集气瓶口有大量气泡逸出(1分)
⑷ B 、 D(各1分)
28.(共6分)
⑴ FeCl2 +H2Fe +2HCl (2分)
⑵ 纳米铁有很强的反应活性,防止铁在高温下与氧气反应 (1分)
⑶ 镁片与盐酸反应比铁片与盐酸反应剧烈、铜比汞的金属活动性强、 铁(各1分,共3分)
29.(共8分)
实验操作
预期现象与结论
1.分别取少量液体于四只试管中,再各滴入紫色石蕊溶液。
2.分别向上述紫色溶液中加入少量氢氧化钠溶液。
显红色的是稀盐酸,显蓝色的是氢氧化钠溶液,显紫色的是氯化钠溶液和氯化镁溶液。
有沉淀生成的是氯化镁溶液,没有明显现象的是氯化钠溶液。