- 294.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018中考化学真题分类汇编
专题分类:常见气体的制取1.
1.(2018德州)实验室中分别用高锰酸钾、过氧化氢、氯酸钾制取比较纯净的氧气。请你按照要求回答问题:
(l)结合下图所提供装置完成下列表格
(2)请结合上图回答问题:
①写出甲、乙所指仪器名称:甲_______________;乙_______________;
②用过氧化氢制氧气的装置与其他两种方法的装置相比具有的优点____________,_____________(写出两条);
③若用下图装置收集一瓶氧气,气体应从____(填a或b)端进入集气瓶。
【答案】(1)AD (2)2H2O22H2O+O2↑(3)BD (4)2KClO32KCl+3O2↑(5)酒精灯 (6)集气瓶 (7)可随时添加液体药品 (8)操作简便或节能安全 (9)b
【解析】(1)实验室用高锰酸钾制取氧气的反应是固体,反应条件是加热,排水法收集的氧气纯净,所以应选用的装置组合是AD;过氧化氧在二氧化锰做催化剂的条件下生成水和氧气,化学方程式为:2H2O22H2O+O2↑,实验室用过氧化氧和二氧化锰制取氧气的反应是固体和液体,反应条件是常温,排水法收集的氧气纯净,所以应选用的装置组合是BD;加热二氧化锰和氯酸钾的混合物生成氯化钾和氧气,化学方程式为:2KClO32KCl+3O2↑;(2)①据图可知甲、乙所指仪器名称:甲是酒精灯;乙是集气瓶;②用过氧化氢制氧气的装置与其他两种方法的装置相比具有的优点是:可随时添加液体药品、操作简便或节能安全等;③用排水法收集氧气时,在瓶中装满水,氧气应从b端进入。
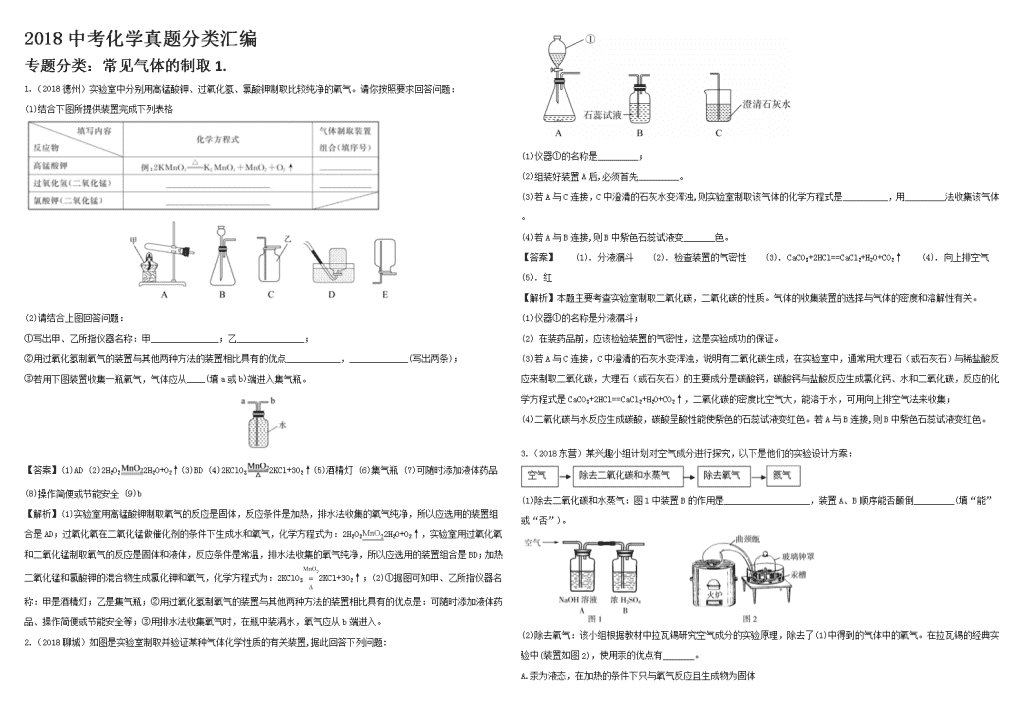
2.(2018聊城)如图是实验室制取并验证某种气体化学性质的有关装置,据此回答下列问题:
(1)仪器①的名称是_________;
(2)组装好装置A后,必须首先_________。
(3)若A与C连接,C中澄清的石灰水变浑浊,则实验室制取该气体的化学方程式是__________,用_________法收集该气体。
(4)若A与B连接,则B中紫色石蕊试液变_______色。
【答案】 (1). 分液漏斗 (2). 检查装置的气密性 (3). CaCO3+2HCl==CaCl2+H2O+CO2↑ (4). 向上排空气 (5). 红
【解析】本题主要考查实验室制取二氧化碳,二氧化碳的性质。气体的收集装置的选择与气体的密度和溶解性有关。
(1)仪器①的名称是分液漏斗;
(2) 在装药品前,应该检验装置的气密性,这是实验成功的保证。
(3)若A与C连接,C中澄清的石灰水变浑浊,说明有二氧化碳生成,在实验室中,通常用大理石(或石灰石)与稀盐酸反应来制取二氧化碳,大理石(或石灰石)的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是CaCO3+2HCl==CaCl2+H2O+CO2↑,二氧化碳的密度比空气大,能溶于水,可用向上排空气法来收集;
(4)二氧化碳与水反应生成碳酸,碳酸呈酸性能使紫色的石蕊试液变红色。若A与B连接,则B中紫色石蕊试液变红色。
3.(2018东营)某兴趣小组计划对空气成分进行探究,以下是他们的实验设计方案:
(1)除去二氧化碳和水蒸气:图1中装置B的作用是___________________,装置A、B顺序能否颠倒_________(填“能”或“否”)。
(2)除去氧气:该小组根据教材中拉瓦锡研究空气成分的实验原理,除去了(1)中得到的气体中的氧气。在拉瓦锡的经典实验中(装置如图2),使用汞的优点有_______。
A.汞为液态,在加热的条件下只与氧气反应且生成物为固体
B.时间足够长,能将密闭装置中的氧气几乎耗尽
C.无法观察装置中气体体积的变化
D.得到的氧化汞粉末加热生成的气体体积+剩余气体体积=原空气体积
(3)分析误差:该小组按设计方案得到的氮气密度(假设要除去的气体均已除净)与氮气的实际密度有误差,产生误差的原因是___________________。
(4)拓展与延伸:实验室如何制取氮气呢?
请阅读资料并回答下列问题:
资料:
①仪器B的名称是 ______。
②利用上述仪器和重铬酸铵在实验室制取少量氮气,其发生装置应选择的仪器有_____
(填序号),还必须补充的一种仪器是_______________。若用上述装置制氧气,反应的化学方程式为________________________。
③根据已有知识,收集氮气只能用________法,理由是______________________。该小组欲进行镁在氮气中的燃烧实验,现收集一瓶含水约1/5体积的氮气,该如何操作____________。
【答案】 (1). 除去水蒸气(或除水) (2). 否 (3). ABD (4). 得到的气体中还含有稀有气体 (5). 锥形瓶 (6). CDF (7). 酒精灯 (8). 2KMnO4K2MnO4+MnO2+O2↑(2KClO3 2KCl + 3O2↑) (9). 排水法 (10). 氮气密度接近空气且难溶于水 (11). 向集气瓶中装满水,倒扣入水槽中,当收集到约剩余1/5体积水时,停止收集,移出集
气瓶,放在实验台上。
【解析】本题考查了测定空气里氧气含量的探究,常见气体的检验与除杂方法,化学方程式的书写。气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关。
(1)浓硫酸具有吸水性,图1中装置B的作用是:除去水蒸气;气体从溶液通过会带出部分水蒸气,装置A、B顺序不能颠倒;
(2)A、汞为液态,在加热的条件下只与氧气反应且生成物为固体,正确;B、汞与氧气在加热时反应生成氧化汞,时间足够长,能将密闭装置中的氧气几乎耗尽,正确;C、汞是液体,当容器内压强改变时,液面的位置发生改变,能观察装置中气体体积的变化,错误;D、汞与氧气在加热时反应生成氧化汞,氧化汞受热分解生成汞和氧气,得到的氧化汞粉末加热生成的气体体积+剩余气体体积=原空气体积,正确。故选:ABD;
(3)该小组按设计方案得到的氮气密度(假设要除去的气体均已除净)与氮气的实际密度有误差,产生误差的原因是:得到的气体中还含有稀有气体;
(4)①仪器B的名称是锥形瓶;
②利用上述仪器和重铬酸铵,在实验室中制取少量氮气,重铬酸铵加热至180℃时,可分解生成氮气,其发生装置应选择的仪器有:CDF,还必须补充的一种仪器是:酒精灯;若用上述装置制氧气,可用高锰酸钾或氯酸钾制氧气,高锰酸钾分解生成锰酸钾、二氧化锰和氧气,氯酸钾和二氧化锰混合加热时,生成氯化钾和氧气,反应的化学方程式分别是2KMnO4K2MnO4+MnO2+O2↑,2KClO3 2KCl + 3O2↑;
③氮气的密度比空气略小,难溶于水,因此只能用排水法收集;该小组欲进行镁在氮气中的燃烧实验,现收集一瓶含水约1/5 体积的氮气,操作方法是:向集气瓶中装满水,倒扣入水槽中,当收集到约剩余1/5体积水时,停止收集,移出集气瓶,放在实验台上。
4.(2018青岛)实验室制取气体时需要的一些装置如下图所示,请回答下列问题。
(1)写出标有序号的仪器名称:①______,②______。
(2)实验室制取氧气和二氧化碳的发生装置都可选用 B 装置的原因是______,装置中使用分液漏斗的优点是______。
(3)若要得到干燥的氧气,所选择装置的连接顺序为:B→______→______(填字母序号)。
(4)检验二氧化碳是否收集满的操作方法是______。
(5)某兴趣小组的同学连接 B、G、H 装置进行实验。若实验时 G 装置中蜡烛燃烧更剧烈,H 装置中溶液变浑浊,则 B 装置中反应的化学方程式为______。
【答案】 (1). 酒精灯; (2). 锥形瓶; (3). 反应物是固体和液体,反应不需要加热; (4). 可以控制反应速率,节约药品; (5). F; (6). E; (7). 将一根燃着的木条平放在集气瓶口,木条熄灭,证明二氧化碳收集满(答案合理即可); (8). 2H2O22H2O+O2↑
【解析】(1)根据常见仪器解答;(2)根据反应物的状态、反应条件解答;根据可以控制反应速率,节约药品解答;(3)根据先干燥、后用向上排空气法收集解答;(4)根据将燃着的木条置于集气瓶口,木条熄灭,证明二氧化碳收集满解答;(5)根据过氧化氢溶液在加入二氧化锰的条件下分解生成水和氧气解答。(1)标有序号的仪器名称:①酒精灯,②锥形瓶;(2)实验室制取氧气和二氧化碳的发生装置都可选用B装置的原因是:反应物都是固体和液体,反应不需要加热;装置中使用分液漏斗的优点是:可以控制反应速率,节约药品;(3
)若要得到干燥的氧气,氧气可以用浓硫酸干燥,所选择装置的连接顺序为B→F→E;(4)二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明二氧化碳收集满;(5)若实验时G装置中蜡烛燃烧更剧烈,H装置中溶液变浑浊,则B装置中生成的是氧气。过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,反应的化学方程式为2H2O2MnO22H2O+O2↑。
5.(2018北京)实验室用右图装置制取CO2.
(1)反应的化学方程式为 。
(2)用向上排空气法收集CO2的原因是 。
答案:(1)CaCO3 + 2HCl===CaCl2 + H2O + CO2↑;
(2)CO2的密度大于空气的密度,且不与空气中的成分发生反应。
解析:(1)实验室用大理石和稀盐酸反应来制取二氧化碳,其反应的化学方程式为CaCO3 + 2HCl===CaCl2 + H2O + CO2↑;
(2)能用向上排空气法收集的气体,其密度要比空气密度大,且与空气中的成分不发生化学反应,CO2的密度大于空气的密度,且不与空气中的成分发生反应,故可用向上排空气法收集。
6.(2018天津)根据下列装置图回答问题:
(1)写出仪器a和b的名称:a________,b________。
(2)实验室用大理石和稀盐酸制取并收集二氧化碳,应选用的装置为________(填字母),若用F装置干燥二氧化碳气体,F中应加入的试剂是________。
(3)实验室用高锰酸钾制取气体,该反应的化学方程式为________。
(4)实验室取用药品要注意节约,如果没有说明用量,一般应该取用最少量,固体药品只需盖满试管底部,液体药品取用________mL。
【答案】(1)试管 (2)集气瓶 (3) BD (4)浓硫酸 (5) 2KMnO4K2MnO4+MnO2+O2↑(6) 1~2
【解析】(1)a是试管,b是集气瓶;(2)固液常温反应制取气体,选择发生装置B,二氧化碳的密度比空气的密度大,用向上排空气法收集,选择收集装置D;浓硫酸具有吸水性,可干燥二氧化碳;(3)用高锰酸钾制取氧气的化学方程式为:2KMnO4K2MnO4+MnO2+O2↑;(4)如果没有说明用量,一般液体药品取用1~2mL。
7.(2018枣庄)请分析下列实验装置,阅读所给材料,回答问题:
材料:氨气(NH3)常温下是一种具有刺激性气味的无色气体,对人体有较大毒性,密度比空气小,极易溶于水,其水溶液显碱性。实验室可用加热氯化铵(NH4Cl)和熟石灰两种固体的方法制取氯气,同时生成氯化钙和水。铵盐易溶于水,Ca(OH)2微溶于水,CaCl2溶液显中性,NH4Cl溶液显酸性。
(1)实验室制取氨气的化学方程式为 2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑ ,应选取的发生装置是 B (填装置编号)。
(2)用C装置收集氨气时,气体应从 b 口通入(填“a”或“b”);检验氨气可用湿润的 红色 石蕊试纸(填“红色”或“蓝色”)。
(3)某同学对充分反应后反应器内的固体物质做进一步研究:
【提出问题】固体物质的成分是什么?
【作出猜想】猜想I:Ca(OH)2、NH4Cl和CaCl2
猜想II:Ca(OH)2和CaCl2
猜想III:NH4Cl和CaCl2
猜想IV:只有CaCl2
有同学对上述猜想提出质疑:有一种猜想不合理。你认为是 猜想I 。
【实验探究】①取反应器内少量固体于试管中,加水溶解、过滤,得到滤液。
②取少量溶液于试管中,滴加无色酚酞试液溶液,颜色无变化,说明 猜想II (填一种猜想)不正确。
③再取少量滤液于另一试管中,滴加AgNO3溶液,产生白色沉淀,该同学认为固体中含有NH4Cl,于是得出结论猜想III正确。你认为该同学的结论 不合理 (填“合理“或“不合理”),理由是 氯化钙也能和硝酸银反应生成白色沉淀 。
【评价反思】该同学认为实验装置仍有不足之处,请你提出改进措施: 在C装置的a导管连接吸收氨气的装置 。
解析:(1)实验室制取氨气的化学方程式为:2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑,反应需要加热,应选取的发生装置是B。
故填:2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑;B。
(2)用C装置收集氨气时,由于氨气密度比空气小,气体应从b口通入;
检验氨气可用湿润的红色石蕊试纸,这是因为氨气能够水反应生成氨水,氨水能使湿润的红色石蕊试纸。
故填:b;红色。
(3)【作出猜想】
上述猜想中,猜想I不合理,这是因为氢氧化钙和氯化铵不能共存。
故填:猜想I。
【实验探究】
②取少量溶液于试管中,滴加无色酚酞试液溶液,颜色无变化,说明溶液不显碱性,即溶液中不含有氢氧化钙,说明猜想II不正确。
故填:猜想II。
③该同学的结论不合理,理由是氯化钙也能和硝酸银反应生成白色沉淀。
故填:不合理;氯化钙也能和硝酸银反应生成白色沉淀。
【评价反思】
该同学认为实验装置仍有不足之处,不足之处是:没有处理尾气装置,改进措施:在C装置的a导管连接吸收氨气的装置。
故填:在C装置的a导管连接吸收氨气的装置