- 276.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
实 验 探 究
1.有一包未知粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜六种物质中的四种。兴趣小组为确定其组成设计并进行如下实验。
【实验一】甲组同学进行定性探究。
实验操作
实验现象
实验结论及分析
(1)取少量该未知粉末于烧杯中,加入足量的水溶解、过滤。
粉末部分溶解,
得到白色滤渣和无色滤液。
原粉末中一定不含 ;
白色滤渣不一定是原粉末中的碳酸钙,其理由是 。
(用化学方程式表示)。
(2)向滤液中滴加无色酚酞试液。
溶液变红
滤液中存在碱性物质。
(3)向(2)中滴加足量稀盐酸。
原固体粉末中一定含有Na2CO3。
【实验二】乙组同学进行定量探究。
实验测得固体B中含15 g氯元素。试综合甲、乙两组同学的实验进行分析。
(1)乙组实验中一定发生的化学反应是:Na2CO3+ 2HCl=2NaCl + H2O+ CO2↑和 。
(2)该未知粉末的组成可能是 。
2.工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
【资料1】草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为:
浓H2SO4
Δ
H2C2O4·3H2O CO2↑+ CO↑+ 4H2O
【问题讨论】用下图所示装置进行实验:
A B C D E F
(1)实验前应先检查装置的气密性。
(2)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)B装置的作用是 。
(4)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸。
②停止加热后 。
【数据分析与计算】
【资料2】铁的常见氧化物中铁的质量分数:
铁的氧化物
FeO
Fe2O3
Fe3O4
铁的质量分数
77.8%
70.0%
72.4%
(5)称取铁红样品10.0 g,用上述装置进行实验,测定铁红中铁的质量分数。
① D中充分反应后得到Fe粉的质量为m g,则m的取值范围是 。
② 实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是 。(计算结果精确到0.1%)
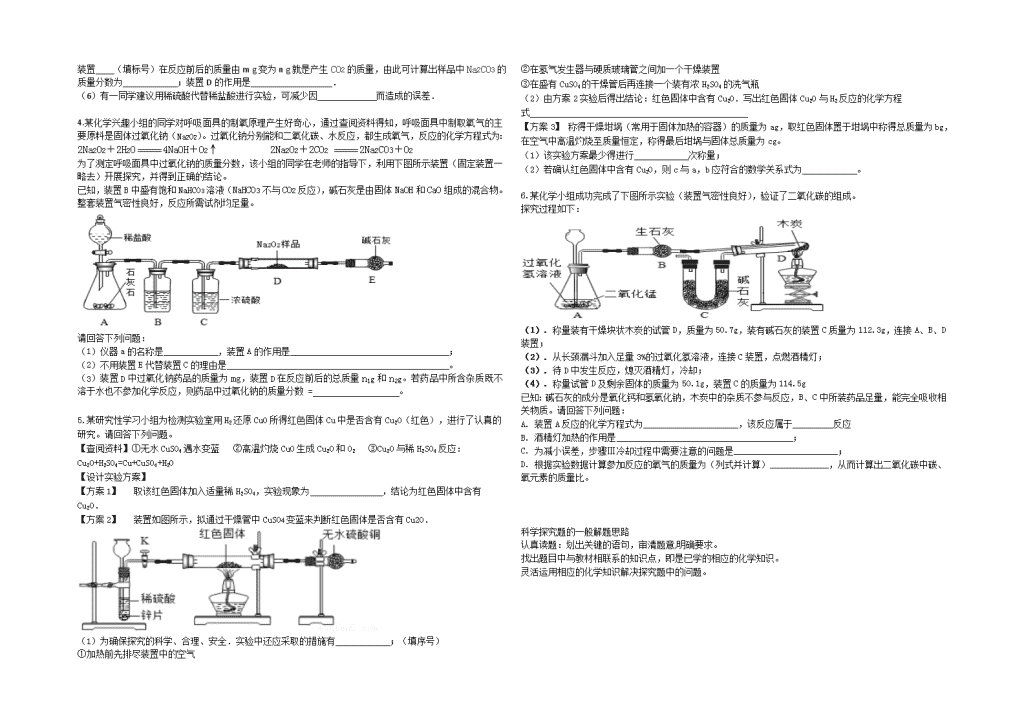
3.用“侯氏制碱法”制得的纯碱常有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱a g样品中碳酸钠的质量分数进行实验探究,在老师的指导下,他们设计了下列两种实验方案。资料摘要:碱石灰常用于吸收水蒸气和二氧化碳。
【方案一】利用样品与氯化钙溶液反应产生的沉淀来测定Na2CO3的质量分数:称取样品,溶于足量的水,滴加过量的CaCl2溶液,再洗涤……,最后称得沉淀物 b g。
(1) 滴加CaCl2溶液要足量的原因: .
(2)将反应后的混合物过滤,对沉淀物进行洗涤、 、称量.利用沉淀物的质量计算Na2CO3的质量分数。如不洗涤沉淀会造成测定结果______(填“偏大”或“偏小”),这是因为 ;
(3) 列出碳酸钠的质量分数的计算式 。
【方案二】利用样品与稀盐酸反应产生的气体来测定Na2CO3的质量分数.
利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,且每步反应均完全)。
(4) 连接装置A和B,打开止水夹K。通入已除去CO2的空气,排尽装置A和B中含有的 ,再接装置C和D。
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应)。待装置A中的反应结束后,再一次打开止水夹K,继续往装置内通入已除去CO2的空气,目的是____ __,装置B的作用是 。
装置 (填标号)在反应前后的质量由m g变为n g就是产生CO2的质量,由此可计算出样品中Na2CO3的质量分数为 ;装置D的作用是 .
(6)有一同学建议用稀硫酸代替稀盐酸进行实验,可减少因 而造成的误差.
4.某化学兴趣小组的同学对呼吸面具的制氧原理产生好奇心,通过查阅资料得知,呼吸面具中制取氧气的主要原料是固体过氧化钠(Na2O2)。过氧化钠分别能和二氧化碳、水反应,都生成氧气,反应的化学方程式为:
2Na2O2+2H2O4NaOH+O2↑ 2Na2O2+2CO2 2Na2CO3+O2
为了测定呼吸面具中过氧化钠的质量分数,该小组的同学在老师的指导下,利用下图所示装置(固定装置一略去)开展探究,并得到正确的结论。
已知,装置B中盛有饱和NaHCO3溶液(NaHCO3不与CO2反应),碱石灰是由固体NaOH和CaO组成的混合物。整套装置气密性良好,反应所需试剂均足量。
请回答下列问题:
(1)仪器a的名称是 ,装置A的作用是 ;
(2)不用装置E代替装置C的理由是 。
(3)装置D中过氧化钠药品的质量为mg,装置D在反应前后的总质量n1g和n2g。若药品中所含杂质既不溶于水也不参加化学反应,则药品中过氧化钠的质量分数 = 。
5.某研究性学习小组为检测实验室用H2还原CuO所得红色固体Cu中是否含有Cu2O(红色),进行了认真的研究。请回答下列问题。
【查阅资料】①无水CuSO4遇水变蓝 ②高温灼烧CuO生成Cu2O和O2 ③Cu2O与稀H2SO4反应:Cu2O+H2SO4=Cu+CuSO4+H2O
【设计实验方案】
【方案1】 取该红色固体加入适量稀H2SO4,实验现象为 ,结论为红色固体中含有Cu2O.
【方案2】 装置如图所示,拟通过干燥管中CuSO4变蓝来判断红色固体是否含有Cu2O.
(1)为确保探究的科学、合理、安全.实验中还应采取的措施有 ;(填序号)
①加热前先排尽装置中的空气
②在氢气发生器与硬质玻璃管之间加一个干燥装置
③在盛有CuSO4的干燥管后再连接一个装有浓H2SO4的洗气瓶
(2)由方案2实验后得出结论:红色固体中含有Cu2O.写出红色固体Cu2O与H2反应的化学方程
式
【方案3】 称得干燥坩埚(常用于固体加热的容器)的质量为ag,取红色固体置于坩埚中称得总质量为bg,在空气中高温灼烧至质量恒定,称得最后坩埚与固体总质量为cg。
(1)该实验方案最少得进行 次称量;
(2)若确认红色固体中含有Cu2O,则c与a,b应符合的数学关系式为 。
6.某化学小组成功完成了下图所示实验(装置气密性良好),验证了二氧化碳的组成。
探究过程如下:
(1). 称量装有干燥块状木炭的试管D,质量为50.7g,装有碱石灰的装置C质量为112.3g,连接A、B、D装置;
(2). 从长颈漏斗加入足量3%的过氧化氢溶液,连接C装置,点燃酒精灯;
(3). 待D中发生反应,熄灭酒精灯,冷却;
(4). 称量试管D及剩余固体的质量为50.1g,装置C的质量为114.5g
已知:碱石灰的成分是氧化钙和氢氧化钠,木炭中的杂质不参与反应,B、C中所装药品足量,能完全吸收相关物质。请回答下列问题:
A. 装置A反应的化学方程式为_____________________,该反应属于_________反应
B. 酒精灯加热的作用是 ;
C. 为减小误差,步骤Ⅲ冷却过程中需要注意的问题是_______________________;
D. 根据实验数据计算参加反应的氧气的质量为(列式并计算)_____________,从而计算出二氧化碳中碳、氧元素的质量比。
科学探究题的一般解题思路
认真读题:划出关键的语句,审清题意,明确要求。
找出题目中与教材相联系的知识点,即是已学的相应的化学知识。
灵活运用相应的化学知识解决探究题中的问题。