- 374.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
坐标曲线题
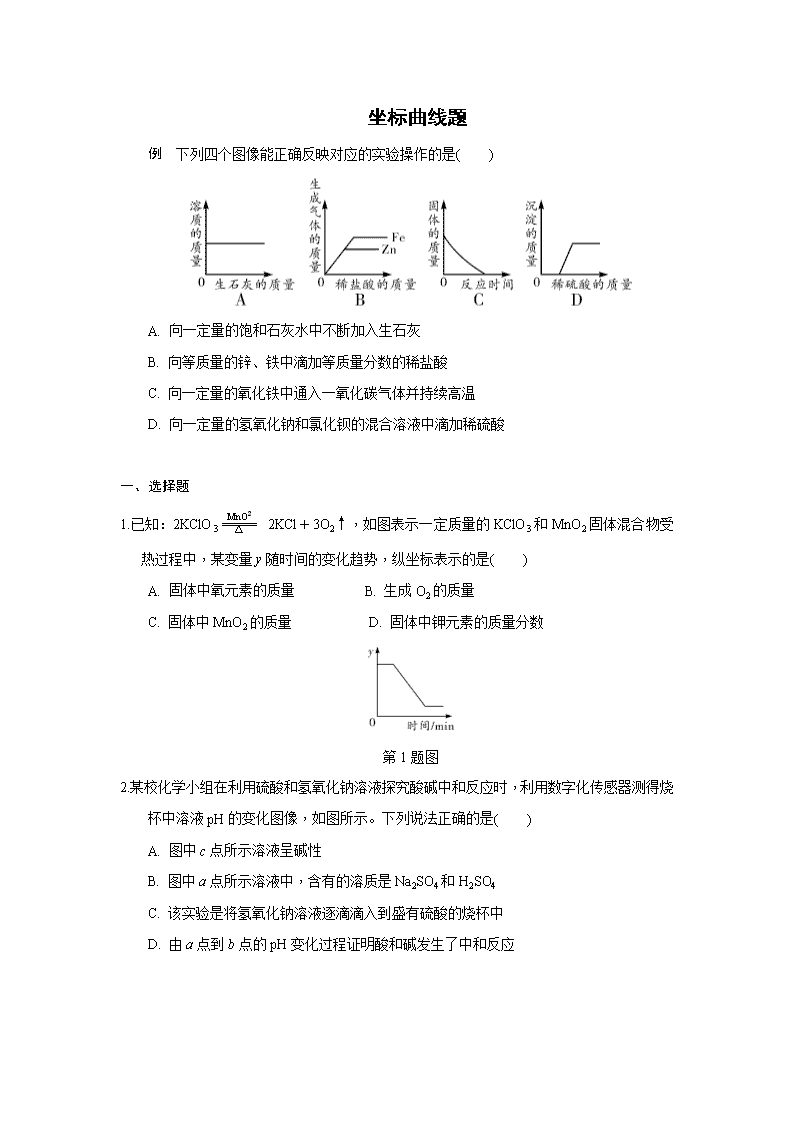
例 下列四个图像能正确反映对应的实验操作的是( )
A. 向一定量的饱和石灰水中不断加入生石灰
B. 向等质量的锌、铁中滴加等质量分数的稀盐酸
C. 向一定量的氧化铁中通入一氧化碳气体并持续高温
D. 向一定量的氢氧化钠和氯化钡的混合溶液中滴加稀硫酸
一、选择题
1.已知:2KClO3 2KCl+3O2↑,如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( )
A. 固体中氧元素的质量 B. 生成O2的质量
C. 固体中MnO2的质量 D. 固体中钾元素的质量分数
第1题图
2.某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像,如图所示。下列说法正确的是( )
A. 图中c点所示溶液呈碱性
B. 图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4
C. 该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中
D. 由a点到b点的pH变化过程证明酸和碱发生了中和反应
第2题图第 3题图
3.向甲物质中逐渐加入乙物质至过量。若x轴表示加入乙物质的质量,则下列选项与图不相符合的是( )
选项
甲物质
乙物质
Y轴表示的含义
A
二氧化锰
过氧化氢溶液
二氧化锰的质量
B
t ℃的水
硝酸钾
t ℃时硝酸钾的溶解度
C
氯化银
稀硝酸
氯化银的质量
D
饱和石灰水
生石灰
溶液的质量
4.下列能正确反映相关实验过程中量的变化关系的图像是( )
第4题图
A. 图1表示一定压强下,氧气在水中的溶解度
B. 图1表示一定压强下,氢氧化钙在水中的溶解度
C. 图2表示一定温度下,向不饱和硝酸钾溶液中加入硝酸钾
D. 图2表示一定温度下,向水中加入硝酸钾
第5题图
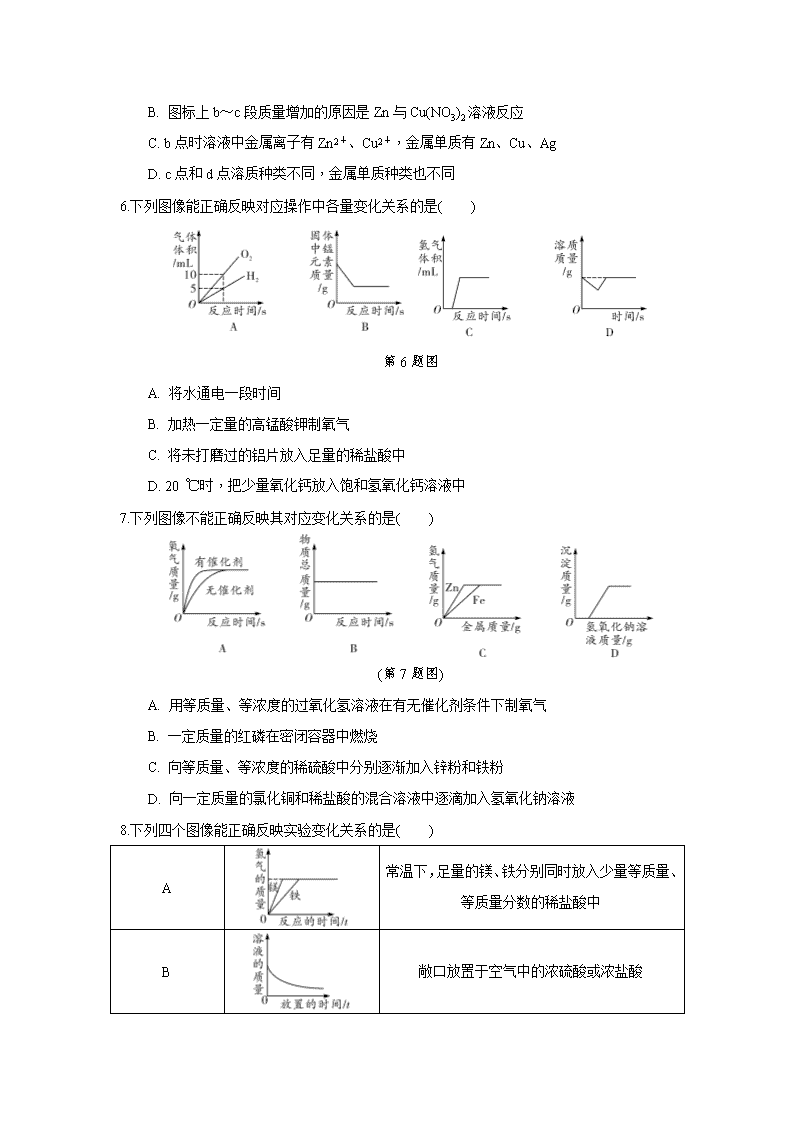
5.向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间变化的情况如图所示。下列说法正确的是( )
A. 取a点溶液,滴加稀盐酸,无白色沉淀
B. 图标上b~c段质量增加的原因是Zn与Cu(NO3)2溶液反应
C. b点时溶液中金属离子有Zn2+、Cu2+,金属单质有Zn、Cu、Ag
D. c点和d点溶质种类不同,金属单质种类也不同
6.下列图像能正确反映对应操作中各量变化关系的是( )
第6题图
A. 将水通电一段时间
B. 加热一定量的高锰酸钾制氧气
C. 将未打磨过的铝片放入足量的稀盐酸中
D. 20 ℃时,把少量氧化钙放入饱和氢氧化钙溶液中
7.下列图像不能正确反映其对应变化关系的是( )
(第7题图)
A. 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气
B. 一定质量的红磷在密闭容器中燃烧
C. 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
D. 向一定质量的氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
8.下列四个图像能正确反映实验变化关系的是( )
A
常温下,足量的镁、铁分别同时放入少量等质量、等质量分数的稀盐酸中
B
敞口放置于空气中的浓硫酸或浓盐酸
C
加热KNO3、Ca(OH)2的饱和溶液(不考虑溶剂的蒸发)
D
少量的碳在密闭的集气瓶中与氧气完全燃烧
9.下列图像与对应的表述不吻合的是( )
,第9题图)
A. 向氢氧化钠溶液中不断加水
B. 氯酸钾和二氧化锰混合加热制取氧气
C. 向硫酸和硫酸铜的混合溶液中滴加氢氧化钠溶液
D. 某温度下,向一定量接近饱和的硝酸钾溶液中加入硝酸钾固体
二、填空与简答题
10.小明测得石灰石与一定量的稀盐酸反应后的溶液pH为2,取适量该溶液向其中逐滴加入碳酸钠溶液,并测得溶液pH随加入碳酸钠溶液体积的变化曲线如图所示。请回答下列问题:
第10题图
(1)A点处溶液中的两种溶质是__________________(写化学式)。
(2)AB段可观察到的实验现象是________________。
(3)BC段发生反应的化学方程式是____________________________。
(4)CD段pH上升的原因是______________________。
11.现有10%的Na2CO3溶液,请按下面要求回答:
(1)向106 g上述溶液中逐滴加入10%的盐酸并不断搅拌。反应中生成的CO2质量的变化如下:
加入的盐酸质量/g
0
18.25
36.5
54.75
73
91.25
生成的CO2
质量/g
0
0
a
2.2
4.4
b
①表中a的值为________,b的值为________。
②请绘出生成CO2的质量与加入盐酸质量的关系图。
,第11题图)
(2)碳酸钠与盐酸的反应分为两步:①Na2CO3+HCl=== NaHCO3+NaCl;②________________________。
(3)若其他条件不变,改用20%的盐酸进行滴定,请结合上述曲线,分析新曲线的起点与最高点所对应的横纵坐标位置。
①起点横坐标________,纵坐标________。
②最高点横坐标________,纵坐标________。
12.请按要求完成下列金属性质的实验:
研究一:金属与酸反应过程中的能量变化。
第12题图
(1)打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应____________(填“放热”或“吸热”),反应的化学方程式为________________________。
(2)实验测得反应中产生气体的速度(v)与时间(t)的关系如图,请根据t1~t2时间段反应速率变化,说明化学反应速率受________等因素影响。
研究二:金属与盐溶液反应过程中的相关变化。
(1)某同学用硫酸铜溶液把“铁勺”变“铜勺”,其反应的化学方程式为_______________________________。
(2)在一定量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,充分反应后,下图描述相关变化曲线,一定不正确的是________。
三、计算题
13.菱铁矿(主要成分是FeCO3)是炼铁的原料。现取20.0 g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示。
已知:①FeCO3+H2SO4=== FeSO4+CO2↑+H2O
②菱铁矿中杂质不参加反应,且难溶于水。
请计算:
(1)20.0 g菱铁矿中FeCO3的质量为________ g。
(2)列式计算所用稀硫酸的溶质质量分数(结果精确到0.1%)。
第13题图
例 B 【解析】生石灰是氧化钙的俗称,氧化钙与水反应生成氢氧化钙,消耗了溶剂,则溶质会析出,A错误;等质量锌、铁与等质量分数的稀盐酸反应,产生氢气的质量铁大于锌,横坐标为稀盐酸,质量相等的酸提供的氢元素质量相等,则产生的氢气质量相等,因此斜率相同,B正确;三氧化二铁与CO在高温的条件下反应生成铁和二氧化碳,固体质量不可能为0,C错误;稀硫酸加入后立即产生硫酸钡沉淀,所以应从0点开始,D错误。
热点题型精练参考答案
1. A 【解析】氯酸钾制取氧气的化学方程式为2KClO3 2KCl+3O2↑,根据化学方程式可以看出MnO2是该反应的催化剂,反应前后质量不发生变化,C错误;由于氯酸钾要加热到一定的温度时才开始发生反应,产生O2,当完全反应时,KClO3中的氧全部转化为O2,O2的质量达到最大值,固体中氧元素的质量逐渐减小直至反应停止,反应结束后,固体中氧元素的质量只是MnO2中氧元素的质量,A正确、B错误;由于反应前后钾元素的质量没有发生变化,但固体总质量减小,所以钾元素的质量分数从反应开始到结束一直增大,反应结束后达到最大值,D错误。
方法指导:如何解答坐标曲线类试题?
解答此类试题时,首先要做到“五看”,一看坐标(横、纵坐标的含义)、二看起点(图像的起点)、三看拐点(图像的拐点及终点)、四看比例(看图像中横纵坐标的比例关系)、五看特征(看图像的走向,如上升还是下降等);其次把图像表示的意义与化学知识有效地结合起来,找出图像与相关化学知识的具体关系即可。
具体详情如下:
向盐酸中不断加水
起点a
a点pH<7,说明起始溶液显酸性
交点b
b点pH=7,随着溶液的稀释,溶液显中性
终点c
c点pH>7,溶液最终显碱性
稀释的过程中,酸性不会变为碱性,曲线只会无限接近pH=7这条直线,b、c点错误
2. D 【解析】c点的pH小于7,溶液显酸性,A错误;a点的pH大于7,溶液显碱性,溶液中的溶质是硫酸钠和氢氧化钠,B错误;由图像可知,pH是开始时大于7逐渐的减小到7然后小于7,可知原溶液显碱性,然后不断地加入酸性溶液,使pH减小,最后溶液显酸性,说明是把硫酸滴加到氢氧化钠溶液中,C错误;由a点到b点的pH的变化是从大于7逐渐的减小到等于7,可以说明酸和碱发生了中和反应,D正确。
3. D 【解析】
A
√
二氧化锰是过氧化氢分解反应的催化剂,反应前后二氧化锰的质量不变
B
√
固体物质的溶解度只与温度有关,温度一定时,溶解度不变
C
√
氯化银不溶于水,也不溶于酸,因此加入稀硝酸的过程中,氯化银质量不变
D
×
向饱和石灰水中加入生石灰,生石灰与溶液中的水反应生成氢氧化钙,由于饱和石灰水中的溶剂减少,导致一部分氢氧化钙固体析出,使原饱和溶液的质量减少
4. C 【解析】一定压强下,气体溶解度随温度的增大而减小,A错误;一定压强下,氢氧化钙的溶解度随温度的升高而降低,B错误;一定温度下,向水中加入硝酸钾,质量分数应该是从零开始,D错误。
5. B 【解析】根据金属活动性顺序表可知,锌的活动性大于铜,铜的活动性大于银。根据优先置换原则可知,锌先与硝酸银反应,再与硝酸铜反应。由图像可知,从一开始到b点是锌与硝酸银反应,b~c段表示锌与硝酸铜反应,c~d段表示锌有剩余。取a点溶液,由于溶液中含有未反应完的硝酸银,滴加稀盐酸,会产生白色沉淀,A错误;图标上b~c段表示锌与硝酸铜反应的过程,由于65份锌与硝酸铜反应生成了64份的铜,根据质量守恒定律,固体质量减小,则溶液质量增加,B正确;b点表示硝酸银全部反应完,硝酸铜即将开始反应,故溶液中含有的金属离子有锌离子和铜离子,金属单质有锌和银,C错误;c、d两点表示硝酸铜全部反应完,因此两点的溶液中只含有硝酸锌,金属单质含有锌、银、铜三种金属,D错误。
6. C 【解析】
A
×
电解水产生氢气和氧气的体积比为2∶1
B
×
根据质量守恒定律,反应前后锰元素的质量不变
C
√
由于铝片表面有未打磨的氧化铝,反应时盐酸先和氧化铝反应,氧化铝反应完后,再与铝反应产生氢气,直至铝片反应完
D
×
氧化钙与水反应放出大量的热,氢氧化钙的溶解度随温度的升高而减小,且氧化钙消耗了溶剂,因此溶质析出,溶质质量减小,氧化钙反应完全后随着溶液的冷却,温度降低,氢氧化钙溶解度增大,溶液中溶质质量增加,但是由于氧化钙和水反应消耗了一部分水,使得饱和氢氧化钙溶液中溶剂减少,最终溶液中溶质质量比变化前应减少
7. C 【解析】催化剂改变的是反应速率,不改变产物的质量,A正确;根据质量守恒定律,反应前后物质总质量相等,B正确;C图横坐标为金属质量,当加入等量的金属时,相对原子质量小的产生氢气多,铁产生氢气比锌多,当酸反应完后,产生氢气的质量将不再增加,图中锌与铁的曲线弄反了,C错误;酸碱盐之间发生反应时,氢氧化钠溶液先与稀盐酸发生中和反应,将盐酸反应完后再与氯化铜反应生成氢氧化铜沉淀,D正确。
8. A 【解析】根据题干信息“足量的镁和铁分别同时放入少量等质量、等质量分数的稀盐酸中”,可知酸没有剩余,即反应消耗的酸质量相等,根据质量守恒定律确定该反应生成的氢气质量相等;镁比铁活泼,则镁比铁反应速率快,A正确。其余选项解释如下:
9. A 【解析】NaOH的pH大于7,向氢氧化钠溶液中不断加水,NaOH的浓度减小,pH随之降低,但它仍然是碱,不会小于或等于7,只是pH越来越接近于7,A错误;氯酸钾和二氧化锰混合加热制取氧气,二氧化锰是催化剂,化学反应前后质量和化学性质均不变,B正确;在硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠,先中和硫酸,等硫酸完全反应后再与硫酸铜反应,也就是刚开始不能出现氢氧化铜沉淀,C正确;某温度下,向一定量接近饱和的硝酸钾溶液中加入硝酸钾固体,固体溶解,溶液质量增加,达到饱和状态后溶液质量不变,D正确。
10. (1)HCl和CaCl2 (2)产生气泡 (3)Na2CO3+CaCl2=== 2NaCl+CaCO3↓ (4)Na2CO3溶液显碱性(其他合理答案也可)
11. (1)① 0 4.4
②
(2)NaHCO3+HCl=== NaCl+H2O+CO2↑ (3)①18.25 0 ②36.5 4.4
12. 研究一:(1)放热 Mg+2HCl=== MgCl2+H2↑ (2)温度
研究二:(1)CuSO4+Fe=== FeSO4+Cu (2)B
【解析】研究一:(1)打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应放热,镁与盐酸反应会生成氢气和氯化镁,化学方程式为:Mg+2HCl=== MgCl2+H2↑。(2)通过图中的反应速率可以看出,在t1~t2时间段速率加快,所以化学反应速率受温度等因素影响;研究二:(1)铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:CuSO4+Fe=== FeSO4+Cu。(2)由金属活动性顺序可知,铁会先与硝酸银反应生成硝酸亚铁和银,然后再与硝酸铜反应生成硝酸亚铁和铜。刚开始铜的质量为零,置换完银才会置换出铜,A正确;硝酸铜的质量分数最后会减小到零,B错误;铁和硝酸银反应生成硝酸亚铁和银,每56份质量的铁会置换出216份质量的银,溶液质量减轻,铁和硝酸铜反应生成硝酸亚铁和铜,每56份质量的铁会置换出64份质量的铜,溶液质量也会减轻,但是没有前面减小的幅度大,C正确;铁刚与硝酸银反应生成硝酸亚铁和银,溶液中会出现银离子、亚铁离子、铜离子三种离子,然后会出现亚铁离子和铜离子,最后只剩下亚铁离子,D正确。
13. (1)11.6
(2)【信息梳理】
需要求的量
所用稀硫酸的溶质质量分数
分析或计
算公式
将(1)求得的20.0 g 菱铁矿中FeCO3的质量代入化学方程式FeCO3+H2SO4=== FeSO4+CO2↑+H2O中可计算出反应所消耗的硫酸的质量,再用求得的硫酸的质量除以反应完全时消耗的稀硫酸的总质量,即可求得所用稀硫酸的溶质质量分数
需要知
道的量
20.0 g 菱铁矿中FeCO3的质量、反应完全时消耗的稀硫酸的总质量
已知的量
(1)中求得20.0 g 菱铁矿中FeCO3的质量为11.6 g、反应完全时消耗的稀硫酸的总质量为50.0 g
解:设稀硫酸中溶质的质量为x
FeCO3+H2SO4=== FeSO4+CO2↑+H2O
116 98
11.6 g x
=
x=9.8 g
所用稀硫酸的溶质质量分数为×100%=19.6%
答:所用稀硫酸的溶质质量分数为19.6%。
【解析】(1)由图像的纵坐标,可以看出固体质量由20.0 g减少到8.4 g,杂质不参与反应也不溶于水,所以最后得到的8.4 g固体为杂质,则固体减少的质量为FeCO3的质量,即20.0 g-8.4 g=11.6 g。