- 37.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2016中考化学易错知识点整理
1. 在做“红磷燃烧测定氧气在空气中含量”的实验时,有时候水面上升不到1/5,其原因是①红磷的量不足②装置漏气③未冷却至室温就打开弹簧夹。
2. 过氧化氢无色液体 氯酸钾白色固体 氯化钾白色溶于水的固体 二氧化锰黑色不溶于水的固体 高锰酸钾暗紫色固体
3. 加热高锰酸钾制取氧气:
注意:①在靠近试管口 放一团棉花,防止加热时高锰酸钾粉末进入导管而堵塞导管;②反应结束后先把导管一出水面,在熄灭酒精灯,防止水倒流进试管,使试管炸裂。
4. 由原子直接构成的物质(它们的化学式直接用元素符号表示)①金属②固态非金属③稀有气体。
5. 元素是具有相同的核电荷数(即核内质子数)的一类原子的总称。因此元素的种类由质子数或核电荷数决定。元素只论种类,不论个数。
6. 在地壳中排在前四位的元素是氧元素、硅元素、铝元素、铁元素。在地壳中最多的金属元素和最多的非金属元素形成的化合物是氧化铝。
7. 常见原子团化合价:负一价硝酸根氢氧根 正一价铵根 正二价硫酸根碳酸根。
8. 在化合物中,正负化合价的代数和为零。在单质中,元素的化合价为0。
9. 反应物和生成物的总质量不变
化 六个 宏观 元素的种类不变
学 不变 元素的质量不变
反 原子数目不变
应 微观 原子的种类不变
前 原子的质量不变
后 两个 宏观:物质的种类一定变
变 一定变
化 微观:分子的种类一定变
一个可能变:分子的总数可能变
10. 在做水的净化过滤操作时,过滤后水仍浑浊的原因是①滤纸破损②液面高于滤纸边缘③仪器本身不干净。明矾的作用:吸附杂质使杂质沉降下来;活性炭的作用:吸附。
11. 氢气:密度比空气小,难溶于水;混有一定量空气或氧气的氢气遇明火。会爆炸。排水法。
氧气:密度比空气大,不易溶于水,支持燃烧。向上排空气法;排水法
二氧化碳:密度比空气大,能溶于水,不支持燃烧。向上排空气法。
一氧化碳:密度比空气略小,与空气相差不大,难溶于水,排水法。可燃性,有毒。
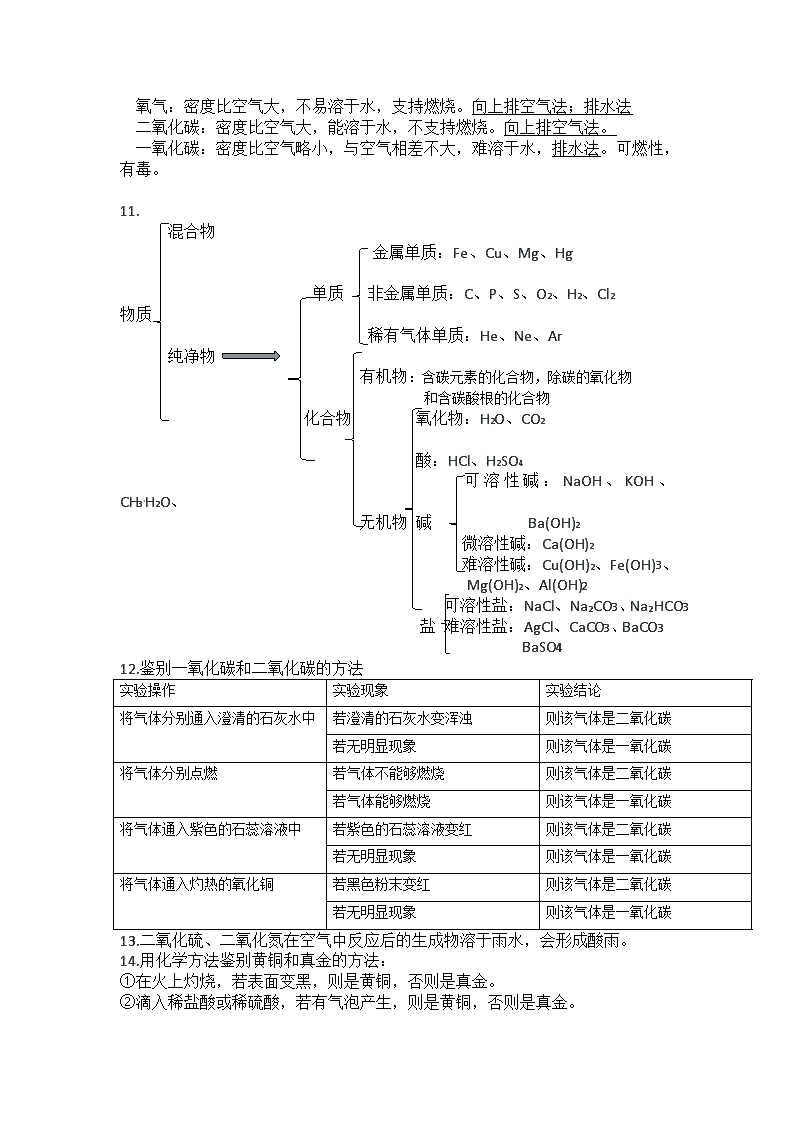
11.
混合物
金属单质:Fe、Cu、Mg、Hg
单质 非金属单质:C、P、S、O2、H2、Cl2
物质
稀有气体单质:He、Ne、Ar
纯净物
有机物:含碳元素的化合物,除碳的氧化物
和含碳酸根的化合物
化合物 氧化物:H2O、CO2
酸:HCl、H2SO4
可溶性碱:NaOH、KOH、CH3`H2O、
无机物 碱 Ba(OH)2
微溶性碱:Ca(OH)2
难溶性碱:Cu(OH)2、Fe(OH)3、
Mg(OH)2、Al(OH)2
可溶性盐:NaCl、Na2CO3、Na2HCO3
盐 难溶性盐:AgCl、CaCO3、BaCO3
BaSO4
12.鉴别一氧化碳和二氧化碳的方法
实验操作
实验现象
实验结论
将气体分别通入澄清的石灰水中
若澄清的石灰水变浑浊
则该气体是二氧化碳
若无明显现象
则该气体是一氧化碳
将气体分别点燃
若气体不能够燃烧
则该气体是二氧化碳
若气体能够燃烧
则该气体是一氧化碳
将气体通入紫色的石蕊溶液中
若紫色的石蕊溶液变红
则该气体是二氧化碳
若无明显现象
则该气体是一氧化碳
将气体通入灼热的氧化铜
若黑色粉末变红
则该气体是二氧化碳
若无明显现象
则该气体是一氧化碳
13. 二氧化硫、二氧化氮在空气中反应后的生成物溶于雨水,会形成酸雨。
14. 用化学方法鉴别黄铜和真金的方法:
①在火上灼烧,若表面变黑,则是黄铜,否则是真金。
②滴入稀盐酸或稀硫酸,若有气泡产生,则是黄铜,否则是真金。
③放入硝酸银溶液中,若表面有银白色物质析出,则是黄铜,否则是真金。
14. 一氧化碳还原氧化铁实验的注意事项:
一通:先通CO的目的是排进玻璃管内的空气,防止加热时爆炸
二点:点燃酒精灯加热
三灭:实验结束时先熄灭酒精灯
四停:冷却到室温时再停止通CO
五处理:尾气处理,防止污染空气
15. 等质量的金属铝、镁、铁、锌与稀盐酸或稀硫酸反应,产生氢气的质量由少到多的顺序是锌<铁<镁<铝。
16. 产生等质量的氢气需要铝、镁、铁、锌的质量由多到少的顺序是锌>铁>镁>铝。
17. 判断三种金属的活动性顺序的原则是:
(1) 金属与酸能否反应以及反应的剧烈程度
(2) ①先将三种金属按金属活动性顺序排好序②找中间金属③然后找中间金属的盐溶液和两边金属是单质或两边金属是盐溶液和中间金属是单质。
18. 金属跟混合盐溶液反应的次序:在金属活动性顺序表里,排在越后面的金属越易从它们的盐溶液里被置换出来。
19. 在溶液中的反应,求反应后溶液的质量时,可根据质量守恒定律得出:
反应后所得溶液质量=反应前所有物质的质量总和-难溶性杂质的质量-生成沉淀的质量-生成气体的质量。
说明:①反应前各物质包括参加反应的物质和难溶性杂志
②难溶性杂质是指反应前混有的、不溶于水的且不参加反应的物质。
20. 合金的硬度一般大于组成它们纯金属的硬度;合金的熔点一般比组成它们的纯金属的熔点低。
21. 生铁与钢的许多性能不同,主要是由于含碳量不同。
22. 铝耐腐蚀是因为铝与氧气反应时,其表面生成一层致密的氧化铝播磨,从而阻止了铝的进一步氧化;金耐腐蚀是因为金的化学性质不稳定,不与氧气反应。
23. C60是以单质形式存在的碳。
24. CO2与CO性质不同,H2O与H2O2性质不同的原因:分子的构成不同。
25. 向一个收集满CO2气体的塑料瓶中加入约1/3体积的水,立即旋紧瓶盖,震荡。现象:塑料瓶变瘪。分析:CO2能溶于水。引起塑料瓶内的气压变小,大气压压瘪了塑料瓶。
26. 能产生温室效应的气体:二氧化碳、臭氧、甲烷、氟氯代烷(氟利昂).
27. 制取CO2实验:
注意:①不能选用浓硫酸,因为浓硫酸易挥发产生HCl气体,导致得到的CO2不纯②不能选用稀硫酸,因为稀硫酸,因为稀硫酸与大理石(或石灰石)反应生成微溶于水的硫酸钙,会附着在大理石(或石灰石)的表面,阻碍此反应继续进行,不能连续、大量的制得CO2气体。③不能选用碳酸钠等纯净物的粉来代替石灰石,因为反应太剧烈,反应速率太快,产生的气体不便于收集。
28. 一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物叫做溶液。
小液滴分散到液体里形成的混合物叫做乳浊液。
固体小颗粒分散到液体里形成的不均一的、浑浊的混合物叫做悬浊液。
29. 在初中化学中,溶于水且明显放热的物质主要有三种:
①氢氧化钠 ②生石灰(氧化钙)③浓硫酸
18. ①溶解度曲线上方的点表示加入溶质后形成饱和溶液,但固体有剩余。
②溶解度曲线下方的点表示形成不饱和溶液。
19. 防止铁制品锈蚀的建议:①保证铁制品的洁净与干燥。②刷漆,涂油。
20. 保护金属资源的措施:①防止金属的锈蚀;②金属的回收利用;③计划、合理地开采矿物;④寻找金属的代替品。
21.
指示剂
酸性物质
碱性物质
中性物质
紫色石蕊溶液
变红
变蓝
不变色
无色酚酞溶液
不变色
变红
不变色
22. 盐酸:无色,液态。打开试剂瓶会有白雾冒出(浓盐酸易挥发,打开浓盐酸试剂瓶盖时,瓶口有一团白雾,因为浓盐酸会发出的HCl气体容于空气中的水蒸气,形成了盐酸小液滴。)有刺激性气味。
硫酸:无色,黏稠油状的液体,无白雾,无味,浓盐酸具有吸水性,可做中性酸性气体的干燥剂。
浓硫酸具有腐蚀性(碳化现象)脱水性(化学性质)。
23. 生石灰(氧化钙)溶于水能生成熟石灰(氢氧化钙)。
24. 鉴别氢氧化钠、氢氧化钙溶液:通入二氧化碳。
检验碳酸钙:加稀盐酸。
检验二氧化碳:通入澄清的石灰水。
去除二氧化碳:加氢氧化钠溶液。 ①没变质:氢氧化钠
25. 氢氧化钠固体不能敞口放置的原因: ②部分变质:氢氧化钠、
①吸水,易潮解②吸收二氧化碳,变质生成碳酸钠 碳酸钠
③全变质:碳酸钠
检验氢氧化钠是否变质:取氢氧化钠样品,滴加稀盐酸,若冒气泡,则证明变质。
26. 生成盐和水的反应,不一定是中和反应。但是中和反应,一定生成盐和水。
27. 生成盐和水的反应:
①酸与碱②酸与金属氧化物③碱与非金属氧化物
28. 含铜离子的溶液是蓝色的,含亚铁离子的溶液是浅绿色的,含铁离子的溶液是黄色的。
29. 碳酸钠(纯碱,苏打)溶液呈碱性。
氢氧化钠(火碱、烧碱、苛性钠)易潮解,具有吸水性,可作中性酸性气体的干燥剂。
氢氧化钙(熟石灰、消石灰)其溶解度随温度的升高而降低,微溶于水。
30. 检验碳酸根离子或碳酸氢根离子的方法:向试剂中加入稀盐酸,将生成的气体通入到澄清的石灰水中。
31. 氢氧化铝可治疗胃酸过多。氢氧化钙可改良酸性土壤。氢氧化镁可以除水垢。
32. 可做干燥剂的:浓硫酸、氢氧化钠、氧化钙、铁粉。
33. 沉淀:①白色沉淀:硫酸钡、碳酸钡、碳酸钙、氯化银、氢氧化镁②蓝色絮状沉淀:氢氧化铜③红棕色沉淀:氢氧化铁
34. 氮肥不能与碱性物质混合。
35. 物质 构成
构成 构成
分子 破裂 原子 得失电子 离子
构成
48.