- 760.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
近五年高考真题——化学反应原理
(2013年全国卷1)28.(15分)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量CO2)直接制备二甲醚,其中主要过程包括下列四个反应:
甲醇合成反应:
(i)CO(g)+2H2(g)=CH3OH(g) △H1=-90.1 kJ/mol
(ii)CO2(g)+3H2(g)=CH3OH(g)+H2O △H2=-40.9 kJ/mol
水煤气变换反应:
(iii)CO(g)+H2O(g)= CO2(g)+H2(g) △H3=-41.1 kJ/mol
二甲醚合成反应:
(iv)2CH3OH(g)= CH3OCH3(g)+H2O △H4=-24.5 kJ/mol
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂主要成分之一。工业上从铝土矿制备高纯度Al2O3的主要工艺流程是 。(用化学方程式表示)
(2)分析二甲醚合成反应(iv)对CO转化率的影响 。
(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。根据化学反应原理,增加压强对直接制备二甲醚的反应的影响 。
(4)有研究者在催化剂(含Cu-Zn-Al-O、Al2O3)、压强在5.0Mpa条件下,由H2和CO直接制备二甲醚,结果如右图所示。其中CO转化率随温度升高而降低的原因是 。
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为 。一个二甲醚分子经
过电化学氧化,可以产生 个电子的电量:该电池理论输出电压为1.20V,能量密度E= (列式计算,能量密度=电池输出电能/燃料质量)。
28.答案:(1)Al2O3+2NaOH+3H2O=2NaAl(OH)4
NaAl(OH)4+CO2=Al(OH)3+NaHCO3、2 Al(OH)3△
△
△
Al2O3+3H2O
(2)消耗甲醇,促进甲醇合成反应(i)平衡向右移,CO转化率增大:生成的水通过水煤气变换反应(iii)消耗部分CO。
(3)2CO(g)+4H2(g)=CH3OCH3(g)+H2O △H=-204.7 kJ/mol;该反应分子数减小,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加,压强升高使CO和H2浓度增大,反应速率加快。
(4)反应放热,温度升高,平衡左移。
(5)CH3OCH3+3H2O=2CO2+12H++12e-;12;
(2014年全国卷1)、27、(15 分)
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1) H3PO2是一元中强酸,写出其电离方程式: 。
(2) H3PO2及 NaH2PO2均可将溶液中的 Ag+还原为银,从而可用于化学镀银。
① H3PO2 中,磷元素的化合价为 。
②利用 H3PO22进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4:1,则氧化产
物为 (填化学式)。
③ NaH2PO2 为 (填“正盐”或“酸式盐”),其溶液显 (填“弱
酸性”、“中性”或“弱碱性”)
(3) H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成 PH3气体和 Ba(H2PO3) 2,后者再与 H2SO4反应。写出白磷与氢氧化钡溶液反应的化学方程式: 。
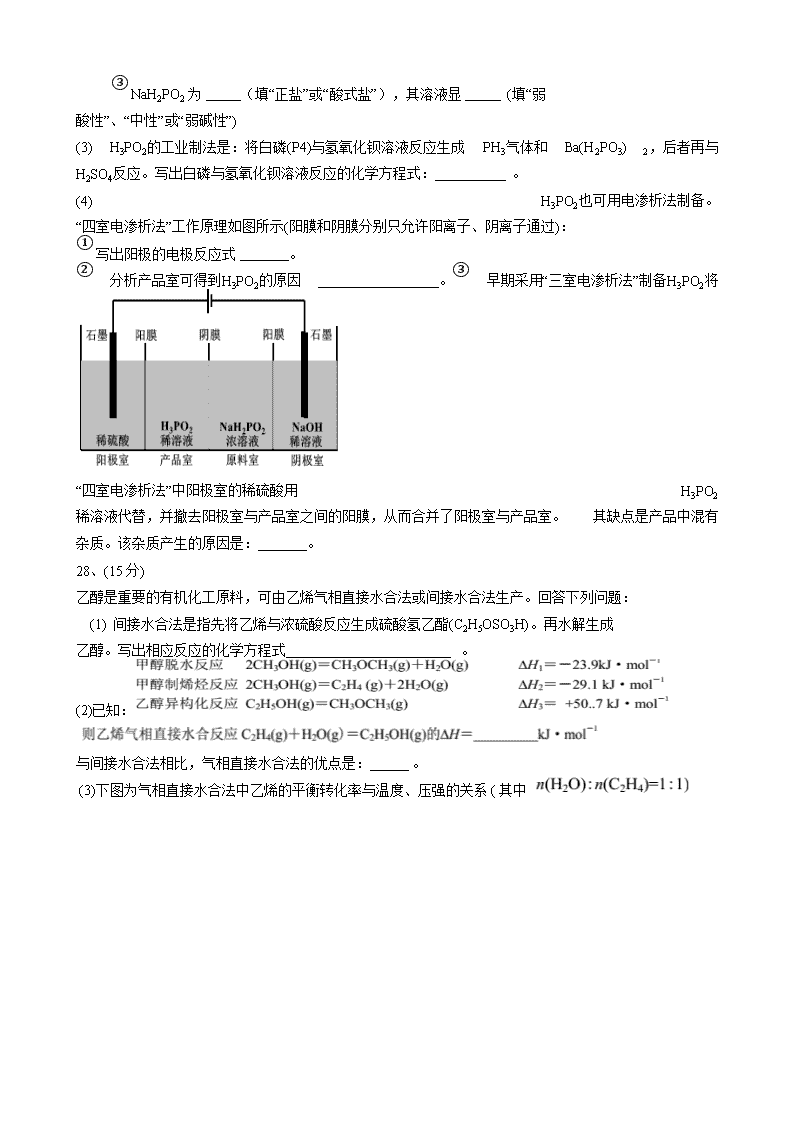
(4) H3PO2也可用电渗析法制备。 “四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
① 写出阳极的电极反应式 。
② 分析产品室可得到H3PO2的原因 。③ 早期采用“三室电渗析法”制备H3PO2将
“四室电渗析法”中阳极室的稀硫酸用 H3PO2 稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。 其缺点是产品中混有 杂质。该杂质产生的原因是: 。
28、(15 分)
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1) 间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成
乙醇。写出相应反应的化学方程式 。
(2)已知:
与间接水合法相比,气相直接水合法的优点是: 。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系 ( 其中
除了可以适当改变反应温度和压强外,还可以采取的措施有: 、
。
【27题答案】(15分)
(1)(2)+1 H3PO4 正盐 弱碱性
(3)
(4)
【28题答案】(15分)
(1)
(2) —45.5 污染小,腐蚀性小等
(3)①
(2015年全国卷1).28.(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛图。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) H2(g) + I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g)在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min
0
20
40
60
80
120
X(HI)
1
0.91
0.85
0.815
0.795
0.784
X(HI)
0
0.60
0.73
0.773
0.780
0.784
1根据上述实验结果,该反应的平衡常数K的计算式为:___________。
2上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正=0.0027min-1,在t=40,min时,v正=__________min-1
3由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)
28. (15分)
⑴MnSO4(或Mn2+) (1分) ⑵ 4.72×10-7 (2分) ⑶ 299 (2分)
⑷①K= (2分); ②k正/K;1.95×10-3 (每空2分,共4分)
③A、E (4分)
(2016年全国卷1)27、(15分)
元素铬()在溶液中主要以(蓝紫色)、(绿色)、(橙红色)、(黄色)等形式存在。为难溶于水的灰蓝色固体,回答下列问题:
(1)与的化学性质相似。在溶液中逐滴加入溶液直至过量,可观察到的现象是________________________________。
(2)和在溶液中可相互转化。室温下,初始浓度为的溶液中随的变化如图所示。
①用离子方程式表示溶液中的转化反应 。
②由图可知,溶液酸性增大,的平衡转化率_________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为___________。
③温度升高,溶液中的平衡转化率减小,则该反应的______0(填“大于”、“小于”或“等于”)。
(3)在化学分析中采用为指示剂,以,标准溶液滴定溶液中,利用与生成转红色沉淀,指示剂达滴定终点。当溶液中恰好沉淀完全(浓度等于)时,溶液中为__________,此时溶液中等于__________。(已知的分别为和)。
(4)价铬的化合物毒性较大,常用将废液中的还原成,该反应的离子方程式为______________________________________________________________。
27.(1)蓝紫色溶液变浅,同时生成灰蓝色沉淀,继续滴加NaOH溶液,沉淀溶解,最终溶液变绿色
(2)①②增大;;③小于
(3);
(4)
或:
(2017年全国卷1)28.(14分)
近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是 (填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为 、 ,制得等量H2所需能量较少的是 。
(3) H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g)+H2O(g)。在610K时,将
0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1= %,反应平衡常数K= 。
②在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2 a1,该反应的∆H 0。(填“>” “<” 或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是 (填标号)。
A.H2S B.CO2 C.COS D.N2