- 346.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
绝密★启用前
2017年普通高等学校招生全国统一考试(天津卷)
理科综合化学部分
理科综合共300分,考试用时150分钟。
化学试卷分为第Ⅰ卷(选择题)和第Ⅱ卷两部分,第Ⅰ卷1至2页,第Ⅱ卷3至6页,共100分。
答卷前,考生务必将自己的姓名、准考号填写在答题卡上,并在规定位置粘贴考试用条形码。答卷时,考生务必将答案涂写在答题卡上,答在试卷上的无效。考试结束后,将本试卷和答题卡一并交回。
祝各位考生考试顺利!
第Ⅰ卷
注意事项:
1.每题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
2.本卷共6题,每题6分,共36分。在每题给出的四个选项中,只有一项是最符合题目要求的。
1.下列有关水处理方法不正确的是
A.用石灰、碳酸钠等碱性物质处理废水中的酸
B.用可溶性的铝盐和铁盐处理水中的悬浮物
C.用氯气处理水中的Cu2+、Hg+等重金属离子
D.用烧碱处理含高浓度的废水并回收利用氨
2.汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
A.汉黄芩素的分子式为C16H13O5
B.该物质遇FeCl3溶液显色
C.1 mol该物质与溴水反应,最多消耗1 mol Br2
D.与足量H2发生加成反应后,该分子中官能团的种类减少1种
3.下列能量转化过程与氧化还原反应无关的是
A.硅太阳能电池工作时,光能转化成电能
B.锂离子电池放电时,化学能转化成电能
C.电解质溶液导电时,电能转化成化学能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
4.以下实验设计能达到实验目的的是
实验目的
实验设计
A.除去NaHCO3固体中的Na2CO3将固体加热至恒重
B.制备无水AlCl3 蒸发Al与稀盐酸反应后的溶液
C.重结晶提纯苯甲酸将粗品水溶、过滤、蒸发、结晶
D.鉴别NaBr和KI溶液分别加新制氯水后,用CCl4萃取
5.根据元素周期表和元素周期律,判断下列叙述不正确的是
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.图1所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族
6.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
绝密★启用前
2017年普通高等学校招生全国统一考试(天津卷)
理科综合化学部分
第Ⅱ卷
注意事项:
1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。
2.本卷共4题,共64分。
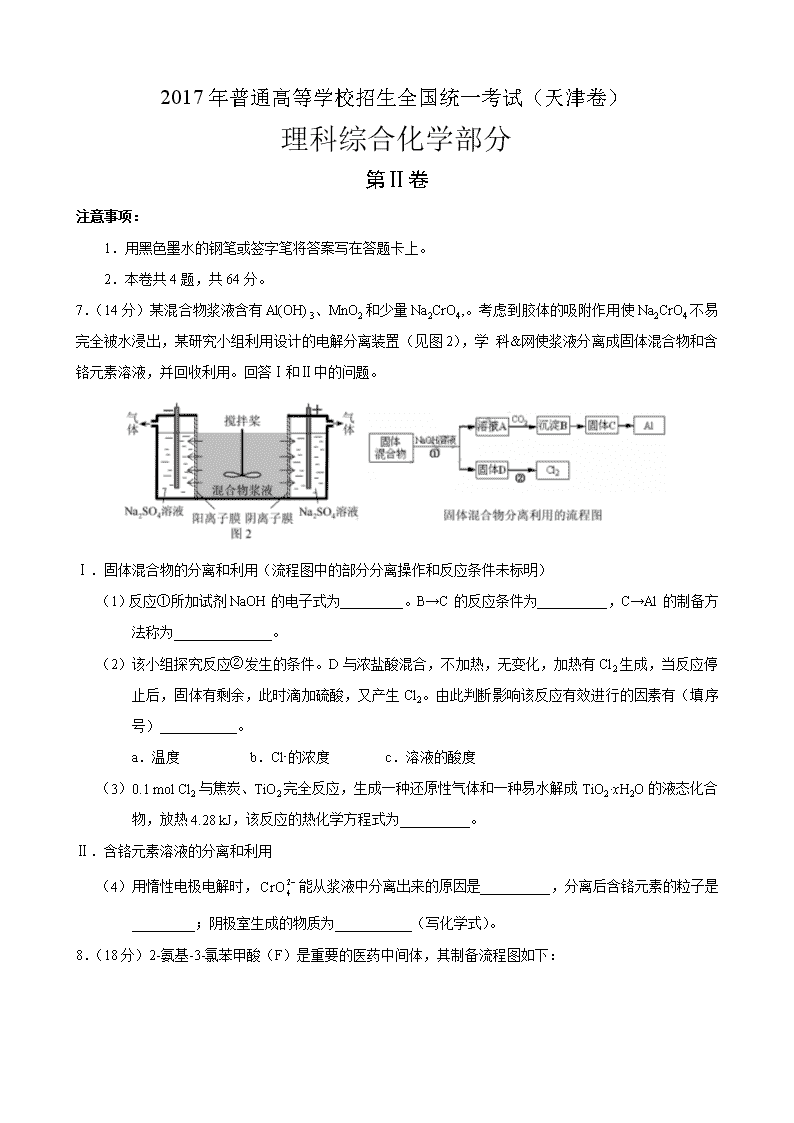
7.(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),学 科&网使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________。B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化,加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
8.(18分)2-氨基-3-氯苯甲酸(F)是重要的医药中间体,其制备流程图如下:
回答下列问题:
(1)分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_______。
(2)B的名称为_________。写出符合下列条件B的所有同分异构体的结构简式_______。
a.苯环上只有两个取代基且互为邻位 b.既能发生银镜反应又能发生水解反应
(3)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是______________。
(4)写出⑥的化学反应方程式:_________,该步反应的主要目的是____________。
(5)写出⑧的反应试剂和条件:_______________;F中含氧官能团的名称为__________。
(6)在方框中写出以为主要原料,经最少步骤制备含肽键聚合物的流程。
……目标化合物
9.(18分)用沉淀滴定法快速测定NaI等碘化物溶液中c(I−),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468 g(0.0250 mol)后,学&科网配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.1000 mol·L−1 NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.1000 mol·L−1 AgNO3溶液(过量),使I−完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000 mol·L−1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号
1
2
3
消耗NH4SCN标准溶液体积/mL
10.24
10.02
9.98
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有__________。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是___________________________。
(3)滴定应在pH<0.5的条件下进行,其原因是___________________________________。
(4)b和c两步操作是否可以颠倒________________,说明理由________________________。
(5)所消耗的NH4SCN标准溶液平均体积为_____mL,测得c(I-)=_________________mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,学|科网应进行的操作为________________________。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果_______________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果____________________。
10.(14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO42Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双减法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液Na2SO3
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+H2O (l) Ca(OH)2(s)Ca2+(aq)+2OH−(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH−)=_________________mol·L−1。将SO2通入该氨水中,当c(OH−)降至1.0×10−7 mol·L−1时,溶液中的c()/c()=___________________。
绝密★启用前
2017年普通高等学校招生全国统一考试(天津卷)
理科综合化学部分答案
Ⅰ卷共6题,每题6分,共36分。
1.C 2.B 3.A 4.D 5.C 6.B
Ⅱ卷共4题,共64分。
7.(14分)
(1)加热(或煅烧)电解法
(2)ac
(3)2Cl2(g)+TiO2(s)+2C(s)===TiCl4(l)+2CO(g) ΔH=−85.6kJ·mol−1
(4)在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液
和 NaOH和H2
8.(18分)
(1)4 13
(2)2-硝基甲苯或邻硝基甲苯
(3)避免苯环上甲基对位的氢原子被硝基取代(或减少副产物,或占位)
(4)保护甲基
(5)Cl2/FeCl3(或Cl2/Fe)羧基
(6)
9.(18分)
(1)250 mL(棕色)容量瓶、胶头滴管
(2)避免AgNO3见光分解
(3)防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解)
(4)否(或不能)
若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点
(5)10.00 0.0600
(6)用NH4SCN标准溶液进行润洗
(7)学&科网偏高偏高
10.(14分)
(1)降低反应活化能(或作催化剂)
(2)30 ℃、pH=2.0 蛋白质变性(或硫杆菌失去活性)
(3)H2SO4
(4)2OH-+SO2+H2O
与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成
(5)6.0×10-3 0.62