- 310.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题定时精练(十六) [专题十六 综合实验方案的设计与评价]
(时间:40分钟)
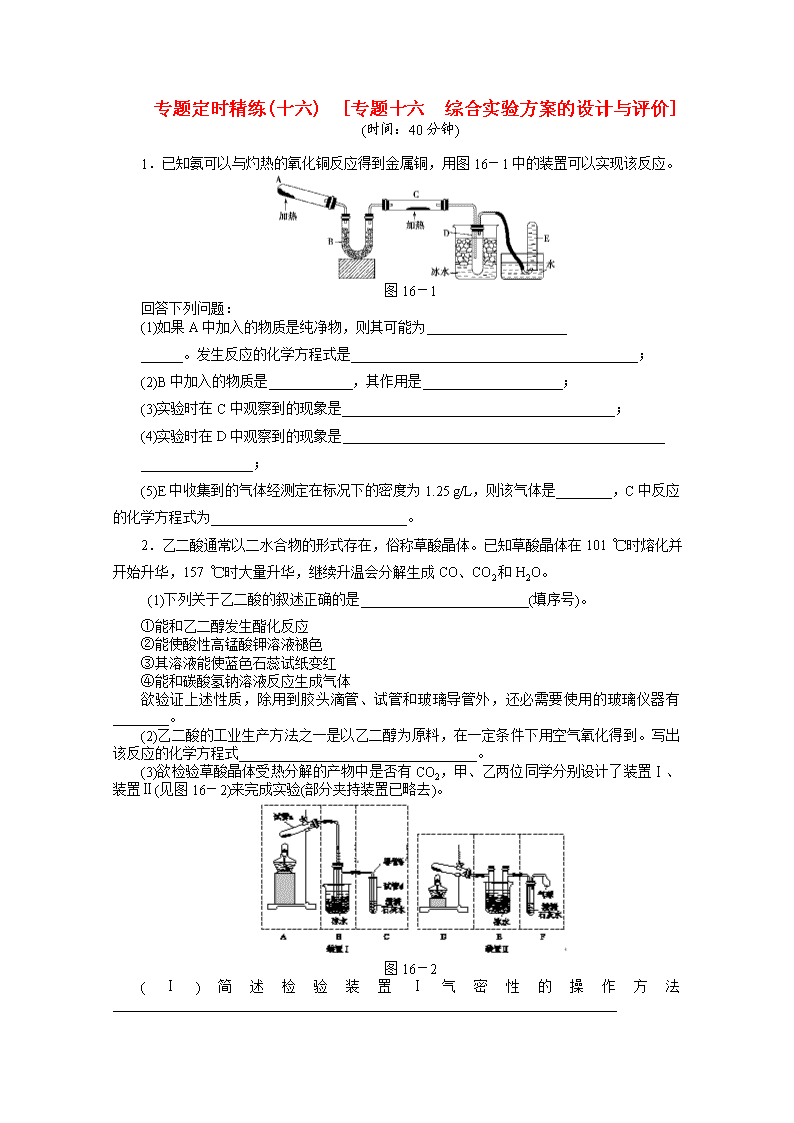
1.已知氨可以与灼热的氧化铜反应得到金属铜,用图16-1中的装置可以实现该反应。
图16-1
回答下列问题:
(1)如果A中加入的物质是纯净物,则其可能为____________________
______。发生反应的化学方程式是_________________________________________;
(2)B中加入的物质是____________,其作用是____________________;
(3)实验时在C中观察到的现象是_______________________________________;
(4)实验时在D中观察到的现象是______________________________________________
________________;
(5)E中收集到的气体经测定在标况下的密度为1.25 g/L,则该气体是________,C中反应的化学方程式为____________________________。
2.乙二酸通常以二水合物的形式存在,俗称草酸晶体。已知草酸晶体在101 ℃时熔化并开始升华,157 ℃时大量升华,继续升温会分解生成CO、CO2和H2O。
(1)下列关于乙二酸的叙述正确的是________________________(填序号)。
①能和乙二醇发生酯化反应
②能使酸性高锰酸钾溶液褪色
③其溶液能使蓝色石蕊试纸变红
④能和碳酸氢钠溶液反应生成气体
欲验证上述性质,除用到胶头滴管、试管和玻璃导管外,还必需要使用的玻璃仪器有________。
(2)乙二酸的工业生产方法之一是以乙二醇为原料,在一定条件下用空气氧化得到。写出该反应的化学方程式__________________________________。
(3)欲检验草酸晶体受热分解的产物中是否有CO2,甲、乙两位同学分别设计了装置Ⅰ、装置Ⅱ(见图16-2)来完成实验(部分夹持装置已略去)。
图16-2
(Ⅰ)简述检验装置Ⅰ气密性的操作方法________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(Ⅱ)B和E两个装置中更合理的是______,理由为________________________________________________________________________
________________________________________________________________________。
(Ⅲ)请从A~F中选择合适的仪器,组装一套可更好达到实验目的的装置,按照气流由左到右的顺序依次为(用字母表示):__________。
3.某化学学习小组对铝与酸和碱的反应进行探究,过程如下。
实验Ⅰ:
(1)取形状、大小均相同的铝丝分别与等体积的、pH相同的盐酸、稀硫酸反应,随反应进行,盐酸中生成气体的速率明显比硫酸中生成气体的速率快,对此原因,你认为合理的猜测是下列的________(填写相应的字母);
a.盐酸的物质的量浓度大于硫酸的物质的量浓度
b.Cl-能促进此反应的进行
c.SO能抑制此反应的进行
d.硫酸使铝发生钝化
(2)为了探究反应速率不同的原因,请你根据所提供的药品,填写实验方案中的空白部分。
药品:氯化钠固体、硫酸钠固体、硫酸铜固体、氯化铜固体、6 mol/L盐酸、3 mol/L硫酸、18.4 mol/L硫酸、5 mol/L硝酸。
方案:取两支试管,分别加入形状、大小均相同的铝丝和等体积的__________(填写相应的试剂,下同),再向其中的一支试管中加入适量的____________固体并振荡使固体溶解,观察实验现象。
实验探究:略。
实验Ⅱ:
取足量的形状、质量均相同的铝丝分别与等体积的6 mol/L的盐酸、6 mol/L氢氧化钠溶液反应,待反应停止后取出剩余的铝丝洗净、干燥、称量,剩余铝丝的质量关系是前者________后者(填“大于”或“小于”或“等于”);观察反应后的液体,发现铝与盐酸反应后所得的液体是黑色浑浊的,试管底部有少量黑色沉淀,对此现象,同学们进行了如下探究:
(1)提出猜想
同学们查找资料后获得如下信息:工业上用电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,所以得到的氧化铝中可能还含有微量的氧化铁和二氧化硅两种杂质,据此,同学们提出如下猜想:
猜想1:此黑色固体是铁单质,可能是电解得到的铝与杂质反应生成的,相应的化学反应方程式为____________________________________ ;
猜想2:此黑色固体是硅单质,是电解得到的铝与二氧化硅反应生成的;
猜想3:此黑色固体是铝单质,是铝与盐酸反应时因反应过快而变成粉末分散到溶液中;
猜想4:此黑色固体可能是上述若干种单质组成的混合物。
(2)设计实验方案并完成相关实验:
将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中,完成下列实验:
①向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解。实验时发现固体完全溶解,证明猜想________一定不正确(填“1”、“2”、“3”、“4”);
②向另一试管中加入足量的氢氧化钠溶液,观察固体是否溶解。实验时发现固体完全溶解,证明猜想________一定不正确(填“1”、“2”、“3”、“4”)。
(3)得出结论
综合实验①②的现象,可推知猜想________(填“1”、“2”、“3”、“4”)是正确的,固体溶解在氢氧化钠溶液中的离子方程式为________________________________________________________________________。
4.某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质。
(一)他们先把铜粉放在空气中灼烧,再与稀HNO3反应制取硝酸铜。
(1)如果直接用铜屑与稀HNO3反应来制取硝酸铜,可能导致的两个不利因素是________________________________________________________________________
________________________、________________________________________________________________________。
(2)实验中铜粉应该放在________(填“蒸发皿”、“坩埚”或“烧杯”)中灼烧。欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序分别是________、________、过滤。
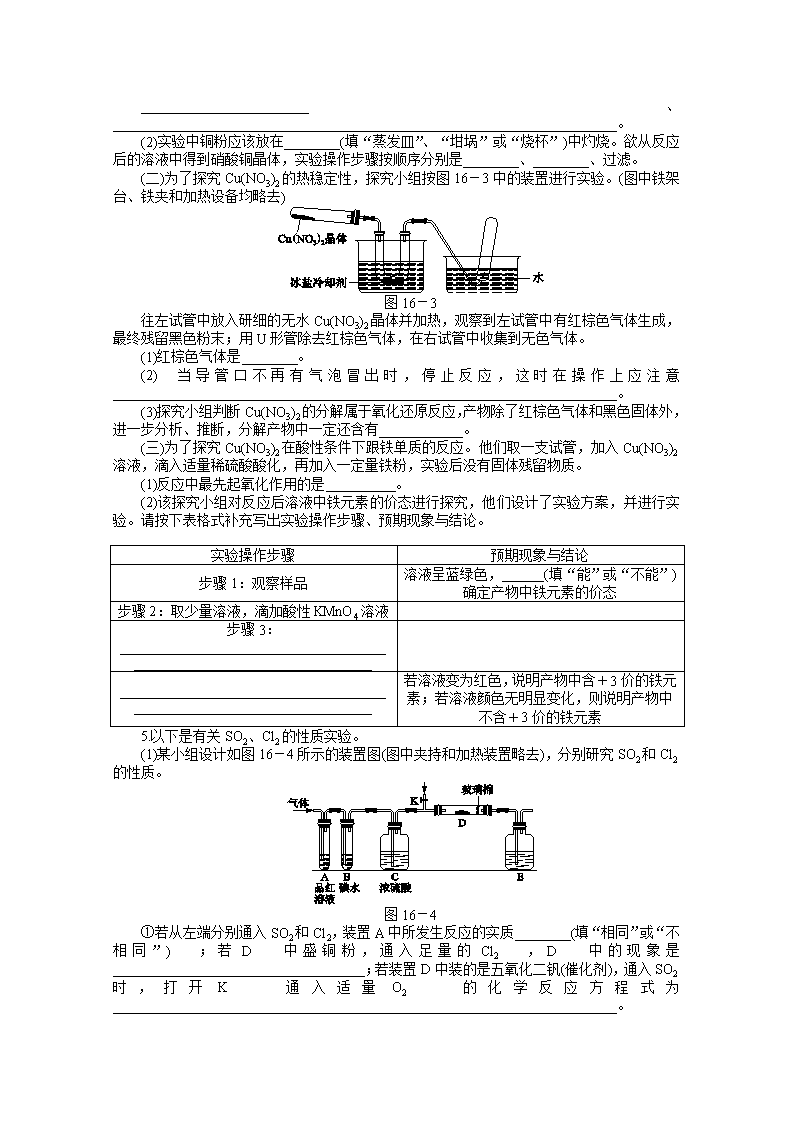
(二)为了探究Cu(NO3)2的热稳定性,探究小组按图16-3中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)
图16-3
往左试管中放入研细的无水Cu(NO3)2晶体并加热,观察到左试管中有红棕色气体生成,最终残留黑色粉末;用U形管除去红棕色气体,在右试管中收集到无色气体。
(1)红棕色气体是________。
(2)当导管口不再有气泡冒出时,停止反应,这时在操作上应注意________________________________________________________________________。
(3)探究小组判断Cu(NO3)2的分解属于氧化还原反应,产物除了红棕色气体和黑色固体外,进一步分析、推断,分解产物中一定还含有____________。
(三)为了探究Cu(NO3)2在酸性条件下跟铁单质的反应。他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质。
(1)反应中最先起氧化作用的是__________。
(2)该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验。请按下表格式补充写出实验操作步骤、预期现象与结论。
实验操作步骤
预期现象与结论
步骤1:观察样品
溶液呈蓝绿色,______(填“能”或“不能”)确定产物中铁元素的价态
步骤2:取少量溶液,滴加酸性KMnO4溶液
步骤3:________________________________________________________________________
________________________________________________________________________
若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素
5.以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图16-4所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
图16-4
①若从左端分别通入SO2和Cl2,装置A中所发生反应的实质________(填“相同”或“不相同”);若D中盛铜粉,通入足量的Cl2,D中的现象是____________________________________;若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为________________________________________________________________________。
②SO2通入B中,碘水褪色,则该反应的离子方程式为
________________________________________________________________________。
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)________,则可以看到白色沉淀产生。
A.氨水 B.稀盐酸
C.稀硝酸 D.氯化钙溶液
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,可得澄清溶液。取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式____________________________________;向含X的水溶液中加入稀硫酸时的现象是__________________________________。
专题定时精练(十六)
1.(1)碳酸氢铵或碳酸铵(其他答案合理也可)
NH4HCO3===NH3↑+CO2↑+H2O或
(NH4)2CO3===2NH3↑+CO2↑+H2O
(2)碱石灰或生石灰 除去二氧化碳和水蒸气
(3)黑色粉末逐渐变红
(4)出现无色液体,石蕊试纸变蓝
(5)N2 2NH3+3CuON2+3Cu+3H2O
【解析】 本题考查化学实验和有关化学方程式,注意化学实验现象的描述和试剂的选择。根据反应原理,反应物为氨气和氧化铜,可以判断试管A为制取氨气的装置,A中加入的物质是纯净物,则为创新的制法,其最可能为碳酸铵或碳酸氢铵(其他答案合理也可),不可能是氯化铵,因为它有类似“升华”现象,根本放不出氨气,氨气中的二氧化碳和水蒸气,要使用碱石灰除掉。加热后,黑色氧化铜变为红色的铜,生成的水和未反应的氨气生成氨水留在了D中,E中收集到的气体经测定在标况下的密度为1.25 g/L,相对分子分质量为28,证明该气体是氮气,通过排水法进行收集。
2.(1)①②③④ 酒精灯、玻璃棒(或:玻璃棒、酒精灯)
(2)+2O2+2H2O
(3)(Ⅰ)如图连接好装置,将导管b末端没入水中,微热(或手捂)试管a,看到导管口处有气泡冒出,撤火(或松手)后,观察到导管b末端有一段水柱上升,则说明该装置的气密性良好
(Ⅱ)E B中的导管过长,过细,冷凝后的乙二酸晶体可能会堵塞导管而存在安全隐患;E中采用U形管,与冰水的接触面积更大,更有利于乙二酸蒸气的冷凝,防止了乙二酸蒸气干扰CO2的检验
(Ⅲ)A、E、F
3.实验Ⅰ:(1)bc
(2)3 mol/L 硫酸 氯化钠(或6 mol/L 盐酸、硫酸钠)
实验Ⅱ:大于
(1)2Al+Fe2O32Fe+Al2O3
(2)①2 ②1
(3)3 2Al+2OH-+2H2O===2AlO+3H2↑
【解析】 实验Ⅰ:(1)两实验现象的差异原因应从反应物组成的不同点去寻找,此题中其他条件均相同,不同的是盐酸中含有Cl-而硫酸中含有SO,所以从这个方面思考即可得答案;
(2)根据控制变量法和对比实验法,在控制其他条件相同时,只让两实验中有一个变量不同。如:都用稀硫酸,但其中一份加入Cl-而另一份不加Cl-,即可得出结论(类似方法亦可)。
实验Ⅱ:由化学方程式可知,等物质的量的HCl与NaOH相比,NaOH消耗的铝更多,所以留下的铝就少,故“前者大于后者”;
(1)根据信息和有关物质的性质,可以看出黑色固体可能是铝、铁、硅三种单质中的一种或几种,从而提出猜想。猜想1中铁的生成是由于电解法时生成的铝能与氧化铁发生铝热反应,由此可写出相应的化学反应方程式;猜想2的化学反应方程式根据题意就可直接写出;
(2)①在盐酸中固体完全溶解,证明一定不含硅,所以猜想2一定不正确;
②在氢氧化钠溶液中固体完全溶解,证明一定不含铁,所以猜想1一定不正确;
(3)综合(1)(2)中相应的结论,可知此固体只含有铝,故猜想3正确,猜想4不正确,固体是铝,铝与氢氧化钠溶液反应的离子方程式为2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
【命题说明】本题取自于课堂实验和学生实验中观察到的现象,是学生经常询问老师的问题,对此司空见惯的现象进行研究很有必要。
实验Ⅰ主要考查学生在探究实验中分析和提出问题的能力,并学会用控制变量法和对比实验法设计简单的探究方案。
实验Ⅱ考查了化学方程式的简单计算、获取和运用信息的能力、提出问题和解决问题的能力、书写化学方程式的能力、综合分析的能力等。
本题以实验探究为主,新课程特征明显,但实质是实验方案的设计与评价。
4.(一)(1)生成等物质的量的硝酸铜,消耗硝酸原料多 产生污染物NO
(2)坩埚 蒸发浓缩 冷却结晶
(二)(1)NO2
(2)先把导气管移出水面,然后熄灭酒精灯火焰
(3)O2
(三)(1)HNO3(或H+和NO)
(2)不能 若KMnO4溶液的紫红色褪去或变浅,则说明产物中含+2价铁元素;若KMnO4溶液不褪色或不变浅,则说明产物中不含+2价铁元素 另取少量溶液,滴加KSCN溶液
【解析】 (一)(1)由反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O与3CuO+6HNO3(稀)===3Cu(NO3)2+3H2O相比,生成等物质的量的Cu(NO3)2前者消耗HNO3多,而且生成的NO污染空气。
(2)固体的灼烧应放在坩埚中进行;从溶液中得到硝酸铜晶体应先蒸发浓缩再冷却结晶,最后过滤。
(二)(1)Cu(NO3)2晶体加热产生的红棕色气体为NO2。
(2)当导管口不再有气泡冒出时,为了防止倒吸应先把导气管移出水面,然后再熄灭酒精灯。
(3)Cu(NO3)2分解生成NO2、CuO,根据电子得失守恒和质量守恒知,分解产物中还应该有O2。
(三)(1)Cu(NO3)2溶液中加入稀硫酸,溶液中有H+、NO,相当于有HNO3,能氧化铁粉。
(2)步骤1:Fe2+在溶液中为浅绿色,Fe3+在溶液中为棕黄色,而该溶液呈蓝绿色,因此不能确定产物中铁元素的价态;步骤2:酸性KMnO4溶液具有氧化性,能够氧化Fe2+,因此若KMnO4溶液的紫红色褪去或变浅说明产物中含+2价的铁元素,否则不含;步骤3:为检验溶液中是否含有+3价的铁元素,现象为溶液变为红色,因此用的试剂是KSCN溶液。
5.(1)①不相同 Cu粉红热,并产生棕黄色烟
2SO2+O22SO3
②SO2+I2+2H2O===4H++2I-+SO
(2)AC
(3)4Cl2+S2O+5H2O===2SO+8Cl-+10H+ 有黄色沉淀和刺激性气味的气体产生
【解析】 (1)①SO2使品红溶液褪色是因为发生了化合反应,生成不稳定的无色物质,加热后又会分解生成品红,溶液又会变为红色;Cl2使品红褪色是因为发生了氧化反应,品红被氧化后加热不会再变为红色;氯气与铜粉反应,产生棕黄色烟。SO2有较强的还原性,能被氧气、碘水氧化,反应方程式见答案。(2)SO2与氯化钡溶液不起反应,加入氨水后先生成亚硫酸铵,再生成亚硫酸钡沉淀;加入稀硝酸后,SO2会被氧化为硫酸,进而生成硫酸钡沉淀。(3)因为n(S)∶n(O)=∶=2∶3,可知X为S2O,它与氯气反应被氧化为硫酸,加入氯化钡后有硫酸钡沉淀生成;S2O与稀硫酸反应的离子方程式为S2O+2H+===S↓+SO2↑+H2O,所以观察到的现象是有黄色沉淀和刺激性气味的气体产生。