- 116.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
离子晶体
【模拟试题】(答题时间:30分钟)
1. 由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子
(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
A. 2︰1 B. 1︰1 C. 1︰2 D. 1︰3
2, 食盐晶体如右图所示。在晶体中,· 表示Na+,o 表示Cl-。已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是
A. cm B. cm C. cm D. cm
3. 下列物质中,含有共价键的离子晶体是
A. NaCl B. NaOH C. NH4Cl D. I2
4. 实现下列变化,需克服相同类型作用力的是
A. 石墨和干冰的熔化 B. 食盐和冰醋酸的熔化
C. 液溴和水的汽化 D. 纯碱和烧碱的熔化
5. 下列性质中,能较充分说明某晶体是离子晶体的是
A. 具有高的熔点 B. 固态不导电,水溶液能导电
C. 可溶于水 D. 固态不导电,熔化状态能导电
6. 下列叙述中正确的是
A. 离子晶体中肯定不含非极性共价键
B. 原子晶体的熔点肯定高于其他晶体
C. 由分子组成的物质其熔点一定较低
D. 原子晶体中除去极性共价键外不可能存在其他类型的化学键
7. 某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比为
A. 1:3:1 B. 2:3:1 C. 2:2:1 D. 1:3:3
8. 实现下列变化,需克服相同类型作用力的是
A. 碘和干冰升华 B. 二氧化硅和生石灰熔化
C. 氯化钠和铁熔化 D. 苯和乙烷蒸发
9. 下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是
A. SO2和SiO2 B. CO2和H2O C. NaCl和HCl D. CCl4和KCl
10. 如下图所示,是一种晶体的晶胞,该离子晶体的化学式为
5
A. ABC B. ABC3 C. AB2C3 D. AB3C3
11. 实现下列变化时,需克服相同类型作用力的是
A. 水晶和干冰的熔化 B. 食盐和冰醋酸的熔化
C. 液溴和液汞的汽化 D. 纯碱和烧碱的熔化
5
12. 2001年,日本科学家发现了便于应用、可把阻抗降为零的由硼和镁两种元素组成的超导材料。这是27年来首次更新了金属超导体的记录,是目前金属化合物超导体的最高温度。该化合物也因此被美国《科学》杂志评为2001年十大科技突破之一。图为该化合物的晶体结构单元示意图:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为
5
A. MgB B. MgB2 C. Mg2B D. Mg3B2
13. 如下图为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元.
(1)在该物质的晶体中,每个钛离子周围与它最接近的且等距离的钛离子共有
个。
(2)该晶体中,元素氧、钛、钙的个数比是 .
14. 1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。下列热化学方程中,能直接表示出氯化钠晶体晶格能的是 。
A. Na+(g)+Cl-(g) NaCl(s); △H
B. Na(s)+Cl2(g) NaCl(s); △H1
C. Na(s) Na(g); △H2
D. Na(g)-e- Na+(g); △H3
E. Cl2(g) Cl(g); △H4
F. Cl(g)+e- Cl-(g); △H5
15. NaCl晶体中Na+与Cl-都是等距离交错排列,若食盐的密度是2.2g/cm3,阿伏加德罗常数为6.02×1023mol-1,食盐的摩尔质量为58.5gmol。求食盐晶体中两个距离最近的钠离子中心间的距离是多少。
16. 晶态氯化钠是 晶体,晶体中,每个钠离子周围有 个氯离子,每个氯离子周围有 个钠离子,钠离子半径比氯离子半径 。在氯化物MCl中,M在第六周期,是钠的同族元素,该晶体中,每个阳离子周期有 个氯离子。钠的金属性比M 。氯化钠的电子式是 ,熔融后 导电(填“能”或“不能”)。Na+(或Cl-)周围的6个Cl- (或Na+)相邻的连线构成的面是什么样的多面体?
5
每个Na+(或Cl-)周围与之距离最近且距离相等的Na+(或Cl-)有几个?
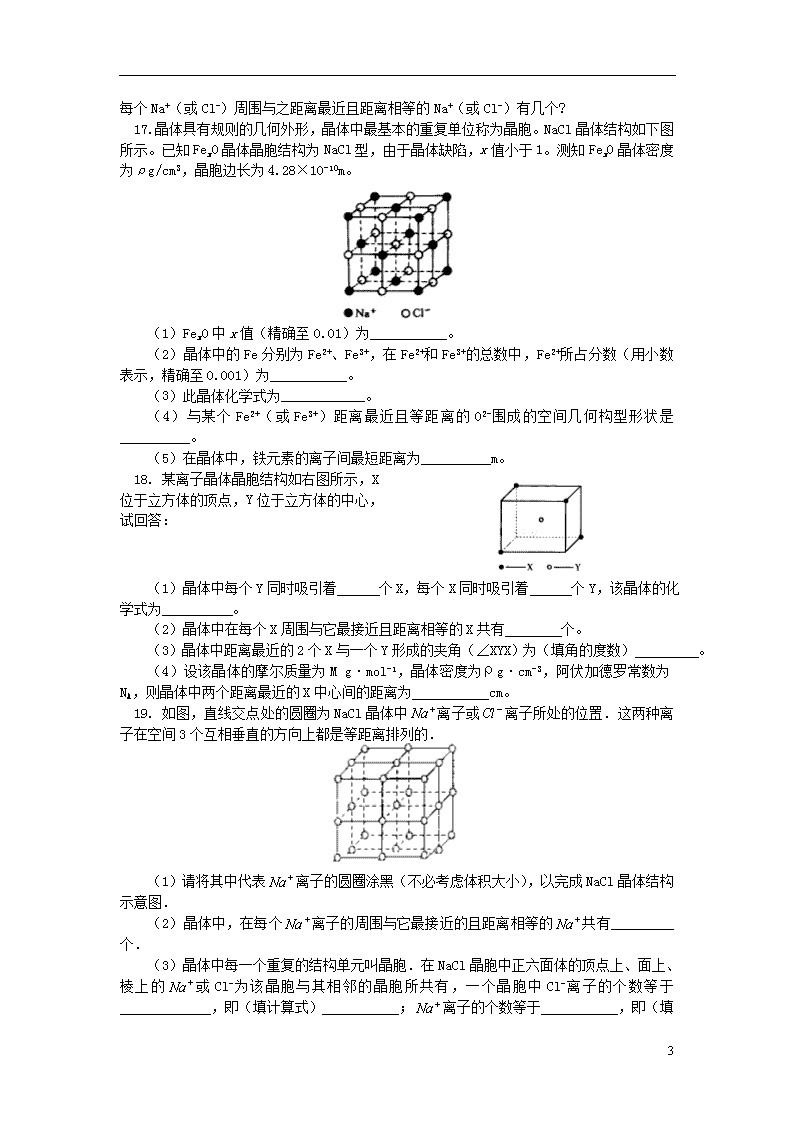
17. 晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。NaCl晶体结构如下图所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为ρg/cm3,晶胞边长为4.28×10-10m。
(1)FexO中x值(精确至0.01)为___________。
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为___________。
(3)此晶体化学式为____________。
(4)与某个Fe2+(或Fe3+)距离最近且等距离的O2-围成的空间几何构型形状是__________。
(5)在晶体中,铁元素的离子间最短距离为__________m。
5
18. 某离子晶体晶胞结构如右图所示,X位于立方体的顶点,Y位于立方体的中心,试回答:
5
(1)晶体中每个Y同时吸引着 个X,每个X同时吸引着 个Y,该晶体的化学式为 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有 个。
(3)晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为(填角的度数) 。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数为NA,则晶体中两个距离最近的X中心间的距离为 cm。
19. 如图,直线交点处的圆圈为NaCl晶体中离子或离子所处的位置.这两种离子在空间3个互相垂直的方向上都是等距离排列的.
(1)请将其中代表离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图.
(2)晶体中,在每个离子的周围与它最接近的且距离相等的共有_________个.
(3)晶体中每一个重复的结构单元叫晶胞.在NaCl晶胞中正六面体的顶点上、面上、棱上的或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-离子的个数等于_____________,即(填计算式)___________;
5
离子的个数等于___________,即(填计算式)___________.
(4)设NaCl的摩尔质量为,食盐晶体的密度为,阿伏加德罗常数为.食盐晶体中两个距离最近的钠离子中心间的距离为___________cm.
【试题答案】
1. C 2. B 3. BC 4. CD 5. D 6. D 7. A 8. AD 9. B 10. B
11. D 12. B
13. 解析:从所给模型图中可看出每个钛离子的上下前后和左右各有一个最接近且等距离的钛离子.又可看出钙原子位于立方体体心,为该立方体单独占有,钛原子位于立方体顶点属于8个立方体共有,所以每个立方体拥有Ti原子为8×=1个,氧原子位于立方体的棱边为四个立方体所共有,所以每个立方体拥有O原子为12×=3个.
答案:(1)6 (2)3∶1∶1
14. A
15. 解析:从上述NaCl晶体结构模型中分割出一个小立方体,如图所示,其中a代表其边长,b代表两个Na+中心间的距离。由此小立方体不难想象出顶点上的每个离子均为8个小立方体所共有。因此小立方体含Na+:4×1/8=1/2,含 Cl-:4×1/8=1/2,即每个小立方体含有1/2个(Na+——Cl-)离子对,故:每个小立方体的质量
m=×,
ρ===2.2g/cm3,
解得 a=2.81×10-8cm.
两个距离最近的Na+中心间的距离d=a=4.0×10-8cm。
16. 离子66 小 8 弱 能 八面体 12个
17. (1)0.92 (2)0.826 (3) (4)正八面体 (5)3.03×10-10
18.(1)4;8;XY2或Y2X;(2)12;(3)109°28′(提示:4个X原子位于正四面体的四个顶点上,Y原子位于该正四面体的中心)(4)(提示:每个晶体中含个X和1个Y,则1mol XY2中含有2NA个晶胞,故每个晶胞的边长为 ,距离最近的两个
5
X位于面对角线上,据勾股定理可求出其距离)。
19. (1)略(提示:与Cl-交替排列) (2)12 (3)4,;4,
(4)
提示:根据,其中m即为4个——离子对的质量:,V为所示晶体的体积,可设其边长为a,则.可求出a,进而求出题设所问.即两个距离最近的钠离子中心间的距离为.
5