- 653.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2016学年度上海高考化学作业卷(从实验走进化学)
可能用到的相对原子质量:H~1 O~16 S~32 N~14 Cl~35.5 C~12 Na~23 Al~27 K~39 He~4 P~31 Cu~64 Ba~137 Ca
~40 Cu~64 Mg~24
一 、选择题(本大题共15小题,在每小题给出的四个选项中,只有一个选项是符合题目要求的)
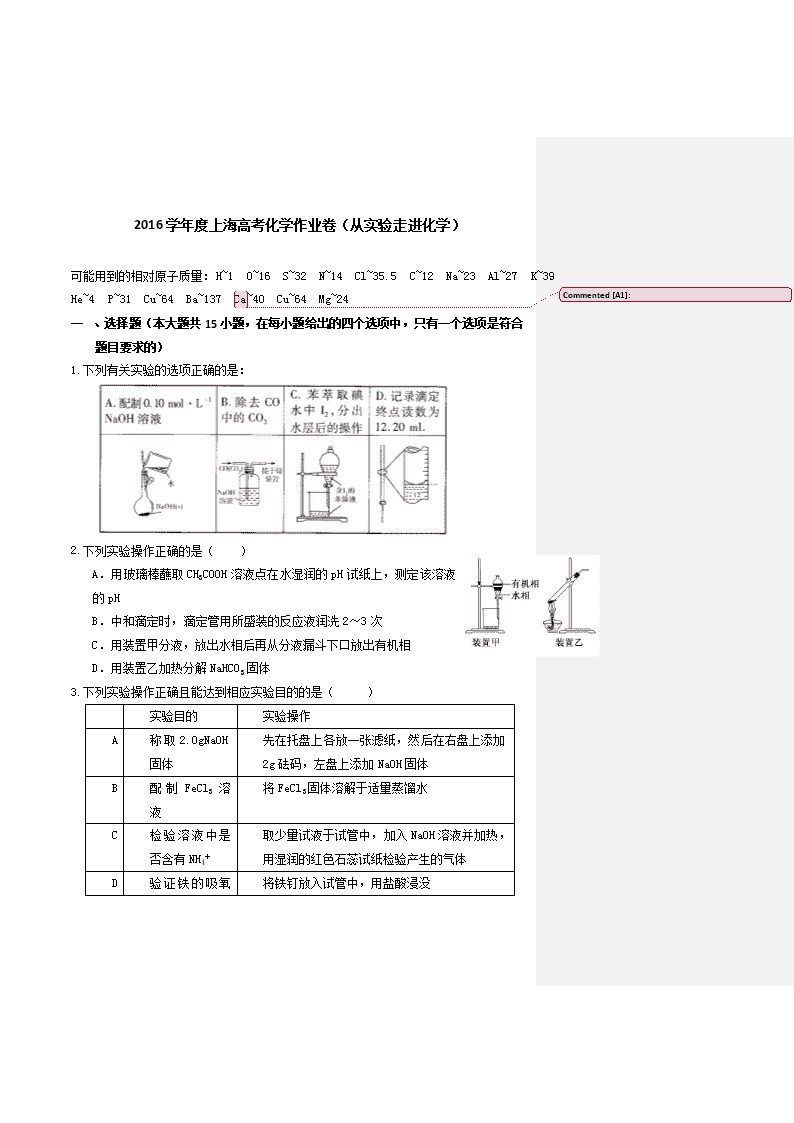
下列有关实验的选项正确的是:
下列实验操作正确的是( )
A.用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH
B.中和滴定时,滴定管用所盛装的反应液润洗2~3次
C.用装置甲分液,放出水相后再从分液漏斗下口放出有机相
D.用装置乙加热分解NaHCO3固体
下列实验操作正确且能达到相应实验目的的是( )
实验目的
实验操作
A
称取2.0gNaOH固体
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体
B
配制FeCl3溶液
将FeCl3固体溶解于适量蒸馏水
C
检验溶液中是否含有NH4+
取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
D
将铁钉放入试管中,用盐酸浸没
验证铁的吸氧腐蚀
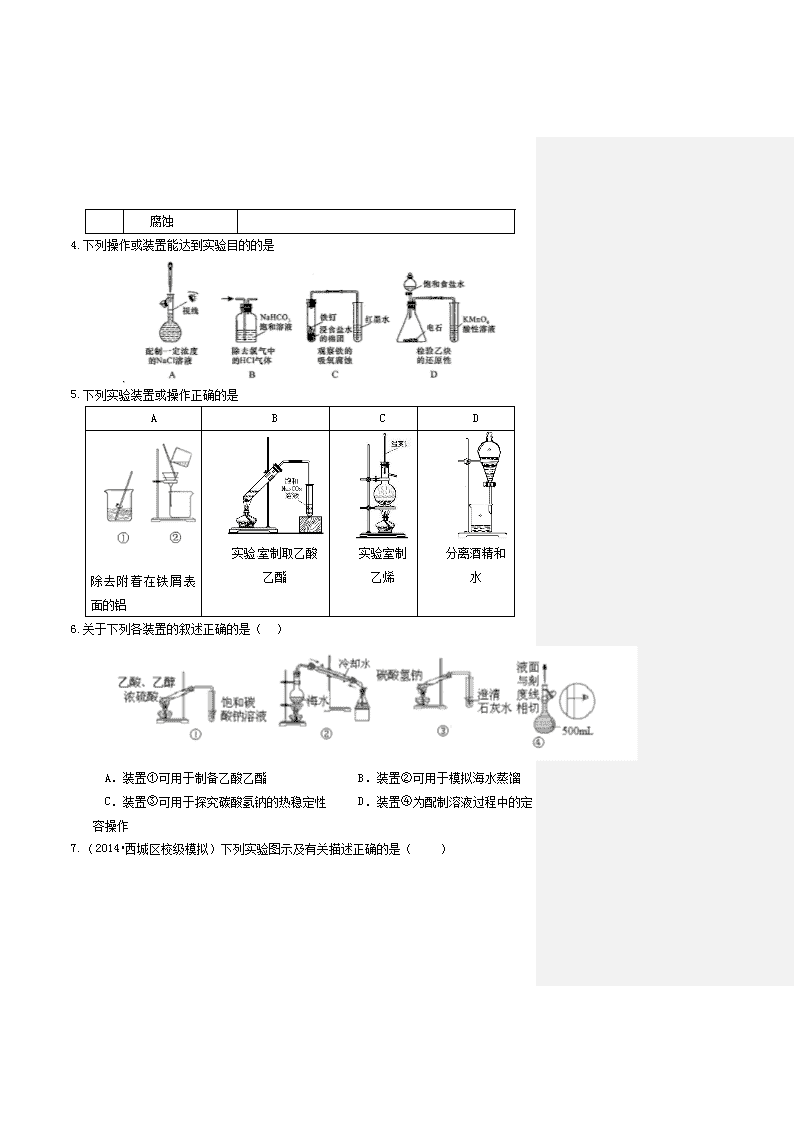
下列操作或装置能达到实验目的的是
下列实验装置或操作正确的是
A
B
C
D
除去附着在铁屑表面的铝
实验室制取乙酸乙酯
实验室制乙烯
分离酒精和水
关于下列各装置的叙述正确的是( )
A.装置①可用于制备乙酸乙酯 B.装置②可用于模拟海水蒸馏
C.装置③可用于探究碳酸氢钠的热稳定性 D.装置④为配制溶液过程中的定容操作
(2014•西城区校级模拟)下列实验图示及有关描述正确的是( )
(2015•永州三模)下列有关仪器使用方法或实验操作说法正确的是()
A.
用湿润的pH试纸测定溶液的pH,测定结果偏小
B.
石蕊、酚酞等酸碱指示剂均可用作中和滴定的指示剂
C.
托盘天平称量药品时,都应垫上滤纸称量
D.
滴定管以及容量瓶在使用前需检查是否漏水
某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广范pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
下列说法错误的是
A.除去NaHCO3溶液中混有的Na2CO3,可向溶液中通入足量CO2
B.向新制氯水中加入CaCO3可使溶液中HClO浓度增大
C.制备Fe(OH)2时将吸有NaOH溶液的长滴管伸到FeSO4溶液底部再挤出NaOH溶液
D.为配制450 mL 0.1 mol/L NaOH溶液,需称取1.8 g NaOH固体,应放在纸上称取
下列有关实验操作和说法正确的是
A、用pH试纸检验气体的酸碱性时,一定要先用蒸馏水润湿
B、润洗滴定管:从滴定管上口加入所要盛装的酸或碱溶液至“0”刻线,再将液体从滴定管下部放出,重复操作2~3次
C、用瓷坩埚加热熔化碳酸钠固体
D、Mg和Al分别为电极,插入NaOH溶液中,构成原电池,探究Mg、Al的活泼性
.下列有关托盘天平的使用的叙述不正确的是( )
A.称量前先调节托盘天平的零点
B.潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
C.用托盘天平只能称量至0.1g
D.称量时左盘放被称量物,右盘放砝码
.观察右图,若用1 L水来代表地球上的总水量,要比较精确地量取地球上的淡水量,应选择的仪器是 ( )
A.100 mL烧杯 B.50 mL烧杯
C.100 mL量筒 D.50 mL量筒
下列实验装置或操作正确的是
A
B
C
D
向容量瓶中转移液体
实验室制取蒸馏水
从饱和食盐水中提取NaCl晶体
分离酒精和水
下列各图所示装置的气密性检查中,漏气的是( )
A.
对装置①,双手移去后,导管中水面高于烧杯内水面
B.
对装置②,长颈漏斗内液面高度保持不变
C.
对装置③,长导管内形成一段水柱
D.
对装置④,上下移动a管后,a、b两端液面仍相平
一 、填空(本大题共3小题)
(2015重庆高考真题)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过题图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
(1)仪器D的名称是 。安装F中导管时,应选用题图2中的 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 ,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
(5)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如题图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。
(1)玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是 。(填写编号)
①粗盐提纯
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)实验室欲配置450mL 0.25mol·L-1 NaOH溶液:
①配制时除需用胶头滴管、托盘天平(带砝码)、玻璃棒、药匙外,还必需用到的仪器是 。
②通过计算,应用托盘天平称取 NaOH
固体,若将物码放反,则所配制溶液物质的量浓度 。(填“偏大”、“偏小”或“不变”)
③定容时,仰视液面,则所配溶液物质的量浓度 。(填“偏大”、“偏小”或“不变”)
(10分) 人体血液里Ca2+离子的浓度一般采用g/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
【配制KMnO4标准溶液】下图是配制50mLKMnO4标准溶液的过程示意图。
(1)上述过程中有两处错误,请你观察图示判断其中不正确的操作是(填序号)____________;
(2)其中确定50mL溶液体积的容器是(填名称)__________________;如果按照图示的操作配制溶液,所得的实验结果将____________(填偏大或偏小)。
【测定血液样品中Ca2+的浓度】抽取血样20.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)滴定时,盛放高锰酸钾溶液的仪器名称为 ,确定反应达到终点的现象_____________________________。
(4)草酸跟酸性KMnO4溶液反应的离子方程式为: 。
(5)根据所给数据计算血液样品中Ca2+离子的浓度为________mg/cm3。
2016万卷作业卷(从实验走进化学)答案解析
一 、选择题
答案:B
【解析】A项,容量瓶不能用来做溶解容器,错误;B项,通入氢氧化钠溶液,只有CO2能反应,干燥后可以得到纯净的CO,正确;C项,苯的密度小在上层,而分液时下层从下口流出。上层液体从上口倒出,错误;D项,酸式滴定管的0刻度在上方,故读数为:11.80mL,错误。
【答案】B命题透析 本题考查化学实验基本操作以及物质的分离。
思路点拨 在测定溶液pH时,pH试纸不能用水湿润,A项错误;中和滴定实验中,滴定管必须要润洗次,B项正确;分液操作中,下层液体从下口放出,上层液体从上口倒出,C项错误;受热分解产生,会引起试管炸裂,试管口应稍向下倾斜,D项错误。
【答案】C
【解析】A夭平的使用原则是左物右码,而且NaOH有腐蚀性,不能在天平上直接称量,应该在烧杯等仪器中称量,错误.B.FeCI3是强酸弱碱盐,Fe3+泼生水解反应是溶液显浑浊,所以配制FeCI3溶液时,应该将FeCI3固体;容解于适量的盐酸中,然后再加水稀释,错误.C.检验;容液中是否含有NH4+ 的方法是取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变为蓝色,就证明产生了NH3,原溶液中含有NH4+,正确.D要验证铁的吸氧腐蚀,应该将铁钉放入试管中,用食盐水浸没,而不能使用酸性物质,否则发生的是析氢腐蚀,错误.
【答案】C
【解析】A、视线应平视,俯视使浓度偏大;B、氯气要和饱和碳酸氢钠反应,应用饱
盐水;D、电石产生的气体中混有H2S等杂质气体也能使酸性高锰酸钾溶液褪色。选C。
【答案】A
【答案】D
【解析】本题考查化学实验基本操作。
制乙酸乙酯时右边的导管口不伸入液面以下,防止发生倒吸,A错误;蒸馏时,冷凝水流向为“下口进、上口出”,B错误;加热碳酸氢钠固体,管口应略向下倾斜,C错误。
分析:
A.在阴极得到氢气,不能得到铝;
B.缺少除杂装置,乙醇也能能使酸性高锰酸钾溶液褪色;
C.可用铝热法冶炼锰;
D.氯气应用向上排空气法收集.
解答:
解:A.在阴极得到氢气,不能得到铝,故A错误;
B.乙醇易挥发,乙醇也能能使酸性高锰酸钾溶液褪色,不能确定是否生成乙烯,故B错误;
C.铝比锰活泼,可用铝热法冶炼锰,故C正确;
D.氯气密度比空气大,氯气应用向上排空气法收集,故D错误.
故选C.
点评:
本题考查较为综合,题目难度中等,本题易错点为A,注意氢离子氧化性大于铝离子.
分析:
A.湿润的pH试纸测定溶液的pH,不一定有误差;
B.石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂;
C.称量NaOH放在小烧杯中;
D.具有活塞或塞子的仪器使用前需要检查是否漏水.
解答:
解:A.湿润的pH试纸测定溶液的pH,不一定有误差,如测定NaCl溶液的pH无影响,故A错误;
B.石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂,可选酚酞、甲基橙等酸碱指示剂均可用作中和滴定的指示剂,故B错误;
C.称量NaOH固体应放在小烧杯中,不具有吸水性、腐蚀性的药品可垫上滤纸称量,故C错误;
D.滴定管以及容量瓶均有塞子,所以在使用前需检查是否漏水,故D正确;
故选D.
点评:
本题考查化学实验方案的评价,为高频考点,涉及pH的测定、酸碱指示剂的使用、固体称量及仪器的使用等,把握物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.
【答案】D
【答案】D
【答案】A
【答案】B
【答案】D
【答案】A
分析:
装置气密性检验有多种方法,原理都是根据装置内外的压强差形成水柱或气泡,据此分析各种检查方法.
解答:
A.双手移去后,导管中水面高于烧杯内水面,说明不漏气,故A错误;
B.用弹簧夹夹住右边导管,向长颈漏斗中倒水,液面高度不变,说明装置气密性良好不漏气,故B错误;
C.用弹簧夹夹住右边导管,双手捂住烧瓶,烧瓶内气体受热膨胀,使集气瓶中气体压强增大,在玻璃管中形成一段水柱,说明装置气密性良好不漏气,故C错误;
D.上下移动a管后,a、b两端液面仍相平,说明装置漏气,故D正确.
故选D.
点评:
本题考查装置气密性的检查,装置气密性检验原理都是依据密闭装置中气体存在压强差,形成水柱或气泡的现象进行判断是解答本题的关键,该题易错点是D选项的判别,题目难度不大.
一 、填空、实验、简答题
【答案】(15分)
(1)锥形瓶 b (2)慢 (3)吸收Cl2
(4)4H++5ClO2-=Cl-+4ClO2↑+2H2O 验证是否有ClO2 生成
(5)稳定剂Ⅱ,稳定剂Ⅱ可以缓慢释放ClO2 ,能较长时间维持保鲜所需的浓度
【解析】(1)D为锥形瓶,F作为检验装置,应当长进短出。
(2)降低滴加稀盐酸的速度可减慢反应速率。
(3)装置C用于吸收A中产生的氯气,否则氯气会进入F中出现蓝色干扰实验。
(4) ClO2-在酸性条件下,发生歧化反应生成Cl-和ClO2;ClO2具有强氧化性能氧化I-为I2,可通过溶液是否变为蓝色来判断是否有ClO2生成。
(5)从图像中起保鲜作用的最低浓度与天数不难选择稳定剂Ⅱ。
(1)③ ⑤ (2分)
(2)①500ml容量瓶 小烧杯(2分) ②5.0g 不变 (2分) ③ 偏小(1分)
解:(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切,
故答案为:②⑤;
(2)应该用容量瓶准确确定50mL溶液的体积,故答案为:容量瓶;
如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小,故答案为:偏小;
(3)酸式滴定管 溶液由无色变为紫红色
(4) 2MnO4―+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(5)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:
0.020mol/L×0.012L=2.4×mol,
根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,
可知:n(Ca2+)=n(H2C2O4)=n(MnO4-)=2.5×2.4×mol=6
mol,Ca2+的质量为:40g/mol×6×mol=0.024g,
钙离子的浓度为:=1.2 mg/cm3,
故答案为:1.2.