- 236.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
速练16 溶液中“粒子浓度”关系判断
1.室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )
A.a点所示溶液中:c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中:c(A-)>c(HA)
答案 D
解析 A项,a点NaOH与HA恰好完全反应,溶液的pH为8.7,呈碱性,说明HA为弱酸,NaA发生了水解反应,则溶液中:c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),错误;B项,a点NaA发生了水解反应,促进了水的电离,b点主要由于HA的电离而使溶液呈酸性,抑制了水的电离,所以a点水的电离程度大于b点水的电离程度,错误;C项,根据电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),pH=7,则c(H+)=c(OH-),可得c(Na+)=c(A-),错误;D项,b点溶液中溶质为等物质的量的NaA和HA,溶液呈酸性,说明HA的电离程度大于NaA的水解程度,所以c(A-)>c(HA),正确。
5
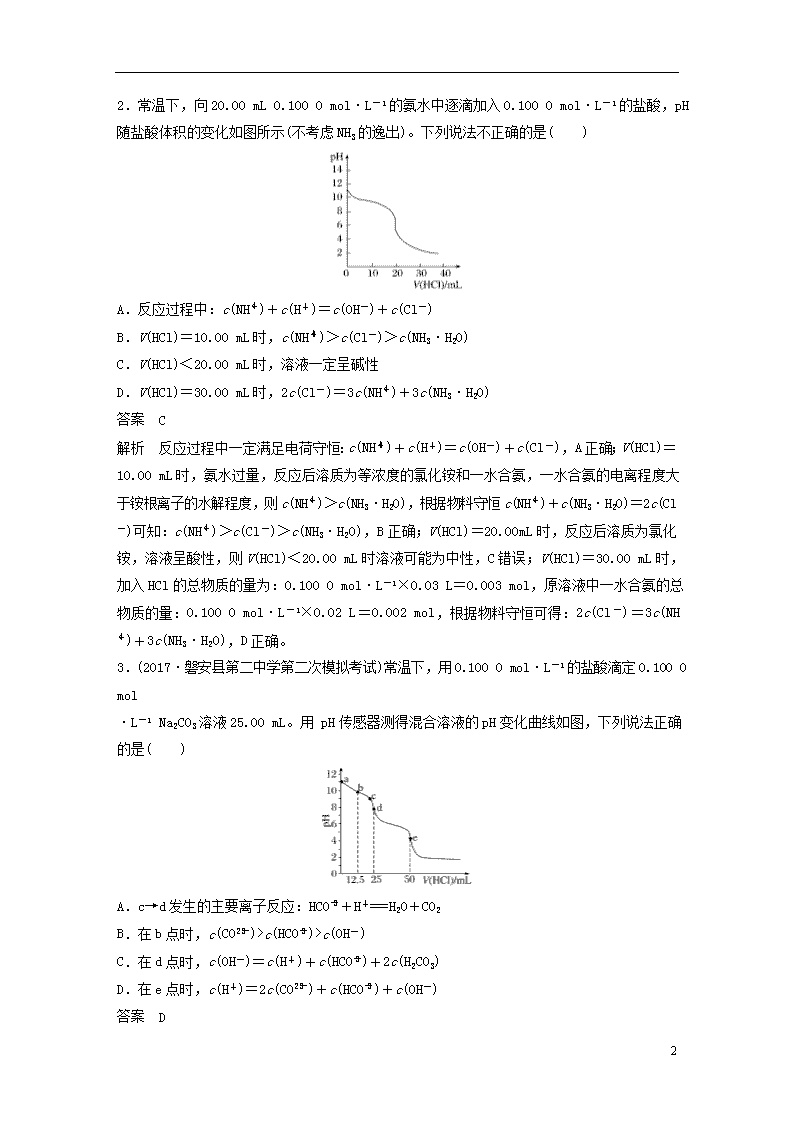
2.常温下,向20.00 mL 0.100 0 mol·L-1的氨水中逐滴加入0.100 0 mol·L-1的盐酸,pH随盐酸体积的变化如图所示(不考虑NH3的逸出)。下列说法不正确的是( )
A.反应过程中:c(NH)+c(H+)=c(OH-)+c(Cl-)
B.V(HCl)=10.00 mL时,c(NH)>c(Cl-)>c(NH3·H2O)
C.V(HCl)<20.00 mL时,溶液一定呈碱性
D.V(HCl)=30.00 mL时,2c(Cl-)=3c(NH)+3c(NH3·H2O)
答案 C
解析 反应过程中一定满足电荷守恒:c(NH)+c(H+)=c(OH-)+c(Cl-),A正确;V(HCl)=10.00 mL时,氨水过量,反应后溶质为等浓度的氯化铵和一水合氨,一水合氨的电离程度大于铵根离子的水解程度,则c(NH)>c(NH3·H2O),根据物料守恒c(NH)+c(NH3·H2O)=2c(Cl-)可知:c(NH)>c(Cl-)>c(NH3·H2O),B正确;V(HCl)=20.00 mL时,反应后溶质为氯化铵,溶液呈酸性,则V(HCl)<20.00 mL时溶液可能为中性,C错误;V(HCl)=30.00 mL时,加入HCl的总物质的量为:0.100 0 mol·L-1×0.03 L=0.003 mol,原溶液中一水合氨的总物质的量:0.100 0 mol·L-1×0.02 L=0.002 mol,根据物料守恒可得:2c(Cl-)=3c(NH)+3c(NH3·H2O),D正确。
3.(2017·磐安县第二中学第二次模拟考试)常温下,用0.100 0 mol·L-1的盐酸滴定0.100 0 mol
·L-1 Na2CO3溶液25.00 mL。用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )
A.c→d发生的主要离子反应:HCO+H+===H2O+CO2
B.在b点时,c(CO)>c(HCO)>c(OH-)
C.在d点时,c(OH-)=c(H+)+c(HCO)+2c(H2CO3)
D.在e点时,c(H+)=2c(CO)+c(HCO)+c(OH-)
答案 D
5
解析 a点为碳酸钠溶液,b点加入12.5 mL盐酸时有的Na2CO3转化成NaHCO3;d点加入25 mL盐酸时二者恰好反应生成碳酸氢钠;e点加入50 mL盐酸,反应后溶质为NaCl,故c→d发生的主要离子反应:CO+H+===HCO,A错误;b点时,有的Na2CO3转化成NaHCO3,由于CO的水解程度大于HCO的电离程度,故c(HCO)>c(CO)>c(OH-),B错误;d点加入25 mL盐酸时二者恰好反应生成碳酸氢钠,根据碳酸氢钠溶液中的质子守恒可得:c(OH-)=c(H+)+c(H2CO3)-c(CO),C错误;在e点时,根据电荷守恒可得:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-)+c(Cl-),由于c(Na+)=c(Cl-),则c(H+)=2c(CO)+c(HCO)+c(OH-),D正确。
4.(2017·诸暨市牌头中学高二下学期期中考试)常温下,分别向10 mL 0.1 mol·L-1的NaOH 溶液中逐滴加入0.1 mol·L-1的一元酸HA和HB溶液,用pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
A.HA的酸性强于HB的酸性
B.V(酸)=10 mL时,两份溶液中c(B-)=c(A-)
C.a点时,c(A-)>c(Na+)>c(OH-)>c(H+)
D.b、c点时,c(A-)+c(HA)=2c(Na+)=c(HB)+c(B-)
答案 D
解析 A项,当V(酸)=10 mL时,酸碱恰好完全反应得到等物质的量浓度的NaA溶液、NaB溶液,NaA溶液的pH(8.7)大于NaB溶液的pH(7.8),根据盐类水解的规律“越弱越水解”,HA的酸性弱于HB的酸性,A项错误;A-的水解能力大于B-的水解能力,两溶液中c(B-)>c(A-),B项错误;溶液中离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+),C项错误;b点加入20 mL的HA溶液得到等浓度的NaA和HA的混合液,根据物料守恒:c(A-)+c(HA)=2c(Na+),同理c点为c(B-)+c(HB)=2c(Na+),b、c两点溶液中c(Na+)相等,则c(A-)+c(HA)=2c(Na+)=c(B-)+c(HB),D项正确。
5.常温下,向20 mL 0.2 mol·L-1的H2SO3溶液中滴加0.2 mol·L-1 NaOH溶液,含硫微粒的物质的量(n)变化曲线如图所示,下列有关说法正确的是( )
5
A.曲线Ⅱ代表H2SO3的浓度
B.a、b、c三个交点处水的电离程度大小:a(HSO)>c(SO)>c(H+)>c(OH-)
D.若c点pH=6.5,则Ka2(H2SO3)=10-7.5
答案 B
解析 向20 mL 0.2 mol·L-1的H2SO3溶液中滴加0.2 mol·L-1 NaOH溶液,滴加前溶液中H2SO3的浓度最大,随着NaOH的加入,H2SO3的浓度减小,c(HSO)逐渐增大,则Ⅰ代表H2SO3的浓度,Ⅱ代表HSO的浓度,当NaOH的体积为20 mL时,c(HSO)达到最大值,继续滴加NaOH,c(HSO)减小,c(SO)增大,所以Ⅲ代表SO的浓度。由以上分析可知,Ⅰ代表H2SO3的浓度,故A错误;随着NaOH的加入,溶液中酸电离的氢离子逐渐减少,水的电离程度逐渐增大,所以水的电离程度大小:a点<b点<c点,故B正确;根据图像知,当V(NaOH)=20 mL时,发生反应为NaOH+ H2SO3===NaHSO3+H2O,溶质主要为NaHSO3,以电离为主,HSO电离程度大于水解程度,则c(H+)>c(SO),则溶液中离子浓度的大小关系为:c(Na+)>c(HSO)>c(H+)>c(SO)>c(OH-),故C错误;c点pH=6.5,则溶液中c(H+)=10-6.5 mol·L-1,已知c(SO)=c(HSO),则Ka2==10-6.5,故D项错误。
6.25 ℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO、SO的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是( )
A.溶液的pH=5时,硫元素的主要存在形式为HSO
B.当溶液恰好呈中性时:c(Na+)>c(SO)+c(HSO)
C.向pH=8的上述溶液中滴加少量澄清石灰水,的值增大
D.向pH=3的上述溶液中滴加少量稀硫酸,α(HSO)减小
答案 C
解析 pH=5时,HSO的物质的量分数(α)为1.0,说明硫元素的主要存在形式为HSO
5
,故A正确;c(H+)+c(Na+)=2c(SO)+c(HSO)+c(OH-),所以,c(Na+)>c(SO)+c(HSO),故B正确;随pH增大,c(SO)增大,c(HSO)减小,所以的值减小,故C错误;根据图像,向pH=3的上述溶液中滴加少量稀硫酸,溶液的pH减小,α(HSO)减小,α(H2SO3)增大,故D项正确。
5