- 714.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
《与名师对话》高考总复习(JS版)高三化学《10.2 研究物质的实验方法》课时作业
建议用时
实际用时
分值
得分
45分钟
100分
一、选择题(本题包括10小题,每小题5分,共50分)
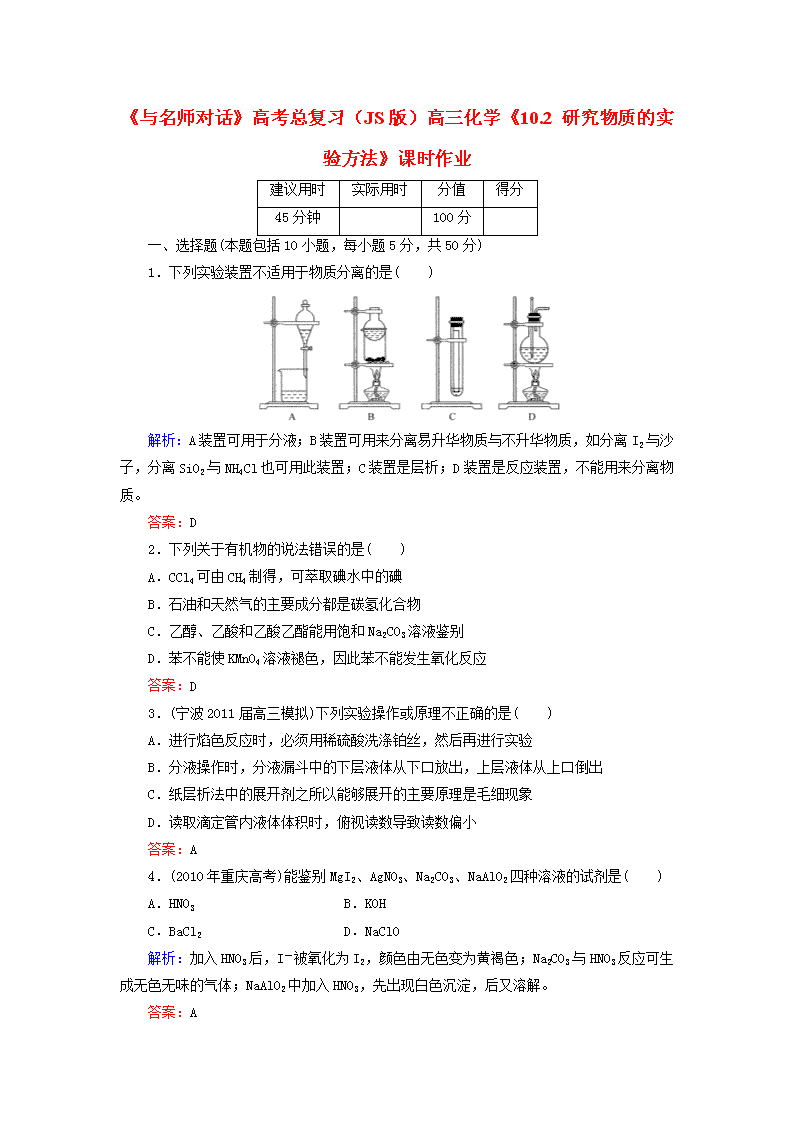
1.下列实验装置不适用于物质分离的是( )
解析:A装置可用于分液;B装置可用来分离易升华物质与不升华物质,如分离I2与沙子,分离SiO2与NH4Cl也可用此装置;C装置是层析;D装置是反应装置,不能用来分离物质。
答案:D
2.下列关于有机物的说法错误的是( )
A.CCl4可由CH4制得,可萃取碘水中的碘
B.石油和天然气的主要成分都是碳氢化合物
C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
D.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
答案:D
3.(宁波2011届高三模拟)下列实验操作或原理不正确的是( )
A.进行焰色反应时,必须用稀硫酸洗涤铂丝,然后再进行实验
B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象
D.读取滴定管内液体体积时,俯视读数导致读数偏小
答案:A
4.(2010年重庆高考)能鉴别MgI2、AgNO3、Na2CO3、NaAlO2四种溶液的试剂是( )
A.HNO3 B.KOH
C.BaCl2 D.NaClO
解析:加入HNO3后,I-被氧化为I2,颜色由无色变为黄褐色;Na2CO3与HNO3反应可生成无色无味的气体;NaAlO2中加入HNO3,先出现白色沉淀,后又溶解。
答案:A
5.(北京东城区2011届高三第一学期期末统测)下列有关分离和提纯的说法正确的是
( )
A.用浓溴水除去苯中混有的苯酚
B.用蒸馏的方法从海水中得到淡水
C.用分液的方法分离乙酸和乙酸乙酯
D.用浓硫酸除去氨气中混有的水蒸气
答案:B
6.下列鉴别方法可行的是( )
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32-
C.加入澄清石灰水,能产生白色沉淀,则原溶液中一定含有CO32-
D.检验某溶液中是否含有SO42-时,应取少量该溶液,依次加入稀盐酸和BaCl2溶液
解析:Al3+和Mg2+与氨水反应都能生成沉淀,不溶解,无法鉴别,A错;SO42-和CO32-与Ba(NO3)2反应都生成白色沉淀,无法鉴别,B错;C项若溶液中含有HCO3-或SO32-等,加入澄清石灰水也能产生白色沉淀,C错。
答案:D
7.某一无色晶体要鉴定它是否为硫酸铵,下列操作必要的是( )
(1)加入NaOH溶液并加热,检验产生气体的性质
(2)加热有无气体放出
(3)晶体用蒸馏水溶解,用盐酸酸化,再加入BaCl2观察有无沉淀生成
(4)晶体溶解,加入Ba(NO3)2溶液,再加入HNO3看有无沉淀生成
A.(1)(2) B.(2)(4)
C.(1)(3) D.(1)(4)
答案:C
8.有a、b、c、d、e五种无色气体,进行下列实验:
实验步骤
实验现象
①a和b相混合
气体变为红棕色
②c和d相混合
产生白烟
③c、e分别通入少量溴水中
都变成无色透明的溶液
④b、e分别通入氢硫酸中
都产生淡黄色的浑浊
a、b、c、d、e依次可能是( )
A.O2、NO、HCl、NH3、CO2
B.O2、NO、NH3、HCl、SO2
C.NO、O2、NH3、HCl、SO2
D.HBr、Cl2、NH3、H2S、C2H4
答案:C
9.(2010年宿迁模拟)有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的一种或几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体并生成白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )
A.肯定没有MnO4-、HCO3-
B.肯定没有K+、MnO4-、HCO3-
C.肯定有K+、Al3+、Mg2+、SO42-
D.肯定有Al3+、Mg2+、NH4+、Cl-
答案:A
10.(2010年广东高考)对实验Ⅰ~Ⅳ的实验现象预测正确的是( )
A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中溶液颜色变为红色
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
解析:A项,CCl4的密度比水大,上层为水层,呈无色,下层为CCl4层,呈紫红色;B项,Al(OH)3不能溶于弱碱;C项,Fe3+和SCN-结合成Fe(SCN)3而显红色;D项,CaO吸收了试管中的水,导致CuSO4从溶液中结晶,析出CuSO4·5H2O。
答案:CD
二、非选择题(本题包括4小题,共50分)
11.(10分)某无色待检溶液A中含有K+、Cl-、OH-、SO32-、SO42-,为检验确认其中所含的各阴离子,可选用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、高锰酸钾溶液和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如图所示。
(1)图中试剂①④⑤的化学式分别为:
①________,④________,⑤________。
(2)图中现象a、b、c表明检验出的离子分别是:
a.________,b.________,c.________。
(3)无色溶液A中加试剂③的主要目的是
________________________________________________________________________
________________________________________________________________________。
(4)把白色沉淀A中加入的试剂②改为试剂③对实验的影响是
________________________________________________________________________。
答案:(1)Ba(NO3)2 KMnO4 AgNO3
(2)SO32- SO42- Cl-
(3)中和OH-,防止对Cl-的检验产生干扰
(4)会使SO32-对SO42-的检验产生干扰,不能确认SO42-是否存在
12.(14分)(2010年全国理综Ⅰ)有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用蘸有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其他五种溶液中,只有D、F中有沉淀生成;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定的溶液是(写出溶液标号与相应溶质的化学式):
________________________________________________________________________
________________________________________________________________________;
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
解析:本题主要考查物质的推断,意在考查考生的逻辑推理能力。由A有刺激性气味,且与浓盐酸靠近有白雾,说明A为浓氨水。而F能溶于过量的氨水,说明其为AgNO3溶液。纯E为油状液体,故E为H2SO4。由C与E(H2SO4)和F(AgNO3)要产生不溶于硝酸的沉淀故其为BaCl2或BaBr2等。B与H2SO4反应生成无色无味的气体,说明其含CO32-,但阳离子不能确定。故可以确定的是:A为浓氨水,F为AgNO3溶液,E为H2SO4。
答案:(1)A NH3 E H2SO4 F AgNO3 C BaCl2
(若C作为不能确定的溶液,进一步鉴别的方法合理,同样给分)
(2)B Na2CO3或K2CO3 用铂丝蘸取少量B,在氧化焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液
D Al2(SO4)3或MgSO4 取少量D,向其中滴加NaOH溶液有沉淀生成,继续加过量NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶,则D为MgSO4溶液
13.(12分)利用如图所示装置,将CCl4(沸点76.7℃)10 mL和甲苯(沸点110.6℃)10 mL的混合物进行蒸馏分离。
(1)应选用的蒸馏烧瓶是(填字母序号)________。
A.20 mL B.30 mL
C.50 mL D.250 mL
(2)该装置中有不合理的地方,下面改正正确的是________(填字母序号)。
A.把温度计水银球再向上提高些
B.把温度计水银球再向下插一些
C.使冷却水按箭头所示逆方向流动
(3)蒸馏结果列在下表中,从A~E中选出两个正确答案(填字母序号)________。
馏分
蒸馏温度/℃
馏出量/mL
Ⅰ
最高82
1.0
Ⅱ
82~93
8.0
Ⅲ
93~104
6.0
Ⅳ
104~109
3.0
残余液
1.0
A.残留液几乎是CCl4
B.馏分Ⅱ是甲苯
C.馏分Ⅲ是CCl4
D.馏分Ⅰ中CCl4含量最高
E.馏分Ⅳ甲苯含量最高
(4)蒸馏装置中B是软木塞,不用橡皮塞的理由是________(填字母序号)。
A.价格便宜
B.二者比较,软木塞保持气体的密封性好
C.软木塞打孔容易
D.软木塞不易被甲苯或CCl4腐蚀
答案:(1)C (2)C (3)D、E (4)D
14.(14分)(2010年安徽高考)锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
(1)第②步反应得到的沉淀X的化学式为
________________________________________________________________________。
(2)第③步反应的离子方程式是
________________________________________________________________________。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有
________________________________________________________________________
________________________________________________________________________。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
________________________________________________________________________
________________________________________________________________________。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g,第③步反应中加入20.0 mL 3.0 mol·L-1的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有________g Na2CO3参加了反应。
解析:本题中要注意金属铝的性质、偏铝酸盐的性质以及有关离子方程式的书写规则。(1)由锂离子电池正极材料可知,只有铝能与NaOH溶液反应生成偏铝酸钠,偏铝酸钠溶液中通入CO2可生成Al(OH)3沉淀。(2)第③步反应是LiMn2O4在酸性条件下被空气中的氧气氧化生成MnO2,LiMn2O4是难溶物,故离子方程式应为4LiMn2O4+4H++O2===8MnO2+4Li++2H2O。(3)过滤时所需的玻璃仪器有烧杯、玻璃棒、漏斗;若过滤时发现滤液中有少量浑浊,只从操作的角度分析可能是滤纸破损、滤液液面高于滤纸的边缘等原因。(4)由第(2)问中离子方程式知LiMn2O4生成Li+时稀硫酸过量,所以沉淀Li+时过量的稀硫酸也消耗Na2CO3,两部分消耗的Na2CO3至少需0.06 mol即6.36 g。
答案:(1)Al(OH)3
(2)4LiMn2O4+4H++O2===8MnO2+4Li++2H2O
(3)烧杯、漏斗、玻璃棒 玻璃棒下端靠在滤纸的单层处,导致滤纸破损 漏斗中液面高于滤纸边缘(其他合理答案均可)
(4)6.4(或6.36)