- 1008.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
绝密★启封并使用完毕前
2015年普通高等学校招生全国统一考试
理科综合能力测试
可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Na 23 Al 27 P 31 S 32 Cl 35.5 Ca 40 Fe 56 Zn 65 Br 80
第I卷
一、选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的
7.食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是
A.硅胶可用作食品干燥剂
B.P2O5不可用作食品干燥剂
C.六水合氯化钙可用作食品干燥剂
D.加工后具有吸水性的植物纤维可用作食品干燥剂
8.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A.C14H18O5 B.C14H16O4 C.C14H22O5 D.C14H10O5
9.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6
10.NA代表阿伏加德罗常数的值。下列叙述正确的是
A.60g丙醇中存在的共价键总数为10NA
B.1L 0.1mol·L-1的NaHCO3-溶液中HCO3-和CO32-离子数之和为0.1NA
C.钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为1NA
D.235g核互U发生裂变反应:U+nSr+U+10n净产生的中子(n)数为10NA
11.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含量立体异构)
A.3种 B.4种 C.5种 D.6种
12.海水开发利用的部分过程如图所示。下列说法错误的是
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
13.用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
选项
①中物质
②中物质
预测②中的现象
A
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C
氯化铝溶液
浓氢氧化钠溶液
产生大量白色沉淀
D
草酸溶液
高锰酸钾酸性溶液
溶液逐渐褪色
第II卷
三、非选择题(包括必考题和选考题两部分。第22题~第32题为必考题,每个考题考生都必须作答,第33~40为选考题,考生根据要求作答)
(一)必考题(129分)
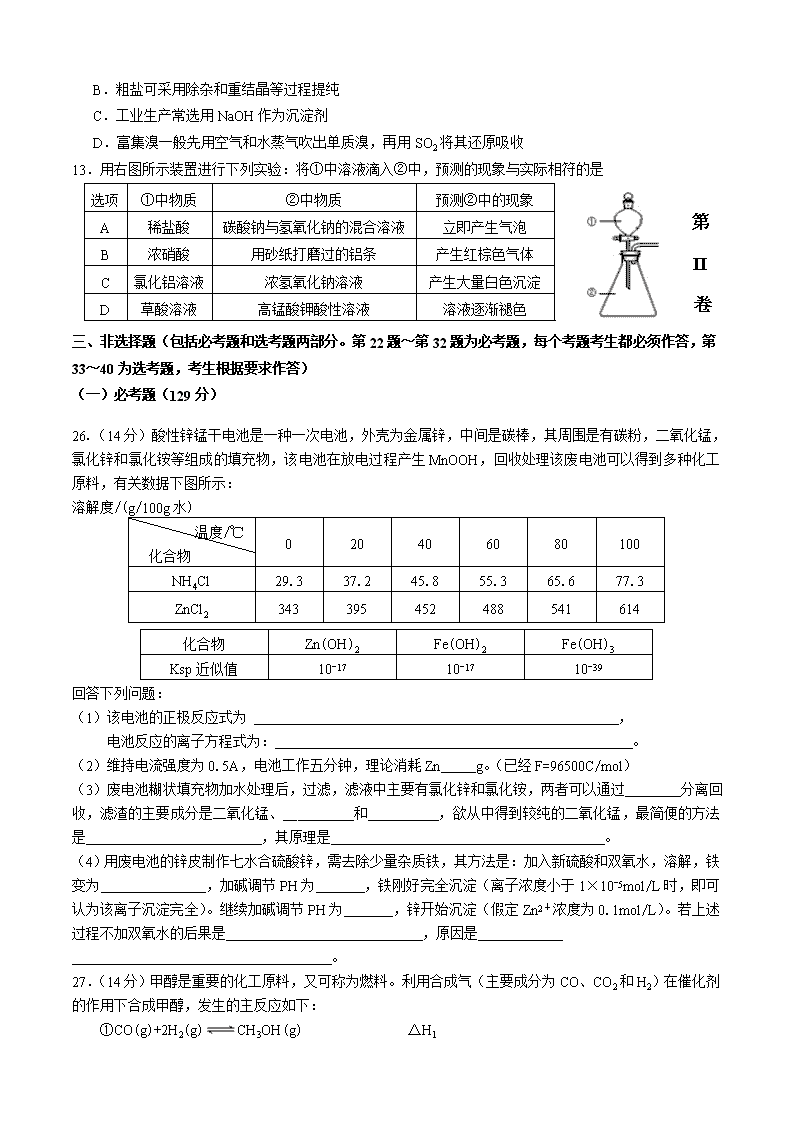
26.(14分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下图所示:
溶解度/(g/100g水)
温度/℃
化合物
0
20
40
60
80
100
NH4Cl
29.3
37.2
45.8
55.3
65.6
77.3
ZnCl2
343
395
452
488
541
614
化合物
Zn(OH)2
Fe(OH)2
Fe(OH)3
Ksp近似值
10-17
10-17
10-39
回答下列问题:
(1)该电池的正极反应式为 ,
电池反应的离子方程式为: 。
(2)维持电流强度为0.5A,电池工作五分钟,理论消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过__ __分离回收,滤渣的主要成分是二氧化锰、__ ____和 ,欲从中得到较纯的二氧化锰,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入新硫酸和双氧水,溶解,铁变为 ,加碱调节PH为 ,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。继续加碱调节PH为 ,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加双氧水的后果是 ,原因是
。
27.(14分)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)CH3OH(g) △H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)CO(g)+H2O(g) △H3
回答下列问题:
化学键
H-H
C-O
C O
H-O
C-H
E/(kJ.mol-1)
436
343
1076
465
413
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1= kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3= kJ.mol-1
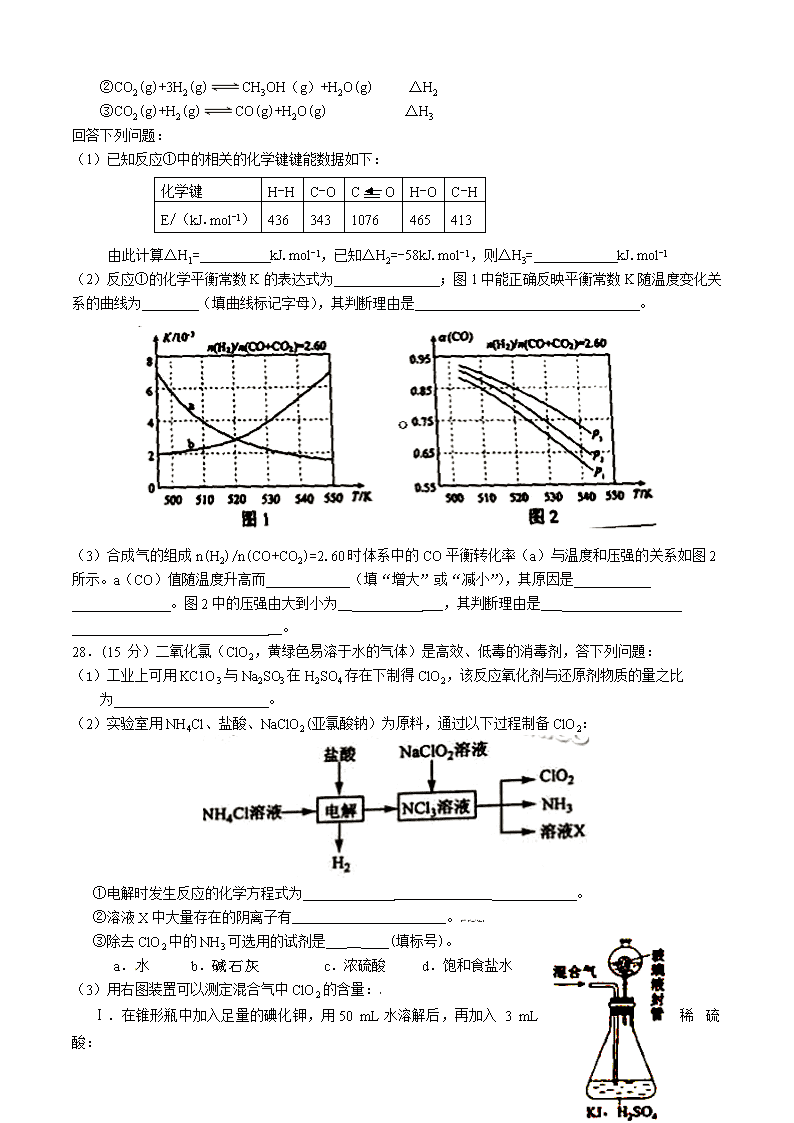
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而 (填“增大”或“减小”),其原因是
。图2中的压强由大到小为__ ___,其判断理由是___
__。
28.(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问題:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比
为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
①电解时发生反应的化学方程式为 ______________ 。
②溶液X中大量存在的阴离子有______________________。[来源:Z§xx§k.Com]
③除去ClO2中的NH3可选用的试剂是 __ (填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用右图装置可以测定混合气中ClO2的含量:[
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 __________________ 。
②玻璃液封装置的作用是 __________________ 。
③V中加入的指示剂通常为 ________ ,滴定至终点的现象是 __________ 。
④测得混合气中ClO2的质量为 g 。(4)O2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物庾最适宜的是_______(填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
(二)选做题(45分)
38.【化学一选修5:有机化学基础】(15分)
聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相存性方面有很好的应用前景。 PPG的一种合成路线如下:
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④ 。
回答下列问题:
(1)A的结构简式为 ___ 。
(2)由B生成C的化学方8式为 __________________________________ 。
(3)由E和F生成G的反应类型为 ___ ,G的化学名称为 ____ 。
(4) ①由D和H生成PPG的化学方程式为 _________________________ _______ 。
②若PPG平均相对分子质量为10000,则其平均聚合度约为 ____ (填标号).
a.48 b.58 c.76 d.122
(5)D的网分异构体中能同时满足下列条件的共有 _____ 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体 ②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 (写结构简式),D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是___________(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
2015年普通高等学校招生全国统一考试
化学部分
7.C
8.A
9.B
10.C
11.B
试题分析:分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体,这说明该有机物是羧酸,即分子组成为C4H9—COOH,丁基有4种,所以有机物有4种,答案选B。
12.C
13.D
试题分析:A、盐酸首先中和氢氧化钠,A错误;B、常温下铝在浓硝酸中钝化,得不到气体,B错误;C、
氢氧化钠溶液开始是过量的,因此不可能产生白色沉淀氢氧化铝,C错误;D、草酸具有还原性,能被酸性
高锰酸钾溶液氧化,使其褪色,D正确,答案选D。
26.(1)MnO2+e—+H+=MnOOH;Zn+2MnO2+2H+=Zn2++2MnOOH (2)0.05g
(3)加热浓缩、冷却结晶;铁粉、MnOOH;在空气中加热;碳粉转变为CO2,MnOOH氧化为MnO2 (4)Fe3+;2.7;6;Zn2+和Fe2+分离不开;Fe(OH)2和Zn(OH)2的Ksp相近
试题分析:(1)酸性锌锰干电池是一种一次电池,外壳为金属锌,锌是负极,电极反应式为
Zn—2e—=Zn2+。中间是碳棒,碳棒中正极,二氧化锰得到电子,则正极电极反应式为MnO2+e—+H+=
MnOOH,总反应式为Zn+2MnO2+2H+=Zn2++2MnOOH。
(2)维持电流强度为0.5A,电池工作五分钟,则通过的电量是150,因此通过电子的物质的量是
,锌在反应中失去2个电子,则理论消耗Zn的质量是。
27.(1)—99;+41 (2);a;反应①为放热反应,平衡常数应随温度升高变小;
(3)减小;升高温度时,反应①为放热反应,平衡向向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又产生CO的量增大;总结果,随温度升高,使CO的转化率降低;P3>P2>P1;相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高
的量不受压强影响,故增大压强时,有利于CO的转化率升高,所以图2中的压强由大到小为P3>P2>P1。
28.(1) 2:1 (2)①NH4Cl+2HCl3H2↑+NCl3 ②Cl—、OH— ③c
(3)①2ClO2+10I-+8H+=2Cl-+5I2+4H2O ②吸收残余的二氧化氯气体(避免碘的逸出)
③淀粉溶液;溶液由蓝色变为无色,且半分钟内溶液颜色不再改变 ④0.02700
(4)d
净水
36.(1)氧气(或空气) (2)A;C (3)催化剂(提高反应速率);腐蚀设备
(4)放热;可能会导致(过氧化物)爆炸
(5)c (6)丙酮、苯酚;苯酚的沸点高于丙酮(7)原子利用率高
37.(1)O;1s22s22p63s23p3(或[Ne] 3s23p3)
(2)O3;O3相对分子质量较大,范德华力大;分子晶体;离子晶体
(3)三角锥形;sp3 (4)V形;4;2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl
(或2Cl2+2Na2CO3=Cl2O+CO2+2NaCl)
(5)Na2O;8;
38.(1) (2)
(3)加成反应;3—羟基丙醛(或β—羟基丙醛)(4)①
②b(5)5;;c
(5)①能与饱和NaHCO3溶液反应产生气体,说明含有羧基;②既能发生银镜反应,又能发生皂化反应,说明含有醛基和酯基,因此是甲酸形成的酯基,所以可能的结构简式为HCOOCH2CH2CH2COOH、
HCOOCH2CH(COOH)CH3、HCOOCH(COOH)CH2CH3、HCOOCH(CH3)CH2COOH、HCOOC(CH3)2COOH,共计5种。其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是答案中所示图形。
a.质谱仪又称质谱计。分离和检测不同同位素的仪器。即根据带电粒子在电磁场中能够偏转的原理,按物质原子、分子或分子碎片的质量差异进行分离和检测物质组成的一类仪器。,b.红外光谱仪是测定结构的,d.核磁共振仪是测定氢原子种类的,而c.元素分析仪是测定元素种类的,
因此完全相同的是元素分析仪,答案选c。