- 86.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2013 届高考化学复习卷-专练 9 水溶液中的离子平衡
1.(2011·四川理综,9)25 ℃时,在等体积的①pH=0 的 H2SO4 溶液、②0.05 mol·L-1 的
Ba(OH)2 溶液、③pH=10 的 Na2S 溶液、④pH=5 的 NH4NO3 溶液中,发生电离的水的物质
的量之比是( )
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109
D.1∶10∶104∶109
2.(2011·福建理综,10)常温下 0.1 mol·L-1 醋酸溶液的 pH=a,下列能使溶液 pH=(a
+1)的措施是( )
A.将溶液稀释到原体积的 10 倍
B.加入适量的醋酸钠固体
C.加入等体积 0.2 mol·L-1 盐酸
D.提高溶液的温度
3.(2011·山东理综,14)室温下向 10 mL pH=3 的醋酸溶液中加水稀释后,下列说法正
确的是( )
A.溶液中导电粒子的数目减少
B.溶液中 c(CH3COO-)
c(CH3COOH)·c(OH-)
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入 10 mL pH=11 的 NaOH 溶液,混合液 pH=7
4.(2011·广东理综,11)对于 0.1 mol·L-1Na2SO3 溶液,正确的是( )
A.升高温度,溶液 pH 降低
B.c(Na+)=2c(SO2-
3 )+c(HSO-
3 )+c(H2SO3)
C.c(Na+)+c(H+)=2c(SO2-
3 )+2c(HSO-
3 )+c(OH-)
D.加入少量 NaOH 固体,c(SO2-
3 )与 c(Na+)均增大
5.(2011·天津理综,4)25 ℃时,向 10 mL 0.01 mol·L-1 KOH 溶液中滴加 0.01 mol·L-1
苯酚溶液,混合溶液中粒子浓度关系正确的是( )
A.pH>7 时,c(C6H5O-)>c(K+)>c(H+)>c(OH-)
B.pH<7 时,c(K+)>c(C6H5O-)>c(H+)>c(OH-)
C.V[C6H5OH(aq)]=10 mL 时,c(K+)=c(C6H5O-)>c(OH-)=c(H+)
D.V[C6H5OH(aq)]=20 mL 时,c(C6H5O-)+c(C6H5OH)=2c(K+)
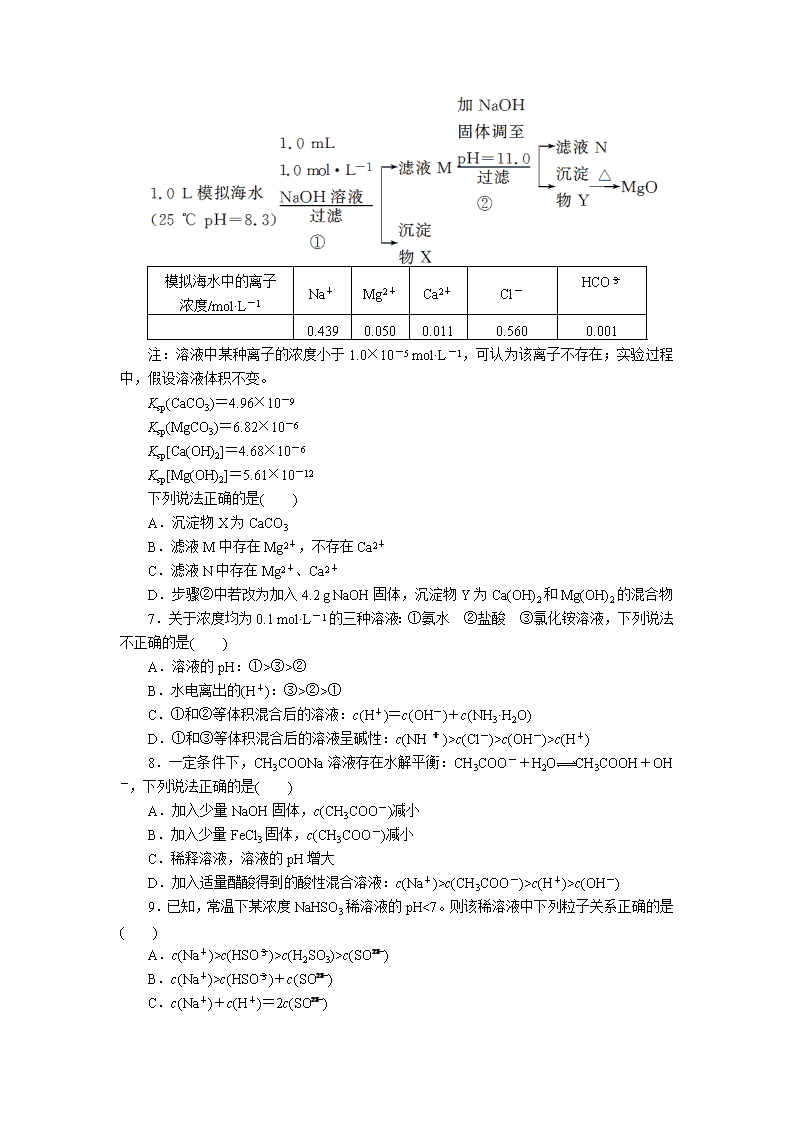
6.(2011·浙江理综,13)海水中含有丰富的镁资源。某同学设计了从模拟海水中制备
MgO 的实验方案:
模拟海水中的离子
浓度/mol·L-1 Na+ Mg2+ Ca2+ Cl- HCO-
3
0.439 0.050 0.011 0.560 0.001
注:溶液中某种离子的浓度小于 1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,
假设溶液体积不变。
Ksp(CaCO3)=4.96×10-9
Ksp(MgCO3)=6.82×10-6
Ksp[Ca(OH)2]=4.68×10-6
Ksp[Mg(OH)2]=5.61×10-12
下列说法正确的是( )
A.沉淀物 X 为 CaCO3
B.滤液 M 中存在 Mg2+,不存在 Ca2+
C.滤液 N 中存在 Mg2+、Ca2+
D.步骤②中若改为加入 4.2 g NaOH 固体,沉淀物 Y 为 Ca(OH)2 和 Mg(OH)2 的混合物
7.关于浓度均为 0.1 mol·L-1 的三种溶液:①氨水 ②盐酸 ③氯化铵溶液,下列说法
不正确的是( )
A.溶液的 pH:①>③>②
B.水电离出的(H+):③>②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液呈碱性:c(NH+4)>c(Cl-)>c(OH-)>c(H+)
8.一定条件下,CH3COONa 溶液存在水解平衡:CH3COO-+H2O CH3COOH+OH-,
下列说法正确的是( )
A.加入少量 NaOH 固体,c(CH3COO-)减小
B.加入少量 FeCl3 固体,c(CH3COO-)减小
C.稀释溶液,溶液的 pH 增大
D.加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
9.已知,常温下某浓度 NaHSO3 稀溶液的 pH<7。则该稀溶液中下列粒子关系正确的是
( )
A.c(Na+)>c(HSO-
3 )>c(H2SO3)>c(SO2-
3 )
B.c(Na+)>c(HSO-
3 )+c(SO2-
3 )
C.c(Na+)+c(H+)=2c(SO2-
3 )
D.c(Na+)+c(H+)=c(HSO-
3 )+c(OH-)
10.在 t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如下图所示。
又知 AgCl 的 Ksp=1.8×10-10。下列说法不正确的是( )
A.t ℃时,Ag2CrO4 的 Ksp 为 1×10-8
B.在饱和 Ag2CrO4 溶液中加入 K2CrO4 不能使溶液由 Y 点变为 X 点
C.t ℃时,Y 点和 Z 点时 Ag2CrO4 的 Ksp 相等
D.t ℃时,将 0.01 mol·L-1 AgNO3 溶液滴入 20 mL 0.01 mol·L-1 KCl 和 0.01 mol·L-1
K2CrO4 的混合溶液中,Cl-先沉淀
11.下列关于电解质溶液的叙述正确的是( )
A.常温下,在 pH=7 的醋酸钠和醋酸混合溶液中,c(CH3COO-)>c(Na+)
B.稀释醋酸溶液,溶液中所有离子的浓度均降低
C.在 pH=5 的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-)
D.在 0.1 mol·L-1 的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S)
12.下列关于电解质溶液的叙述正确的是( )
A.中和 pH 与体积都相同的盐酸和硫酸,消耗 NaOH 的物质的量之比是 1∶2
B.pH=13 的氨水加水稀释后,溶液中所有离子的浓度均降低
C . 浓 度 均 为 0.1 mol·L - 1 的 下 列 溶 液 , pH 由 大 到 小 排 列 顺 序 为
NaOH>Na2CO3>NaHSO4>(NH4)2SO4
D.0.1 mol·L-1 的硫酸铵溶液中,离子浓度大小顺序为 c(NH+4)>c(SO2-
4 )>c(H+)>c(OH-)
13.下列叙述正确的是( )
A.0.1 mol·L-1 氨水中,c(OH-)=c(NH+4)
B. 10 mL 0.02 mol·L-1 HCl 溶液与 10 mL 0.02 mol·L-1 Ba(OH)2 溶液充分混合,若混合后
溶液的体积为 20 mL,则溶液的 pH=12
C.在 0.1 mol·L-1 CH3COONa 溶液中,c(OH-)>c(CH3COOH)+c(H+)
D.0.1 mol·L-1 某二元弱酸强碱盐 NaHA 溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
14.常温下,物质的量浓度均为 0.1 mol·L-1 的两溶液 HA、BOH,HA 溶液的 pH>1,
BOH 溶液中c(OH-)
c(H+)
=1012。下列有关说法正确的是( )
A.取等体积的 HA、BOH 溶液稀释相同的倍数,pH 变化较大的是 HA
B.HA 溶液中水的电离程度小于 BOH 溶液中水的电离程度
C.若两溶液混合时:V(BOH)≥V(HA),则混合液中必有 c(B+)>c(A-)
D.若两溶液混合后所得溶液的 pH=7,则混合液中必有 c(B+)=c(HA)+c(A-)
15.常温下,向 10 mL 0.1 mol·L-1 NaOH 溶液中逐滴加入 0.1 mol·L-1 醋酸溶液,所得
滴定曲线如图所示。下列说法正确的是( )
A.pH<7 时,溶液中:c(CH3COO-)c(CH3COO-)>c(OH-)>c(H+)
C.pH=7 时,所加醋酸溶液的体积大于 10 mL
D.继续滴加 0.1 mol·L-1 醋酸溶液,溶液 pH 可以变为 1
答案
1.A 2.B 3.B 4.D 5.D 6.A 7.B 8.B 9.B 10.A 11.C 12.D
13.B 14.C 15.C