- 269.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
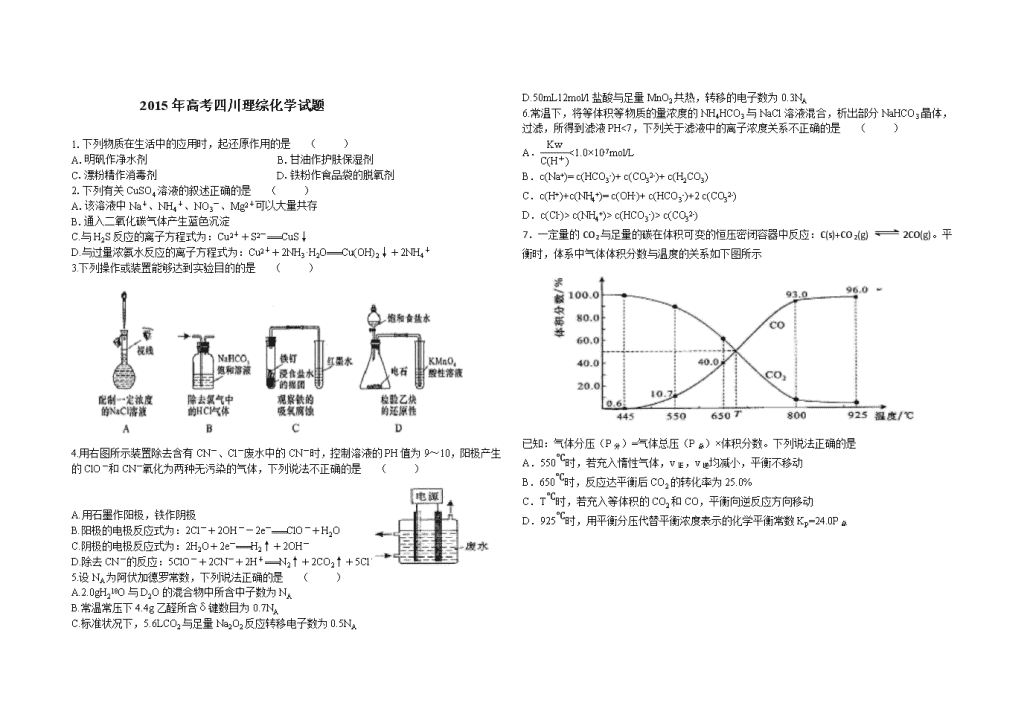
2015年高考四川理综化学试题
1.下列物质在生活中的应用时,起还原作用的是 ( )
A.明矾作净水剂 B.甘油作护肤保湿剂
C.漂粉精作消毒剂 D.铁粉作食品袋的脱氧剂
2.下列有关CuSO4溶液的叙述正确的是 ( )
A.该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存
B.通入二氧化碳气体产生蓝色沉淀
C.与H2S反应的离子方程式为:Cu2++S2-===CuS↓
D.与过量浓氨水反应的离子方程式为:Cu2++2NH3·H2O===Cu(OH)2↓+2NH4+
3.下列操作或装置能够达到实验目的的是 ( )
4.用右图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生
的ClO-和CN-氧化为两种无污染的气体,下列说法不正确的是 ( )
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:2Cl-+2OH--2e-===ClO-+H2O
C.阴极的电极反应式为:2H2O+2e-===H2↑+2OH-
D.除去CN-的反应:5ClO-+2CN-+2H+===N2↑+2CO2↑+5Cl-+H2O
5.设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.2.0gH218O与D2O的混合物中所含中子数为NA
B.常温常压下4.4g乙醛所含δ键数目为0.7NA
C.标准状况下,5.6LCO2与足量Na2O2反应转移电子数为0.5NA
D.50mL12mol/l盐酸与足量MnO2共热,转移的电子数为0.3NA
6.常温下,将等体积等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得到滤液PH<7,下列关于滤液中的离子浓度关系不正确的是 ( )
A.<1.0×10-7mol/L
B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
D.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-)
7.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
8.(13分)X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第VIIA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。
请回答下列问题
(1)R基态原子的电子排布式是___________________。
(2)利用价层电子对互斥理论判断TU3的立体构型是______ 。
(3)X所在周期元素最高价氧化物对应的水化物中,酸性最强的是_____ _(填化学式);Z和U的氢化物中沸点较高的是____ _(填化学式);Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是_______ (填化学式)。
(4)CuSO4溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学
方程式是_______________________ 。
9.(13分)(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料] (NH4)2SO4在2600C和4000C时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。
通入N2排尽空气后,于2600C加热装置A一段时间,停止加热,冷却,停止通入N2.品红溶液
不褪色,去下装置B,加入指示剂,用0.2000mol/LNaOH溶液滴定剩余盐酸,终点时消耗NaOH
溶液25.00mL。经检验滴定后的溶液中无SO42-。
(1)仪器X的名称是________________。
(2)滴定前,下列操作的正确顺序是_________(填字母编号)。
a.盛装0.2000mol/LNaOH溶液 b.用0.2000mol/LNaOH溶液润洗
c.读数、记录 d.查漏、清洗 e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol。
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,与4000C加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2.观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-.进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________
。
(5)装置B内溶液吸收的气体是____________。
(6)(NH4)2SO4在4000C分解的化学方程式是______________________ 。
10.(16分)化合物F(异戊巴比妥)是临床常用的镇静催眠药物,其合成路线如下(部分反应条件和试剂略)
请回答下列问题
(1)试剂I的化学名称是 ,化合物B的官能团名称是 ,第④
步的化学反应类型是 。
(2)第①步反应的化学方程式是 。
(3)第⑤步反应的化学方程式是 。
(4)试剂II的相对分子质量为60,其结构简式是 。
(5)化合物B的一种同分异构体G与NaOH溶液共热反应,生成乙醇和化合物H。H在一定
条件下发生聚合反应得到高吸水性树脂,该聚合物的结构简式是 。
11.(16分)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的工业原料FeSO4(反应条件略)
活化硫铁矿还原Fe2+的主要反应为FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应,请回答下列问题。
(1)第1步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第II步中Fe2+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.K2[Fe(CN)4]溶液 C.KSCN溶液
(3)第III步加FeCO3调溶液pH到5.8左右,然后再第VI步通入空气使溶液pH降到5.2,此
时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是
。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) =-1648kJ/mol
C(s)+O2(g)=CO2(g) =-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)加入烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg
烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗掉硫酸以及调pH后溶液呈微酸性所残留
的硫酸忽略不计。按上述流程,第III步应加入FeCO3 kg。
2015年高考四川理综化学试题参考答案
1.D 2.A 3.C 4.D 5.A 6.C 7.B
8.(13分)
(1)1s22s22p63s23p2
(2)三角锥形
(3)HNO3;HF;Si>Mg>Cl2
(4)10CuSO4+P4+16H2O===10Cu+10H2SO4+4H3PO4
9.(13分)
(1)圆底烧瓶
(2)d-b-a-e-c
(3)0.01
(4)取少量D溶液,加入足量的稀盐酸酸化,再加入氯化钡溶液,没有白色沉淀产生,证明没
有SO42-
(5)NH3
(6)3(NH4)2SO4N2↑+3SO2↑+4NH3↑+6H2O
10.(16分)
(1)乙醇;醛基;酯化反应
(2)CH3CH2CH(CH2Br)2+2NaOHCH3CH2CH(CH2OH)2+2NaBr
(3)CH3CH2CH(COOCH2CH3)2+(CH3)2CHCH2CH2Br+CH3CH2ONa
CH3CH2C(COOCH2CH3)2,
CH2CH3CH(CH3)2
+CH3CH2OH+NaBr
(4)CO(NH2)2
CH2—CH
n
COONa
(5)
11.(16分)
(1)Fe2O3+6H+===2Fe3++3H2O;(2)C (3)Fe2+被氧气氧化Fe3+,Fe3+水解PH下降。
(4)4FeCO3(s)+O2(g)2Fe2O3(s)+4CO2(g) △H=-260kJ·mol-1;
(5)( — ×+×)×116=0.0118ab-0.646c