- 867.78 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
注意::当温度发生变化时,,溶液的体积也会发生相应的变化,,从而导致物质的量浓度也发生相应的变化。但质量分数却不会哟!!
化学计量在化学实验中的应用(二)
—物质的量浓度 第1课时
目的要求:1.了解物质的量浓度变化的含义
2.了解配制一定物质的量浓度溶液的方法
重点难点:物质的量浓度溶液的配制
一、物质的量浓度
1.物质的量浓度是用来表示单位体积溶液里所含溶质B
的物质的量的物理量,也称为B的物质的量浓度,符号为cB。
2.物质的量浓度的数学表达式是____________,nB表示溶质的物质的量,V表示溶液体积,因此物质的量浓度的单位是mol/L(或mol/m3)。
注意::量筒的精确度并不高,,所以配制出的溶液浓度的精确度也不太高,,要得到高精确度的浓度必须用基准试剂去标定。
3.将溶质质量分数一定的溶液稀释时,溶液中溶质的质量总是保持不变;同理,稀释一定物质的量浓度的溶液时,溶液的体积发生了变化,但溶液中溶质的物质的量保持不变,即:c(浓)·V(浓)=c(稀)·V(稀)。
二、配制一定物质的量浓度的溶液
1.仪器
托盘天平、容量瓶、玻璃棒、量筒、烧杯、药匙、胶头滴管等。
2.容量瓶的使用
(1)规格
容量瓶上标有刻线、温度和容积,常见的容量
瓶有50 mL、100 mL、500 mL、1 000 mL (见右图)等几种。
注意::容量瓶的容积是一定的,,没有任意体积的容量瓶。如125mL等。
注意::这里要检查两次哟!!
(2)用途
用于配制一定物质的量浓度的溶液。
(3)使用方法和注意事项
①查漏
容量瓶使用前的第一步操作要检查是否漏水。
检查方法是:加水→倒立→观察→正立,瓶塞旋转180°→倒立→观察。
②使用前用蒸馏水洗净,但不能用待配溶液润洗。
③不能将固体或浓溶液直接在容量瓶中溶解或稀释,容量瓶也不能作为反应容器或长期贮存溶液。
④容量瓶的容积是在瓶身标定温度下确定,因而不能将热的溶液转移到容量瓶中。
⑤只能配制容量瓶上规定容积的溶液,即不能配制任意体积的一定物质的量浓度的溶液。
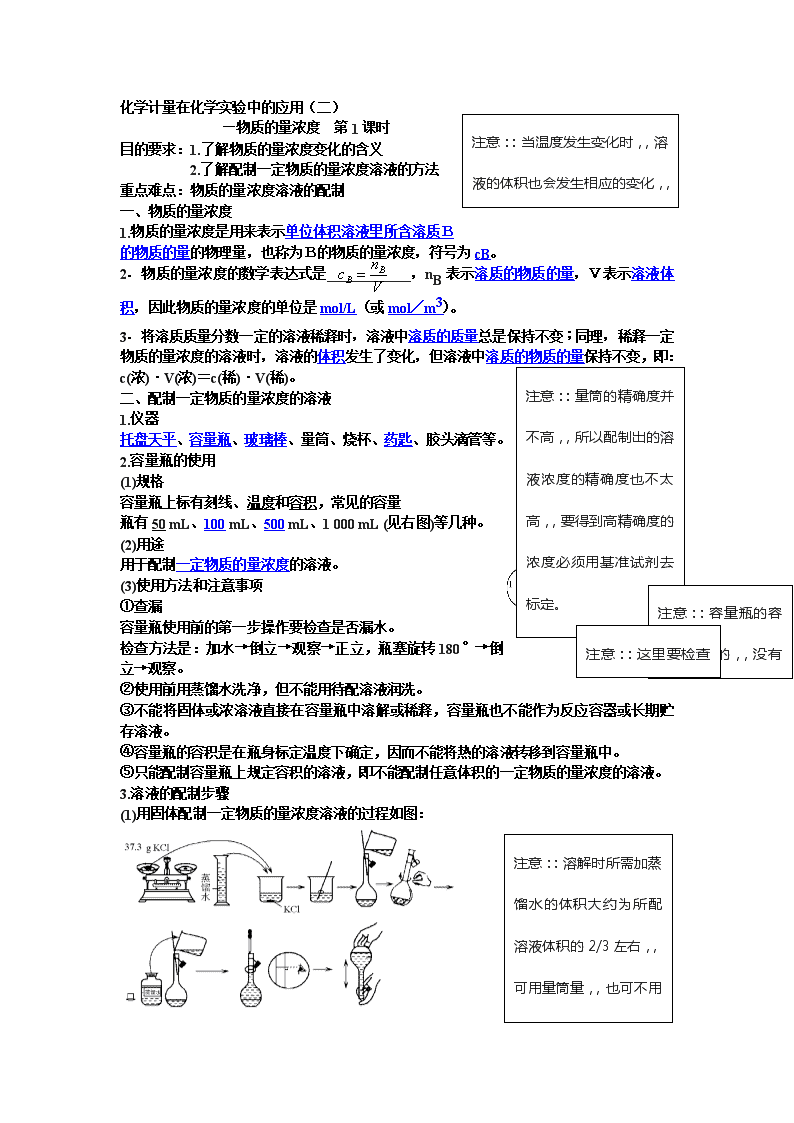
3.溶液的配制步骤
(1)用固体配制一定物质的量浓度溶液的过程如图:
注意::溶解时所需加蒸馏水的体积大约为所配溶液体积的2/3左右,,可用量筒量,,也可不用量筒量。因为这对结果没影响。因此,,固体溶质配制溶液的过程中量筒也不是必需的仪器。
(2)配制一定物质的量浓度溶液的步骤为:
①计算;②称量(量取);③溶解(稀释);④转移;⑤洗涤;⑥定容;⑦摇匀。
体验热身
见教师用书P32-33,重点讲解T-5
解析:(1)设需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为V。
V×1.84 g/cm3×98%=0.5 L×1 mol/L×98 g/mol,V≈27.2 mL。
(2)配制顺序是:计算→量取→稀释→移液→定容,因此使用仪器的顺序为:⑤④②⑥⑦⑧⑨。
(3)按规范操作解答:往容量瓶内加适量水,塞好瓶塞,用食指顶住瓶塞,用另一只手的五指托住瓶底,把瓶倒立过来,如不漏水,把瓶正立过来,将瓶塞旋转180°后塞紧,再把瓶倒立过来,若不漏水,才能使用。
(4)①偏低;②偏高;③偏低;④不变。
化学计量在化学实验中的应用(二)
—物质的量浓度 第2课时
目的要求:1.掌握有关物质的量浓度变化的含义
2.掌握配制一定物质的量浓度溶液的误差分析方法
重点难点:物质的量浓度溶液配制的误差分析
-
讲解:教师用书P34类比迁移
难点探究 误差分析 注意一定要从定义式(或计算式)出发,以配制NaOH溶液为例,具体情况如下: