- 643.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
8-4 难溶电解质的溶解平衡
一、选择题
1.(2011·聊城模拟)下列对沉淀溶解平衡的描述正确的是( )
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,生成沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
解析:本题考查了沉淀溶解平衡的建立与特征。A 项:反应开始时,各离子的浓度没有必然的关系。
B 项正确。C 项沉淀溶解达到平衡时溶液中溶质的离子浓度保持不变,但不一定相等。D 项:沉淀溶解达
到平衡时,如果再加入难溶性的该沉淀物,由于固体的浓度为常数,故平衡不发生移动。
答案:B
2.已知 CuSO4 溶液分别与 Na2CO3 溶液、Na2S 溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO2-
3 +H2O===Cu(OH)2↓+CO2↑
次要:Cu2++CO2-
3 ===CuCO3↓
(2)CuSO4+Na2S
主要:Cu2++S2-===CuS↓
次要:Cu2++S2-+2H2O===Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是( )
A.CuSCu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS D.Cu(OH)2Cu(OH)2,由反应(2)知 Cu(OH)2>CuS。
答案:A
3.已知某难溶电解质 A2B 的 Ksp 为 3.2×10-5,将适量 A2B 固体溶于 100mL 水中至刚好饱和,该过程
中 A+和 B2-浓度随时间变化关系如图。若 t1 时刻在上述体系中加入 100mL 2.0mol·L-1Na2B 溶液,下列示
意图中(实线代表 B2-,虚线代表 A+),能正确表示 t1 时刻后 A+和 B2-浓度随时间变化趋势的是( )
解析:本题考查难溶电解质中离子浓度的变化。难度较大。在 A2B 固体的饱和溶液中 c(A+)=2c(B2-),
c2(A+)·c(B2-)=3.2×10-5,则有 c(A+)=4×10-2mol/L,c(B2-)=2×10-2mol/L。t1 时刻向上述体系中加入
100mL 2.0mol·L-1Na2B 溶液,此时相当于先将原溶液稀释,A+的浓度变成 2×10-2mol/L,B2-的浓度变成
1.01mol/L,Q=c2(A+)·c(B2-)=(2×10-2)2×1.01=4.04×10-4>3.2×10-5,所以会生成 A2B 沉淀,两者的浓
度会减小。
答案:A
4.(2012·郑州高三质检)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成 CuSO4 溶液,向地下
深层渗透,遇到难溶的 ZnS 或 PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是( )
A.相同温度下,CuS 的溶解度大于 PbS 的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4 与 ZnS 反应的离子方程式是 Cu2++S2-===CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
解析:A 项反应向生成更难溶物质的方向转化,故错误;铜蓝(CuS)中硫元素处于最低价态,其化合价
能升高有还原性,B 项错误;ZnS 是难溶物,不能写成 S2-,C 错误,D 正确。
答案:D
5.某温度时,Ag2SO4 在水中的沉淀溶解曲线如下图所示。该温度下,下列说法正确的是( )
A.含有大量 SO 2-
4 的溶液中肯定不存在 Ag+
B.0.02mol/L 的 AgNO3 溶液与 0.2mol/L 的 Na2SO4 溶液等体积混合不会生成沉淀
C.Ag2SO4 的溶度积常数(Ksp)为 1×10-3
D.a 点表示 Ag2SO4 的不饱和溶液、蒸发可以使溶液由 a 点变到 b 点
解析:由图可知 Ksp(Ag2SO4)=c2(Ag+)·c(SO2-
4 )=(2×10-2mol/L)2×5×10-2mol/L=2×10-5mol3/L3,C
错误;B 中,c2(Ag+)·c(SO2-
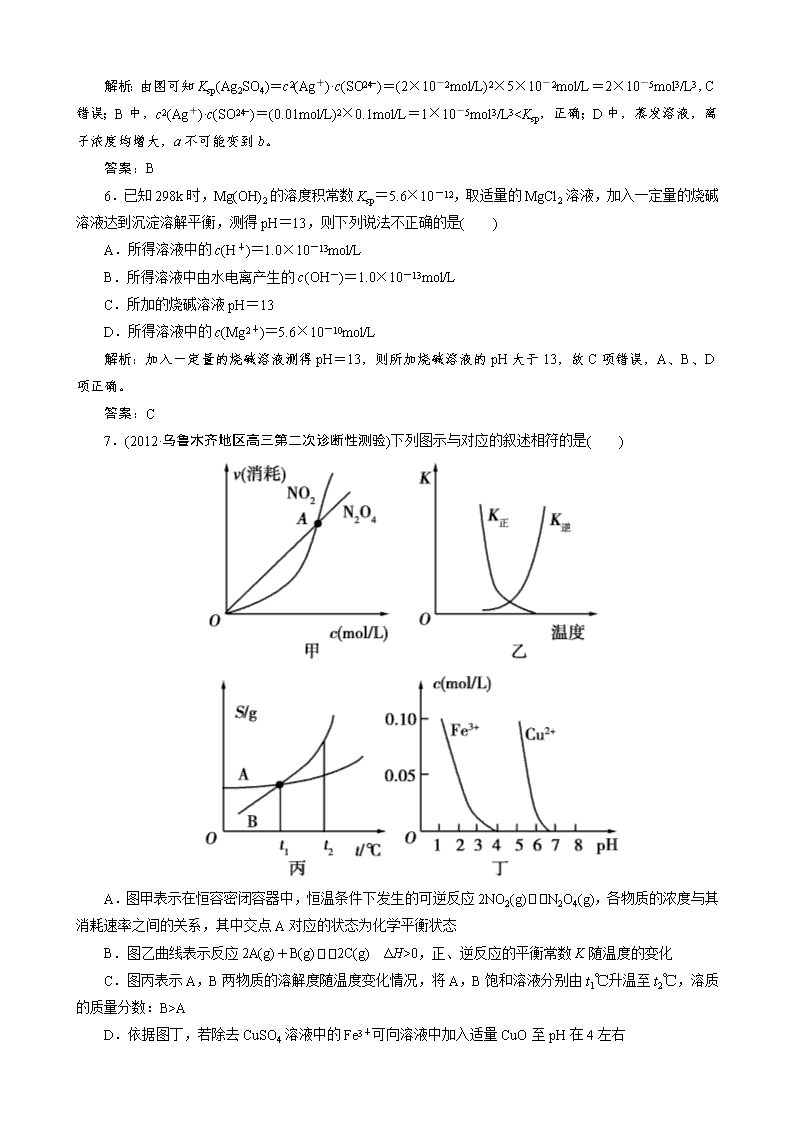
4 )=(0.01mol/L)2×0.1mol/L=1×10-5mol3/L30,正、逆反应的平衡常数 K 随温度的变化
C.图丙表示 A,B 两物质的溶解度随温度变化情况,将 A,B 饱和溶液分别由 t1℃升温至 t2℃,溶质
的质量分数:B>A
D.依据图丁,若除去 CuSO4 溶液中的 Fe3+可向溶液中加入适量 CuO 至 pH 在 4 左右
解析:本题考查化学图像的识别、判断等。难度中等。
A 选项平衡时消耗二氧化氮和四氧化二氮的速率之比应该为 1:2,因此 A 点不平衡点;B 选项正反应
是吸热反应,升高温度平衡右移,平衡常数增大,同理逆反应的平衡常数随温度的升高而减小;C 选项升
高温度两溶液无晶体析出,溶质的质量分不变。
易错点拨:本题容易错选 A,要看清坐标和曲线表示的意义不是通常考生熟悉的速率—时间图像。
答案:D
8.Cu(OH)2 在水溶液中存在着如下沉淀溶解平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),在常温下 Ksp
=2×10-20。在常温下如果要生成 Cu(OH)2 沉淀,需要向 0.02mol/L 的 CuSO4 溶液中加入碱溶液来调溶液
的 pH,使溶液的 pH 大于( )
A.2 B.3 C.4 D.5
解析:由溶液积公式有,Ksp=c(Cu2+)·c2(OH-)=2×10-20,若要使 0.02mol/L 的 Cu2+沉淀,则需 c(OH
-)=1×10-9,再根据水的离子积常数得,c(H+)=1×10-14/1×10-9=1×10-5mol/L,则 pH=5。
答案:D
9.(2013·辽宁省铁岭市六校协作体高三上学期第三次联考)下列说法正确的是( )
A.在 100℃、101kPa 条件下,液态水的气化热为 40.69kJ·mol-1,则 H2O(g) H2O(l)的ΔH=+
40.69kJ·mol-1
B.已知 MgCO3 的 Ksp=6.82×10-6,则所有含有固体 MgCO3 的溶液中,都有 c(Mg2+)=c(CO2-
3 ),且
c(Mg2+)·c(CO2-
3 )=6.82×10-6
C.常温下,在 0.10mol·L-1 的 NH3·H2O 溶液中加入少量 NH4Cl 晶体,能使 NH3·H2O 的电离度降低,
溶液的 pH 减小
D.已知:
共价键 C—C C===C C—H H—H
键能/kJ·mol-1 348 610 413 436
答案:C
10.(2012·济高三调研)已知,常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,下列叙述中,正
确的是( )
A.常温下,AgCl 在饱和 NaCl 溶液中的 Ksp 比在纯水中的 Ksp 小
B.向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色
C.将 0.001mol/L 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀
D.向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-)
解析:Ksp 只是温度的函数,与离子的浓度无关,A 选项错误;碘化银的溶度积远远小于氯化银,因此
氯化银悬浊液中加入碘化钾,氯化银将转化为碘化银,沉淀由白色变为黄色,B 选项正确;因不确定 Cl-、
I-的浓度,无法判断先生成的沉淀是 AgCl 还是 AgI,C 错误;D 选项银离子浓度小于氯离子浓度,错误。
答案:B
11.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下。下列说法正确的是( )
A.温度一定时,Ksp(SrSO4)随 c(SO2-
4 )的增大而减小
B.三个不同温度中,313k 时 Ksp(SrSO4)最大
C.283k 时,图中 a 点对应的溶液是不饱和溶液
D.283k 下的 SrSO4 饱和溶液升温到 363k 后变为不饱和溶液
解析:A 项,Ksp 只与温度有关,与浓度的大小无关,A 项错误。D 项,283k 下的 SrSO4 饱和溶液升
温到 363k 后,因 363k 时的 Ksp 小于 283k 时的 Ksp,故溶液变为过饱和溶液,D 项错误。
答案:BC
12.(2012·潍坊市重点中学高三 4 月模拟)已知 298k 时,Mg(OH)2 的溶度积常数 Ksp=5.6×10-12(MgF2
的溶度积常数 Ksp=7.4×10-11),取适量的 MgCl2 溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得
pH=13.0,则下列说法不正确的是( )
A.所得溶液中 c(H+)=1.0×10-13mol·L-1
B.所得溶液中由水电离产生的 c(OH-)=1.0×10-13mol·L-1
C.所得溶液中的 c(Mg2+)=5.6×10-10mol·L-1
D.298k 时,饱和 Mg(OH)2 溶液与饱和 MgF2 溶液相比前者的 c(Mg2+)大
解析:pH=13.0,c(H+)=1×10-13mol·L-1,A 正确;H+是由水电离出来的,由水电离的 H+和 OH-是
相等的,B 正确;根据 Ksp=c(Mg2+)×c2(OH-)推知 c(Mg2+)= Ksp
c2OH-
=5.6×10-12
10-12
=5.6×10-10mol·L-1,C
正确;饱和 Mg(OH)2 溶液与饱和 MgF2 溶液组成相似,故 Ksp 越大,溶解度越大,所以相比前者的 c(Mg2+)
小,D 错。
答案:D
13.(2011·威海模拟)常温下,Ksp(CaSO4)=9×10-6,常温下 CaSO4 在水中的沉淀溶解平衡曲线见图。
下列说法正确的是( )
A.在任何溶液中,c(Ca2+)、c(SO2-
4 )均相等
B.b 点将有沉淀生成,平衡后溶液中 c(SO2-
4 )一定等于 3×10-3mol·L-1
C.a 点对应的 Ksp 等于 c 点对应的 Ksp
D.d 点通过蒸发可以变到 c 点
答案:B
14.下列对水垢的主要成分是 CaCO3 和 Mg(OH)2 而不是 CaCO3 和 MgCO3 的原因的解释中正确的是
( )
A.Mg(OH)2 的溶度积大于 MgCO3 的溶度积,且在水中发生了沉淀转化
B.MgCO3 水解转化成了更难溶的 Mg(OH)2,在水中发生了沉淀转化
C.MgCO3 电离出的 CO 2-
3 发生水解,使水中 OH-浓度减小,对 Mg(OH)2 的沉淀溶解平衡而言,QcKsp,
生成 Mg(OH)2 沉淀
答案:C
15.(2012·哈尔滨第六中学期末)下列有关平衡常数的说法正确的是( )
A.已知 K= c2CO2·c6H2
c3H2O·cCH3CH2OH
,则对应的化学反应可以表示为:2CO2(g)+6H2(g) CH3CH2OH(g)
+3H2O(g)
B.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数 Ka 将变大
C.常温下,向纯水中加入碳酸钠,水的电离程度变大,KW 变大
D.化学平衡常数 K 与温度有关,随温度的升高,K 可能增大也可能减小,或者不变
解析:据化学平衡常数表达式可知化学反应方程式应表示为:CH3CH2OH(g)+3H2O(g) 2CO2(g)+
6H2(g),A 错;KW 是温度的函数,温度不变,KW 不变,C 错;温度改变,化学平衡常数 K 一定变化,D
错。
答案:B
二、非选择题
16.(2012·北京市海淀区高三第一次模拟)蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有
少量 Fe3+、Al3+、Fe2+等杂质离子)。
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的 0.1mol·L-1 的 H2O2 溶液,再调节溶液
pH 至 7~8,并分离提纯。
Ⅲ.制取氢氧化镁:向步骤Ⅱ所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需 pH 如下表所示。
Fe3+ Al3+ Fe2+ Mg2+
开始沉淀时 1.5 3.3 6.5 9.4
沉淀完全时 3.7 5.2 9.7 12.4
请回答:
(1)步骤Ⅱ中,可用于调节溶液 pH 至 7~8 的最佳试剂是________(填字母)。
A.MgO B.Na2CO3
C.蒸馏水
(2)工业上,常通过 H2O2 溶液滴定滴有铁氰化钾{K3[Fe(CN)6]}的粗硫酸镁溶液来测定粗硫酸镁中 Fe2+
的含量[已知[Fe(CN)3-
6 ]遇 Fe2+会变蓝色]。已知,测定 123g 粗硫酸镁样品所消耗的 0.1mol·L-1 的 H2O2 溶液
的体积如下表所示。
平行测定数据
平均值
实验编号 1 2 3 4
消耗 H2O2 溶液
的体积/mL
0.32 0.30 0.30 0.32 0.2
①Fe2+与 H2O2 溶液反应的离子方程式为____________________
___________________________________________________________________________________________
_________________________,
②根据该表数据,可计算出 123g 粗硫酸镁样品中含 Fe2+________mol。
(3)工业上常以 Mg2+的转化率为考察指标,确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件。其中,反
应温度与 Mg2+转化率的关系如图所示。
①步骤Ⅲ中制备氢氧化镁反应的离子方程式为
___________________________________________________________________________________________
_____________________________________________________。
②根据图中所示 50℃前温度与 Mg2+转化率之间的关系,可判断此反应是________(填“吸热”或“放
热”)反应。
③图中,温度高至 50℃以上 Mg2+转化率下降的原因可能是
________________________________________________________________________。
④Ksp 表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
Ksp=c(Mg2+)·c2(OH-)=5.6×10-12
Ca(OH)2(s) Ca2+(aq)+2OH-(aq)
Ksp=c(Ca2+)·c2(OH-)=4.7×10-6
若用石灰乳替代氨水,________(填“能”或“不能”)制得氢氧化镁,理由是
_______________________________________
___________________________________________________________________________________________
______________。
答案:(1)A
(2)①2Fe2++H2O2+2H+===2Fe3++2H2O
②6.2×10-5
(3)①Mg2++2NH3·H2O===Mg(OH)2↓+2NH+
4
②吸热 ③温度过高时,氨水受热分解,浓度降低,Mg2+的转化率下降 ④能 Mg(OH)2 的溶解度小
于 Ca(OH)2 的,可发生沉淀的转化
17.(2011·宁德模拟)
(1)在粗制 CuSO4·5H2O 晶体中常含有杂质 Fe2+。在提纯时为了除去 Fe2+,常加入合适氧化剂,使 Fe2
+氧化为 Fe3+,下列物质可采用的是________。
A.KMnO4 B.H2O2
C.氯水 D.HNO3
然后再加入适当物质调整至溶液 pH=4,使 Fe3+转化为 Fe(OH)3,可以达到除去 Fe3+而不损失 CuSO4
的目的,调整溶液 pH 可选用下列中的________。
A.NaOH B.NH3·H2O
C.CuO D.Cu(OH)2
(2)甲同学怀疑调整至溶液 pH=4 不一定能达到除去 Fe3+而不损失 Cu2+的目的,乙同学认为可以通过
计算确定,他查阅有关资料得到如下数据,常温下 Fe(OH)3 的溶度积 Ksp=8.0×10-38,Cu(OH)2 的溶度积
Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于 1×10-5mol·L-1 时就认为沉淀完全,设溶液中
CuSO4 的浓度为 3.0mol·L-1,则 Cu(OH)2 开始沉淀时溶液的 pH 为________,Fe3+完全沉淀时溶液的 pH 为
________,通过计算确定上述方案________(填“可行”或“不可行”)。(提示:lg5=0.7)
解析:(1)使 Fe2+氧化为 Fe3+可采用的是 H2O2,然后再加入 CuO 或 Cu(OH)2 调整至溶液 pH=4,若使
用其他试剂,会引入杂质离子。
(2)Cu(OH)2 开始沉淀时溶液中[c(OH-)]2×3.0=3.0×10-20,c(OH-)=1.0×10-10mol·L-1,溶液的 pH 为
4;Fe3+完全沉淀时[c(OH-)]3×1×10-5=8.0×10-38,c(OH-)=2.0×10-11mol·L-1,溶液的 pH 为 3.3;即当
Fe3+完全沉淀时 Cu(OH)2 还未开始沉淀,方案可行。
答案:(1)B CD (2)4 3.3 可行
18.铜、硫的化合物在工农业生产中有重要应用。
(1)工业上由辉铜矿(主要成分为 Cu2S)生产铜的主要反应为:Cu2S+O2=====
高温
2Cu+SO2。该反应中被还
原的元素为________(填元素符号)。
(2)反应(1)中产生的 SO2 尾气可用 NaOH 溶液吸收。若用 1 L 1mol/L 的 NaOH 溶液吸收标准状况下 22.4
L SO2,反应的离子方程式是________;若所得溶液中 c(SO2-
3 )>c(H2SO3),溶液中各离子浓度由大到小的顺
序是__________________。
(3)某温度下 FeS、CuS 的沉淀溶解平衡曲线如图所示,纵坐标 c(M2+)代表 Fe2+或 Cu2+的浓度,横坐标
c(S2-)代表 S2-的浓度。
①在物质的量浓度相等的 Fe2+和 Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为
____________________。
②写出工业上用 FeS 除去废水中 Cu2+的离子方程式______________________。
(4)已知 Cu2O 可以发生如下反应:Cu2O+2H+===Cu2++Cu+H2O。若检验氧化铜中含有氧化亚铜,可
选用的试剂是________(填试剂名称),其实验现象是__________________________。
解析:(1)Cu2S 中铜的化合价是+1 价,由方程式可知化合价降低的元素有铜和氧。
(2)NaOH 与 SO2 按物质的量之比 1:1 反应,恰好生成亚硫酸氢钠。HSO -
3 既能水解,又能电离,而
c(SO2-
3 )>c(H2SO3),说明 HSO -
3 的电离能力大于其水解能力,溶液呈酸性。因 H+还来自水的电离,所以 c(Na
+)>c(HSO-
3 )>c(H+)>c(SO2-
3 )>c(OH-)>c(H2SO3)。
(3)①二者的溶度积常数表达式为:Ksp=c(M2+)×c(S2-),从图示来看 Ksp(FeS)>Ksp(CuS),所以 CuS 更
难溶。
②难溶电解质溶解平衡总是向着更难溶的方向移动,为了不引入新的杂质,可向其中加入 FeS。
(4)根据所给反应可知,若 CuO 中含有 Cu2O,在加入酸后,除溶液为蓝色外,还会产生红色沉淀。但
是在选择酸时应注意不能使用强氧化性酸或引入 NO-
3 。
答案:(1)Cu、O (2)SO2+OH-===HSO-
3
c(Na+)>c(HSO-
3 )>c(H+)>c(SO2-
3 )>c(OH-)
(3)Cu2+ FeS(s)+Cu2+(aq) Fe2+(aq)+CuS(s)
(4)稀盐酸、稀硫酸或硫酸氢钠溶液等 溶液中产生红色固体(或沉淀),溶液为蓝色
19.(2011·南通一调)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,
采用化学沉降法处理含砷废水,相关数据如下表。
表 1:几种砷酸盐的 Ksp
难溶物 Ksp
Ca3(AsO4)2 6.8×10-19
AlAsO4 1.6×10-16
FeAsO4 5.7×10-21
表 2:工厂污染物排放浓度及允许排放标准
污染物 H2SO4 As
浓度 28.42g·L-1 1.6g·L-1
排放标准 pH 6~9 0.5mg·L-1
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度 c(H2SO4)=________mol·L-1。
(2)写出难溶物 Ca3(AsO4)2 的 Ksp 表达式:
Ksp[Ca3(AsO4)2]=________,若混合溶液中 Al3+、Fe3+的浓度均为 1.0×10-4mol·L-1,c(AsO3-
4 )的最大
值是________mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3,弱酸)不易沉降,可投入 MnO2 先将其氧化成五价砷
(H3AsO4,弱酸),写出该反应的离子方程式:____________________________。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节 pH 到 2,再投入生石灰将 pH 调节到 8
左右使五价砷以 Ca3(AsO4)2 形式沉降。
①将 pH 调节到 2 时废水中有大量沉淀产生,沉淀主要成分的化学式为________;
②Ca3(AsO4)2 在 pH 调节到 8 左右才开始沉淀的原因为__________________________________。
解析:(1)c(H2SO4)=
28.42 g
98 g/mol
1 L
=0.29mol/L。
(2)Ksp[Ca3(AsO4)2]=c3(Ca2+)·c2(AsO3-
4 );因为 FeAsO4 的 Ksp 比 AlAsO4 的 Ksp 小,故溶液中 AsO 3-
4 浓度
的最大值以 FeAsO4 的 Ksp 计算,即 c(AsO3-
4 )=5.7×10-21
1.0×10-4 mol/L=5.7×10-17mol/L。
(3)MnO2 作氧化剂,在酸性条件下,锰元素化合价降为+2,则反应的离子方程式为:2H++MnO2+
H3AsO3===H3AsO4+Mn2++H2O。
(4)①将 pH 调节到 2 时废水中有大量沉淀产生,根据题目信息,沉淀不可能是 Ca3(AsO4)2,沉淀的主
要成分应为 CaSO4。②当 pH 调节到 8 左右才开始有 Ca3(AsO4)2 沉淀产生,因为 H3AsO4 是弱酸,在酸性条
件下电离产生的 AsO 3-
4 浓度小,不能形成沉淀,当溶液的 pH 增大时,AsO 3-
4 浓度增大而形成 Ca3(AsO4)2
沉淀。
答案:(1)0.29
(2)c3(Ca2+)·c2(AsO3-
4 ) 5.7×10-17
(3)2H++MnO2+H3AsO3===H3AsO4+Mn2++H2O
(4)①CaSO4 ②H3AsO4 是弱酸,当溶液中 pH 调节到 8 左右时,AsO 3-
4 浓度增大,Ca3(AsO4)2 开始沉
淀