- 1.07 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
选考(30~32)提升标准练(六)
非选择题(本题共3题,每题10分,共30分)
1.氢能是一种极具发展潜力的清洁能源。
(1)氢气的制取与储存是氢能源利用领域的研究热点。
已知:①表示CH4的标准燃烧热的ΔH为-890 kJ·mol-1;②H2的热值为50.2 kJ·g-1,则甲烷部分氧化生成CO2和H2的热化学方程式为 ;该反应自发进行的条件是 。
(2)Bodensteins研究了如下反应:2HI(g)H2(g)+I2(g) ΔH=+11 kJ·mol-1,在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min
0
20
40
60
80
120
x(HI)
1.00
0.910
0.850
0.815
0.795
0.784
x(HI)
0.00
0.600
0.730
0.773
0.780
0.784
①根据上述实验结果,该反应的平衡常数K的计算式为 。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,若k正=9.00 min-1,在t=20 min时,v逆= min-1(保留三位有效数字)。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。在上述平衡基础上,缓慢升高到某一温度,反应重新达到平衡,请在下图中画出此过程的趋势图。
(3)一种可超快充电的新型铝电池,充放电时AlC和Al2C两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为 。
- 7 -
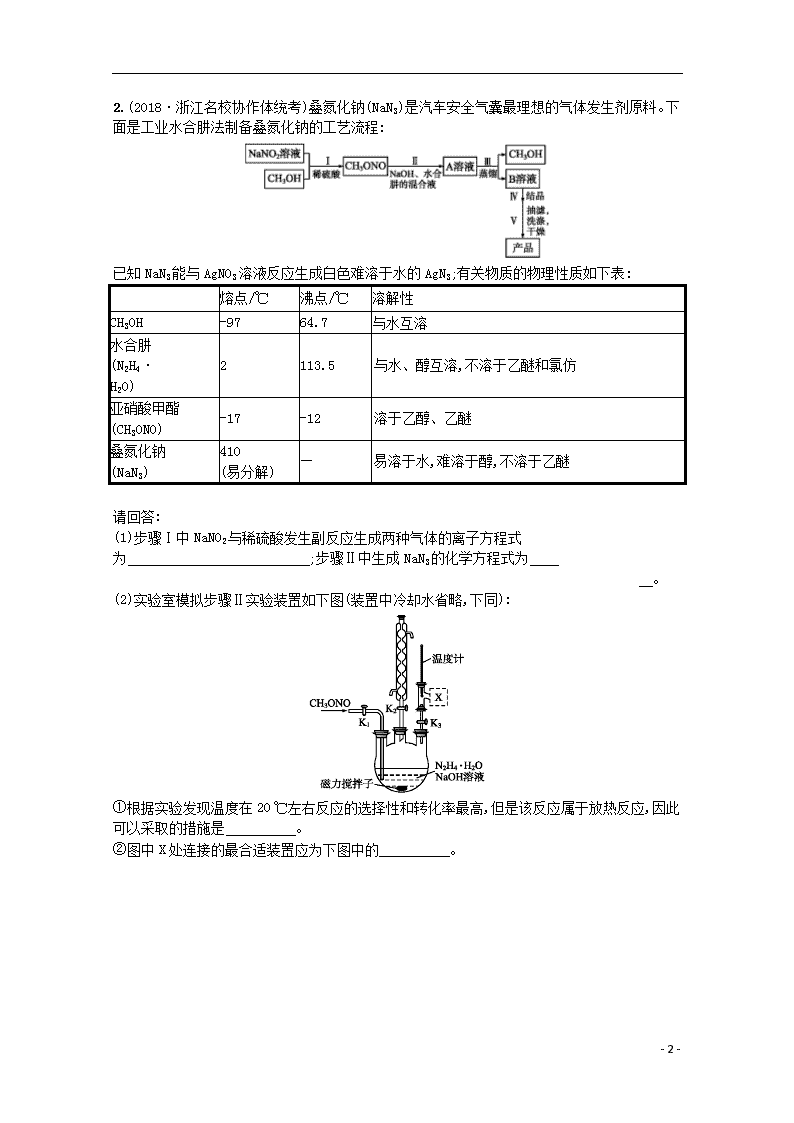
2.(2018·浙江名校协作体统考)叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程:
已知NaN3能与AgNO3溶液反应生成白色难溶于水的AgN3;有关物质的物理性质如下表:
熔点/℃
沸点/℃
溶解性
CH3OH
-97
64.7
与水互溶
水合肼
(N2H4·
H2O)
2
113.5
与水、醇互溶,不溶于乙醚和氯仿
亚硝酸甲酯
(CH3ONO)
-17
-12
溶于乙醇、乙醚
叠氮化钠
(NaN3)
410
(易分解)
—
易溶于水,难溶于醇,不溶于乙醚
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体的离子方程式为 ;步骤Ⅱ中生成NaN3的化学方程式为
。
(2)实验室模拟步骤Ⅱ实验装置如下图(装置中冷却水省略,下同):
①根据实验发现温度在20 ℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是 。
②图中X处连接的最合适装置应为下图中的 。
- 7 -
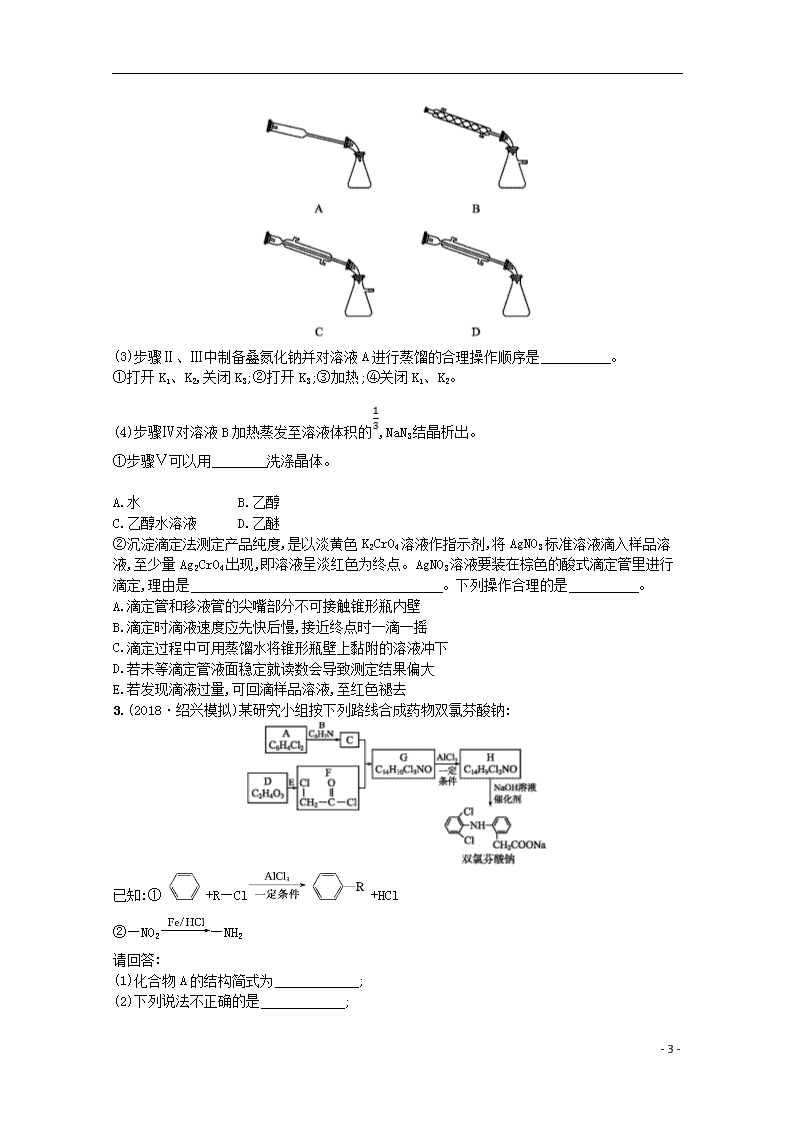
(3)步骤Ⅱ、Ⅲ中制备叠氮化钠并对溶液A进行蒸馏的合理操作顺序是 。
①打开K1、K2,关闭K3;②打开K3;③加热;④关闭K1、K2。
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的,NaN3结晶析出。
①步骤Ⅴ可以用 洗涤晶体。
A.水 B.乙醇
C.乙醇水溶液 D.乙醚
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现,即溶液呈淡红色为终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是 。下列操作合理的是 。
A.滴定管和移液管的尖嘴部分不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上黏附的溶液冲下
D.若未等滴定管液面稳定就读数会导致测定结果偏大
E.若发现滴液过量,可回滴样品溶液,至红色褪去
3.(2018·绍兴模拟)某研究小组按下列路线合成药物双氯芬酸钠:
已知:①+R—Cl+HCl
②—NO2—NH2
请回答:
(1)化合物A的结构简式为 ;
(2)下列说法不正确的是 ;
- 7 -
A.化合物B具有碱性
B.化合物D不能发生自身的缩聚反应
C.化合物G在NaOH水溶液中能发生取代反应
D.药物双氯芬酸钠的分子式为C14H9Cl2NO2Na
(3)写出G→H的化学方程式: ;
(4)以苯和乙烯为原料,设计生成
的合成路线(用流程图表示,无机试剂任选):
;
(5)请用结构简式表示同时符合下列条件的化合物H的同分异构体:
(不考虑立体异构)。
①分子中含有联苯结构()和—OCH3基团;
②1H核磁共振谱显示只有4种不同的氢原子。
参考答案
选考(30~32)提升标准练(六)
1.答案: (1)CH4(g)+O2(g)CO2(g)+2H2(g) ΔH3=-689.2 kJ·mol-1 任意条件均自发进行
(2)①K= ②0.960
③
(3)Al-3e-+7AlC4Al2C
解析: (1)由已知可知CH4燃烧的热化学方程式为①CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-890kJ·mol-1,H2的热值为50.2kJ·g-1,则1molH2完全燃烧生成H2O(l)放出的热量为100.4kJ,其热化学方程式为②H2(g)+O2(g)H2O(l) ΔH=-100.4kJ·mol-1;根据盖斯定律,①-②×2得CH4(g)+O2(g)CO2(g)+2H2(g) ΔH3=-689.2kJ·mol-1。该反应的ΔH<0,ΔS>0,反应任意条件下均可自发进行。
- 7 -
(2)①2HI(g)H2(g)+I2(g)是反应前后气体物质的量不变的反应;反应后x(HI)=0.784,则x(H2)=x(I2)=0.108,K=。
②到达平衡时,v正=v逆,即k正x2(HI)=k逆x(H2)x(I2),k逆=k正·,已知k正=9.00min-1,所以k逆=≈474.3,在t=20min时,x(H2)=x(I2)=0.045,v逆=k逆x(H2)x(I2)=474.3×(0.045)2≈0.960。
(3)原平衡时,x(HI)为0.784,x(H2)为0.108,二者图中纵坐标均约为1.6(因为平衡时v正=v逆),升高温度,正、逆反应速率均增大,对应两点在1.6上面,该反应2HI(g)H2(g)+I2(g) ΔH=+11kJ·mol-1,升高温度,平衡向正反应方向移动,x(HI)减小,x(H2)增大,据此可以画出图像变化,图像如下:
(3)放电时为原电池,金属铝作负极被氧化,根据电子守恒和电荷守恒规律,该电极的电极反应式为Al-3e-+7AlC4Al2C。
2.答案: (1)2N+2H+NO↑+NO2↑+H2O
N2H4·H2O+CH3ONO+NaOHNaN3+CH3OH+3H2O
(2)①冷水浴(或缓慢通入气体等合理答案都可以) ②C
(3)①④②③(或①②④③)
(4)①C ②AgNO3溶液显酸性,且AgNO3易见光分解,浓度减小,使测定产生误差 BCD
解析: (1)NaNO2与稀硫酸反应生成的两种气体为NO、NO2,结合电荷守恒与原子守恒即可写出反应的离子方程式;根据步骤Ⅲ可推知A溶液中含有NaN3、CH3OH,所以CH3ONO与NaOH水合肼混合液反应生成NaN3、CH3OH和H2O。(2)①CH3ONO与NaOH、水合肼的混合液的反应是放热反应,为提高反应的选择性和转化率,则必须使反应温度控制在20℃左右,一般可采用缓慢通入气体来减小反应速率,使热量能及时散失,或者也可用冷水浴冷却三颈烧瓶等。②采用蒸馏的方法分离容器中的CH3OH时,可采用减压蒸馏的方法,有利于提高蒸馏速度,蒸馏时使用直形冷凝管,故C正确。(3)制备NaN3时需打开K1、K2,关闭K3,蒸馏时需打开K3,关闭K1、K2,然后再加热。(4)①NaN3易溶于水,难溶于醇,不溶于乙醚,产品中可能含有水合肼、CH3OH、CH3ONO等杂质,为了能除去杂质,同时确保减少产品的损失,可采用乙醇水溶液进行洗涤,C正确。②AgNO3属于强酸弱碱盐,溶液显酸性,且AgNO3
- 7 -
易见光分解,会导致浓度发生变化,所以要装在棕色的酸式滴定管中进行实验。移液管的尖嘴部分应紧靠锥形瓶内壁,有利于溶液流下,A错误;滴定时,起始待测溶液的浓度较大,可以用较快的滴速进行滴定,接近终点时需一滴一滴进行滴定,并且要充分振荡,B正确;锥形瓶中的溶液附着在内壁,会减少消耗标准液的体积,导致实验误差较大,所以实验过程中需要用蒸馏水将锥形瓶壁上黏附的溶液冲下,C正确;滴定过程中滴定管中的液面不断下降,但由于溶液会附着在滴定管内壁,所以若未等滴定管液面稳定就读数,会使实验后滴定管的读数偏大,导致测定结果偏高,D正确;滴定终点是以产生少量Ag2CrO4,溶液呈淡红色为标志,若滴定过量时,会产生Ag2CrO4沉淀,再回滴样品溶液,沉淀也不可能溶解,E错误。
3.答案: (1) (2)BD
(3)+HCl
(4)
(5)、
、、
解析: 由双氯芬酸钠的结构简式推知,A中含有苯环,且与C6H7N反应生成的C中含有类似双氯芬酸钠的结构,则A为,B为苯胺(),由C+F→G及G的分子式推知G为;G→H发生了类似题给信息的反应,所以H为;H在NaOH溶液中发生水解得到
- 7 -
。(2)A项,苯胺分子中含有氨基,具有碱性,正确;B项,根据F的结构简式及D的分子式推知D为HOCH2COOH,分子中既有羟基,又有羧基,能发生自身的缩聚反应,错误;C项,分子中含有肽键,在NaOH溶液中能发生水解反应,水解反应属于取代反应,正确;D项,的分子式为C14H10Cl2NO2Na,错误。(3)在AlCl3作用下反应生成和HCl。(4)苯与乙烯发生加成反应生成乙苯,乙苯与浓硫酸、浓硝酸的混合物发生硝化反应生成对硝基乙苯,对硝基乙苯被酸性KMnO4溶液氧化得到,然后根据信息提示,
在Fe/HCl作用下生成
,即可写出合成路线。(5)分子中含有联苯结构和—OCH3,则分子中含有—CN基团;分子中只有4种不同的氢原子,则分子存在对称面,即—OCH3、—CN处于对称面上,另2个氯原子关于该对称面对称,所以符合条件的结构有、、、。
- 7 -