- 2.97 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
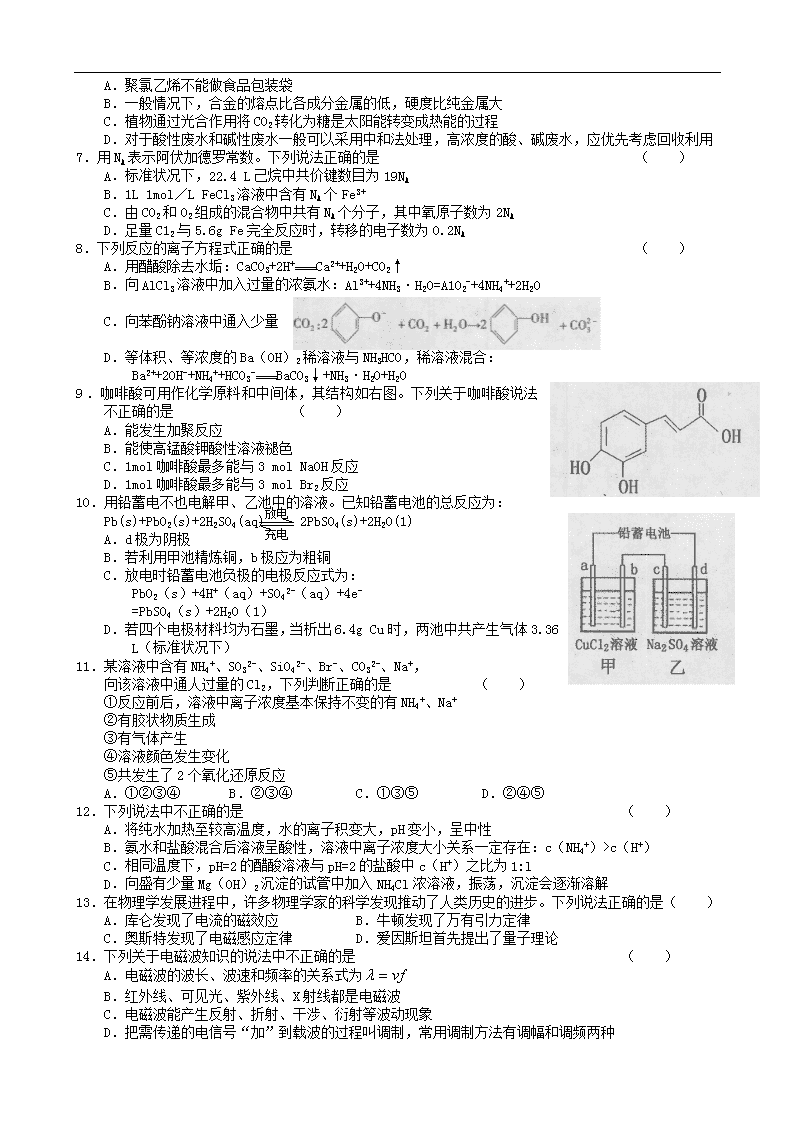
2013高考百天仿真冲刺卷
理 综 试 卷(七)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 P 31 Cu 64 Hg 201
第Ⅰ卷(选择题 共120分)
本卷共20小题,每小题6分,共120分。在每小题列出的四个选项中,选出符合题目要求的一项。
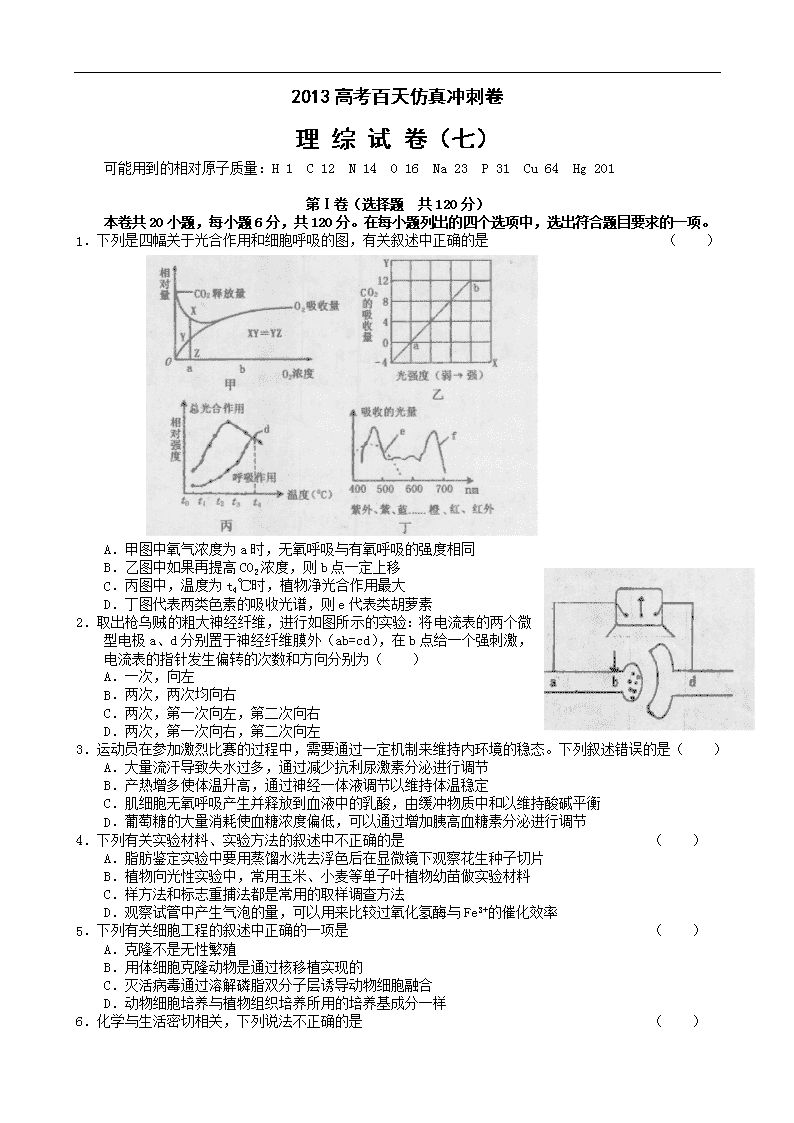
1.下列是四幅关于光合作用和细胞呼吸的图,有关叙述中正确的是 ( )
A.甲图中氧气浓度为a时,无氧呼吸与有氧呼吸的强度相同
B.乙图中如果再提高CO2浓度,则b点一定上移
C.丙图中,温度为t4℃时,植物净光合作用最大
D.丁图代表两类色素的吸收光谱,则e代表类胡萝素
2.取出枪乌贼的粗大神经纤维,进行如图所示的实验:将电流表的两个微型电极a、d分别置于神经纤维膜外(ab=cd),在b点给一个强刺激,电流表的指针发生偏转的次数和方向分别为( )
A.一次,向左
B.两次,两次均向右
C.两次,第一次向左,第二次向右
D.两次,第一次向右,第二次向左
3.运动员在参加激烈比赛的过程中,需要通过一定机制来维持内环境的稳态。下列叙述错误的是( )
A.大量流汗导致失水过多,通过减少抗利尿激素分泌进行调节
B.产热增多使体温升高,通过神经一体液调节以维持体温稳定
C.肌细胞无氧呼吸产生并释放到血液中的乳酸,由缓冲物质中和以维持酸碱平衡
D.葡萄糖的大量消耗使血糖浓度偏低,可以通过增加胰高血糖素分泌进行调节
4.下列有关实验材料、实验方法的叙述中不正确的是 ( )
A.脂肪鉴定实验中要用蒸馏水洗去浮色后在显微镜下观察花生种子切片
B.植物向光性实验中,常用玉米、小麦等单子叶植物幼苗做实验材料
C.样方法和标志重捕法都是常用的取样调查方法
D.观察试管中产生气泡的量,可以用来比较过氧化氢酶与Fe3+的催化效率
5.下列有关细胞工程的叙述中正确的一项是 ( )
A.克隆不是无性繁殖
B.用体细胞克隆动物是通过核移植实现的
C.灭活病毒通过溶解磷脂双分子层诱导动物细胞融合
D.动物细胞培养与植物组织培养所用的培养基成分一样
6.化学与生活密切相关,下列说法不正确的是 ( )
A.聚氯乙烯不能做食品包装袋
B.一般情况下,合金的熔点比各成分金属的低,硬度比纯金属大
C.植物通过光合作用将CO2转化为糖是太阳能转变成热能的过程
D.对于酸性废水和碱性废水一般可以采用中和法处理,高浓度的酸、碱废水,应优先考虑回收利用
7.用NA表示阿伏加德罗常数。下列说法正确的是 ( )
A.标准状况下,22.4 L己烷中共价键数目为19NA
B.1L 1mol/L FeCl3溶液中含有NA个Fe3+
C.由CO2和O2组成的混合物中共有NA个分子,其中氧原子数为2NA
D.足量C12与5.6g Fe完全反应时,转移的电子数为0.2NA
8.下列反应的离子方程式正确的是 ( )
A.用醋酸除去水垢:CaCO3+2H+ Ca2++H2O+CO2↑
B.向AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O=A1O2-+4NH4++2H2O
C.向苯酚钠溶液中通入少量
D.等体积、等浓度的Ba(OH)2稀溶液与NH3HCO,稀溶液混合:
Ba2++2OH-+NH4++HCO3- BaCO3↓+NH3·H2O+H2O
9.咖啡酸可用作化学原料和中间体,其结构如右图。下列关于咖啡酸说法不正确的是 ( )
A.能发生加聚反应
B.能使高锰酸钾酸性溶液褪色
C.1mol咖啡酸最多能与3 mol NaOH反应
D.1mol咖啡酸最多能与3 mol Br2反应
放电
充电
10.用铅蓄电不也电解甲、乙池中的溶液。已知铅蓄电池的总反应为:
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(1)
A.d极为阴极
B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:
PbO2(s)+4H+(aq)+SO42-(aq)+4e-
=PbSO4(s)+2H2O(1)
D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36 L(标准状况下)
11.某溶液中含有NH4+、SO32-、SiO42-、Br-、CO32-、Na+,
向该溶液中通人过量的Cl2,下列判断正确的是 ( )
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤共发生了2个氧化还原反应
A.①②③④ B.②③④ C.①③⑤ D.②④⑤
12.下列说法中不正确的是 ( )
A.将纯水加热至较高温度,水的离子积变大,pH变小,呈中性
B.氨水和盐酸混合后溶液呈酸性,溶液中离子浓度大小关系一定存在:c(NH4+)>c(H+)
C.相同温度下,pH=2的醋酸溶液与pH=2的盐酸中c(H+)之比为1:l
D.向盛有少量Mg(OH)2沉淀的试管中加入NH4Cl浓溶液,振荡,沉淀会逐渐溶解
13.在物理学发展进程中,许多物理学家的科学发现推动了人类历史的进步。下列说法正确的是( )
A.库仑发现了电流的磁效应 B.牛顿发现了万有引力定律
C.奥斯特发现了电磁感应定律 D.爱因斯坦首先提出了量子理论
14.下列关于电磁波知识的说法中不正确的是 ( )
A.电磁波的波长、波速和频率的关系式为
B.红外线、可见光、紫外线、X射线都是电磁波
C.电磁波能产生反射、折射、干涉、衍射等波动现象
D.把需传递的电信号“加”到载波的过程叫调制,常用调制方法有调幅和调频两种
15.有关放射性知识,下列说法中正确的是 ( )
A.衰变是原子核内的中子转化成质子和电子从而放出电子的过程
B.射线一般伴随着或射线产生,这三种射线中,射线电离能力最强
C.由核反应方程可知核反应前后质量守恒、核电荷数守恒
D.氡的半衰期为3.8天,若取4个氡原子核,经7.6天后就一定剩下一个氡原子核
16.如图所示为一直角棱镜的横截面,,一平行细光束从O点沿垂直于bc面的方向射人棱镜,已知棱镜材料的折射率,若不考虑原入射光在面上的反射光,则下列说法中正确的是 ( )
A.部分光线从面射出
B.光线在面上发生全反射
C.部分光线从bc面射出,且与面斜交
D.部分光线从面射出,且与面垂直
17.我国自主研制的“神州七号”载人飞船于2008年9月25日21时10分04秒,在酒泉卫星发射中心成功发射。第583秒火箭将飞船送到近地点200km,远地点350km的椭圆轨道的的入口,箭船分离。21时33分变轨成功,飞船进入距地球表面约343km的圆形预定轨道,绕行一周约90分钟。下列关于“神州七号”载人飞船在预定轨道上运行时的说法中正确的是 ( )
A.“神州七号”载人飞船在圆形轨道上飞行的线速度比第一宇宙速度大
B.飞船由于完全失重,飞船中的宇航员不再受到重力的作用
C.当飞船要离开圆形轨道返回地球时,要启动助推器让飞船速度减小
D.飞船绕地球运行的角速度比月球绕地球运行的角速度小
18.质量为0.3kg的物体在水平面上直线运动,图中两条直线分别表示物体受水平拉力时和不受水平拉力时的v―t图象,则下列说法中正确的是 ( )
A.物体受到的摩擦力一定等于0.1N
B.物体受到的水平拉力一定等于0.1N
C.物体不受水平拉力时的v―t图象一定是a
D.物体不受水平拉力时的v―t图象一定是b
19.如图所示,空间存在水平向左的匀强电场和垂直纸
面向里的匀强磁场,电场和磁场相互垂直。在电磁
场区域中,有一个竖直放置的光滑绝缘圆环,环上
套有一个带正电的小球。O点为圆环的圆心,a、b、
c为圆环上的三个点,O点为最高点,c点为最低点,
Ob沿水平方向。已知小球所受电场力与重力大小相等。现将小球从环的顶端。点由静止释放。下列判断正确的是 ( )
A.当小球运动的弧长为圆周长的l/4时,洛仑兹力最大
B.当小球运动的弧长为圆周长的1/2时,洛仑兹力最大
C.小球从O点到b点,重力势能减小,电势能增大
D.小球从b点运动到c点,电势能增大,动能先增大后减小
20.如图所示,有一匀强磁场分布在一个半径为尺的圆形区域内,并以变化率均匀变化。长度为L的圆弧形金属棒按图中形式放置,圆弧圆心与圆形磁场的中心重合。下面给出了此圆弧形金属棒中产生的感应电动势的表达式,其中只有一个是合理的。你可能不会求解此圆弧形金属棒中产生的感应电动势,但是你可以通过一定的物理分析,对下列表达式的合理性做出判断。根据你的判断,此圆弧形金属棒中产生的感应电动势的合理表达式为 ( )
A. B.
C. D.
第Ⅱ卷 (非选择题共180分)
21.(1)(8分)有一个小灯泡上标有“4.8V 2W”的字样,现在描绘小灯泡的伏安特性曲线。有下列器材可供选用:
A.电压表v(0~3V,内阻3kΩ) B.电流表A(0~0.6A,内阻约1Ω)
C.定值电阻R1=3kΩ D.定值电阻R2=15kΩ
E.滑动变阻器RW1(10Ω,2A) F.滑动变阻器Rw2(1000Ω,0.5A)
G.学生电源(直流6V,内阻不计) H.开关、导线若干
请根据要求完成以下问题:
①提供的电压表不能满足实验要求,可以 联一个定值电阻使电压表V的量程扩大为6v,定值电阻应选用 (用序号字母填写);
②为尽量减小实验误差,并要求电压、电流从零开始多取几组数据,所以实验中滑动变阻器应选用 (用序号字母填写);
③请在方框内画出满足实验要求的电路图;
④利用上述实验电路图测出的电压表读数UV与此时小灯泡两端电压U的定量关系是 。
(2)(10分)某同学在“用单摆测定重力加速度”的实验中进行了如下的实践和探究:
①用游标卡尺测量摆球直径的示数部分如上左图所示,则摆球直径为 cm。
把摆球用细线悬挂在铁架台上,测量摆长L。
②用秒表测量单摆的周期。当单摆摆动稳定且到达最低点时开始计时并记为0,单摆每经过最低点记一次数,当数到n=60时秒表的示数如上右图所示,则该单摆的周期为T= s(结果保留三位有效数字)。
③测量出多组周期r、摆长L数值后,画出T0—L图象如图,则此图线的斜率的物理意义是 ( )
A.g B.
C. D.
④测量结果与真实的重力加速度值比较,发现测量结果偏大,分析原因可能有 ( )
A.振幅偏小
B.在未悬挂单摆之前先测定摆长
C.将摆线长当成了摆长
D.将摆线长与球的直径之和当成了摆长
⑤设计其它的测量重力加速度的方案。现提供如下的器材:
A.弹簧测力计
B.打点计时器、复写纸和纸带
C.低压交流电源(频率为50Hz)和导线
D.铁架台
E.重物
F.天平
G.刻度尺
请你选择适合的实验器材,写出需要测量的物理量,并用测量的物理量写出重力加速度的表达式。(只要求写出一种方案)
22.(16分)
某型号小汽车发动机的额定功率为60kw,汽车质量为1×103kg,在水平路面上正常行驶中所受到的阻力为车重的0.15倍。g取10m/s3。求解如下问题:
(1)此型号汽车在水平路面行驶能达到的最大速度是多少?
(2)若此型号汽车以额定功率加速行驶,当速度达到20m/s时的加速度大小是多少?
(3)质量为60kg的驾驶员驾驶此型号汽车在水平高速公路上以30m/s的速度匀速行驶,设轮胎与路面的动摩擦因数为0.60,驾驶员的反应时间为0.30s,则驾驶员驾驶的汽车与前车保持的安全距离最少为多少?
23.(18分)
如图所示,电阻不计的两光滑金属导轨相距L,放在水平绝缘桌面上,半径为R的l/4圆弧部分处在竖直平面内,水平直导轨部分处在磁感应强度为B,方向竖直向下的匀强磁场中,末端与桌面边缘平齐。两金属棒ab、cd垂直于两导轨且与导轨接触良好。棒ab质量为2 m,电阻为r,棒cd的质量为m,电阻为r。重力加速度为g。
开始时棒cd静止在水平直导轨上,棒ab从圆弧顶端无初速度释放,进入水平直导轨后与棒cd始终没有接触并一直向右运动,最后两棒都离开导轨落到地面上。棒ab与棒cd落地点到桌面边缘的水平距离之比为1:3。求:
(1)棒ab和棒cd离开导轨时的速度大小;
(2)棒cd在水平导轨上的最大加速度;
(3)两棒在导轨上运动过程中产生的焦耳热。
24.(20分)
如图所示,两块平行金属板MN、PQ水平放置,两板间距为d、板长为L,在紧靠平行板右侧的等边三角形区域内存在着匀强磁场,磁场方向垂直纸面向里,三角形底边BG与PQ在同一水平线上,顶点A与MN在同一水平线上。
一个质量为m、电量为+q的粒子沿两板中心线以初速度v0水平射入,若在两金属板间加某一恒定电压,粒子离开电场后垂直AB边从D点进入磁场,BD=AB,并垂直AC边射出(不计粒子的重力)。求:
(1)两金属板问的电压;
(2)三角形区域内磁感应强度大小;
(3)若两金属板问不加电压,三角形区域内的磁场方向垂直纸面向外。要使粒子进入场区域后能从BC边射出,试求所加磁场的磁感应强度的取值范围。
25.(16分)
有机物A是重要的合成原料,在医药、染料、香料等行业有着广泛的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→C,G→麻黄碱的部分反应物和条件):
请回答下列问题:
(1)关于麻黄碱下列说法正确的是 (填字母)。
a.麻黄碱的分子式为C15H15NO
b.具有止咳平喘作用,是从中药麻黄中提取的生物碱
c.属于国际奥委会严格禁止的兴奋剂
d.麻黄碱属于芳香烃
(2)已知有机物A的相对分子质量为106,A中含碳、氢、氧的质量分数之比为42:3:8,
则A的含氧官能团名称是 ;检验该官能团的方法是
(3)反应①~⑤中属于取代反应的是 (填序号)。
(4)写出D~B的化学方程式 。
(5)F可作多种香精的定香剂,请写出B和C反应生成F的化学方程式 。
(6)写出符合下列条件的同分异构体的结构简式 。
①与中间产物G互为同分异构体
②既能发生消去反应,又能发生酯化反应
③苯环上的一氯取代物只有两种,分子结构中没有甲基
(7)已知:
溶解性
沸点
A
微溶于水
179.0℃
E
不溶于水
110.8℃
A可以由E制取,制取工艺中得到的是A、E混合物,分离该混合物的方法是 。
26.(16分)
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为 。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为 。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
③常温下,若电解lL 0.1mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为完全转化,则混合物x中含有的物质有 。
27.(16分)
为探究如何尽可能多的使NO2被水吸收,某活动小组设计并完成了以下实验。
(1)活动小组同学利用铜与浓硝酸反应制取NO2、过氧化氢溶液与MnO2制取O2。
①根据反应原理他们选用了相同的装置 (填“图l”或“图2”)分别制取NO2和O2。
②写出铜与浓硝酸反应的离子方程式 。
③过氧化氢溶液与MnO2制取O2时MnO2的作用是 。
④收集NO2的方法是 。
(2)活动小组的同学做了如下准备工作:用气囊收集好纯净的O2,收集了一试管NO2,用干燥的烧瓶收集了一定比例的NO2和O2的混合气体。
①为了尽可能多的使NO2被水吸收,并达到较好的实验效果,利用图3吸收气体时,用气囊通入O2与直接利用制气装置制取并通人O2相比,其优点是 。
②利用图4吸收气体时,其操作和现象为 。
③NO2、H2O反应的产物为硝酸,反应中NO2和O2物质的量之比a:b= ;若图4中混合气体NO2和O2比例为a:b,当混合气体全部被吸收时所得溶液物质的量浓度为 mol/L(保留两位有效数字)。
28.(10分)
汽车尾气中含有CO和氮氧化物。治理尾气的方法是在排气管上安一个催化转化器,可发生如下反应:2NO+2CO N2+2CO2。
(1)2NO(g)+2CO(g) N2(g)+2CO2(g)反应的平衡常数的表达式为:
K= 。
(2)已知:CO(g)+O2(g)+2CO2(g) △H=-283 kJ/mol
N2(g)+O2(g)=2 NO(g) △H=+180 kJ/mol
则反应2NO(g)+2CO(g) N2(g)+2CO2(g)△H= kJ/mol。
(3)对于可逆反应2NO(g)+2CO(g) N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是 。
①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③在单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2和CO2的方向移动
(4)下列说法正确的是
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气在高温条件下生成的
(5)实验室可利用NaOH溶液吸收CO2,标准状况下2.24LCO2气体被1.5L 0.1mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成NaCO3的物质的量为 mol。
29.(16分)
某实验小组为了探究细胞膜的通透性,将小鼠肝细胞在体外培养一段时间后,检测培养液中的氨基酸、葡萄糖和尿素含量,发现它们的含量发生了明显的变化(如图)。请回答问题。
(1)由图可知,随培养时间延长,培养液中葡萄糖和氨基酸含量 ,尿素含量 。由于在原培养液中没有尿素,推则其是 的产物。
(2)培养液中的氨基酸进入细胞后,可用于合成细胞中 、 、 、
(写出四种细胞结构)上的蛋白质。被吸收的葡萄糖主要通过 (生理过程)为细胞提供能量。
(3)转氨酶是肝细胞内参与氨基酸分解与合成的一类酶,正常情况下这类酶不会排出细胞外,若在细胞培养液中检测到该类酶,可能的原因是 。
(4)由(1)和(3)可初步判断,细胞膜对物质的转运具有 的特性。
30.(16分)
日本明蟹壳色有三种情况:灰白色、青色和花斑色。其生化反应原理如图所示。基因A控制合成酶1,基因B控制合成酶2,基因b控制合成酶3。基因a控制合成的蛋白质无酶1活性,基因a纯合后,物质甲(尿酸盐类)在体内过多积累,导致成体会有50%死亡。甲物质积累表现为灰白色壳,丙物质积累表现为青色壳,丁物质积累表现为花斑色壳。请回答:
(1)明蟹的青色壳是由 对基因控制的。青色壳明蟹的基因型有 种,分别是 。
(2)两只青色壳明蟹交配,后代成体只有灰白色明蟹和青色明蟹,且比例为1:6。亲本基因型组合为 或 。
(3)基因型为AaBb的两只明蟹杂交,后代的成体表现为 ,其比例为 。
(4)从上述实验可以看出,基因通过控制 来控制代射过程,进而控制生物体的性状。
31.(18分)某科研单位在调查湖水中细菌的污染情况进行了实验。实验包括制备培养基、灭菌、接种及培养、菌落观察计数。
(1)培养基中含有蛋白胨、淀粉分别为细菌培养提供了 。对培养基进行灭菌,应该采用的方法是 。接种时通常采用 方法,把聚集的菌种逐步分散到培养基的表面。如果提高培养基中NaCl的浓度,可以用于筛选耐盐细菌,这种培养基被称为 。
(2)该细菌所含的耐盐基因可通过酶切法获取,作为基因工程中的目的基因导入小麦中,其过程如右图所示。其中A为 ,耐盐基因的小麦细胞还应经过 ,在此过程中还将使用 两种植物激素,从而最终可获取含耐盐基因的小麦植株,当然这些小麦植株并不一定具有耐盐的特性,这是因为 。
(3)图中C还可用于其他工程细菌中,若成功导入大肠杆菌内,则可能使大肠杆菌获得哪些特性?
。
2013高考百天仿真冲刺卷
理综试卷(七)参考答案
第Ⅰ卷(选择题 共120分)
本卷共20小题,每小题6分,共120分.在每小题列出的四个选项中,选出符合题目要求的一项.
题号
1
2
3
4
5
6
7
8
9
10
答案
D
C
A
A
B
C
C
D
D
B
题号
11
12
13
14
15
16
17
18
19
20
答案
A
B
B
A
A
D
C
B
D
A
第Ⅱ卷(非选择题 共180分)
21.(1)(8分,每小题2分)
①串、C ②E
③见电路图 ④U=2UV
(2)(10分,每小题2分)
①2.06cm ②2.24s
③C ④D
⑤方案一:AEF,重物的重力G、重物的质量
方案二:BCDEG,连续相等时间内的位移之差,(其它方案只要合理均给分)
22.解(4分)
(1)当汽车发动机达到额定功率并做匀速运动时,汽车达到最大速度,此时发动机牵引力等于所受到的阻力,
(4分)
(4分) (2)此汽车以额定功率启动,设速度达到20m/s时的发动机牵引力为F1,
汽车加速度为a1
(2分)
(2分)
(8分)(3)当出现紧急情况时,汽车争刹车,受到的制动力最大等于汽车轮胎与地面的滑动摩擦力
(1分)
此时汽车的加速度为 (2分)
则汽车的刹车距离为 (2分)
汽车在司机反应时间内行驶的距离为 (2分)
则此汽车与前车保持的安全距离为 (1分)
23.解:(8分)
(1)设ab棒进入水平导轨的速度为v1,ab棒从圆弧导轨滑下机械能定恒:
① (2分)
离开导轨时,设ab棒的速度为棒的速度为棒与棒在水平导轨上运动,
动量定恒,
② (2分)
依题意,两棒离开导轨做平抛运动的时间相等,
由平热量运动水平位移可知
③ (2分)
联立①②③解得 (2分)
(6分)(2)ab棒刚进入水平导轨时,cd棒受到的安培力最大,此时它的加速度最大,设此时回路的感应电动势为 ④ (1分)
⑤ (1分)
cd棒受到的安培力为: ⑥ (1分)
根据牛顿第二定律,cd棒有最大加速度为
⑦ (1分)
联立④⑤⑥⑦解得:
(2分)
(4分)(3)根据能量定恒,两棒在轨道上运动过程产生的焦耳热为:
⑧ (2分)
联立①⑧并代入解得:
(2分)
24.解:(6分)
(1)粒子在两块平行金属板间的电场中,沿水平方向做匀速运动,竖直方向做初速度为零的匀加速运动。
粒子垂直AB边进入磁场,由几何知识得,粒子离开电场时偏角。根据类平抛运动的规律有:
① (1分)
② (1分)
③ (1分)
④ (1分)
联立①②③④解得: (2分)
(8分)(2)由几何关系得:
粒子在磁场中做圆周运动的轨道半径为:
⑤ (2分)
粒子进入磁场时的速率为: ⑥ (2分)
根据向心力公式有: ⑦ (2分)
联立⑤⑥⑦解得: (2分)
(6分)(3)若两板间不加电压,粒子将沿水平以速率v0从AB边的中点进入磁场。
当粒子刚好从C点射出磁场,磁感应强度最小。设磁感应强度的最小值为B2,
由几何关系知,对应粒子的最大轨道半径r2为:r2=d (1分)
根据向心力公式有: (1分)
解得: (1分)
当粒子刚好从E点射出磁场时,磁感应强度最大。
设磁感应强度的最大值为B3,由几何关系知,
对应粒子的最小轨道半径r3为:(1分)
同上解出: (1分)
所以所加磁场的磁感应强度的取值范围为 (1分)
25.(16分,每空2分)
(1)a b c(错选0分,漏选扣1分)
(2)醛基 在试管里加入10%的氢氧化钠溶液2mL,滴加2%的硫酸铜溶液4~6滴,得到新制的氢氧化铜,振荡后加入A的溶液0.5mL;加热,得到红色沉淀。(或在新制的银氨溶液中滴加A的溶液,振荡后半试管放在热水浴中温热,产生银镜。)
(3)①②⑤(错选0分,漏选扣1分)
(4)
(本题方程式缺少条件或条件不对扣1分)
(5)
(本本题方程式缺少条件或条件不对扣1分)
(6)
(7)蒸馏
26.(16分)
(1)Na>Cl>F(2分)
(2)HClO4>H2SO4(全对2分)
(3)
H2O2+2Fe2++2H+ 2Fe3++2H2O(2分)
(4)①2Al+2NaOH+2H2O 2NaAlO2+3H2↑(2分)
②取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色生成(2分)
③0.01(2分)
④Al(OH)3 H2O、NaCl(答对Al(OH)3给1分,全对给2分)
27.(16分)
(1)①图2(2分)
②Cu+4H++2NO-3 Cu2++2NO2↑+2H2O(2分)
③催化剂(2分)
④瓶口向上排空气法(2分)
(2)①有利于控制氧气气流的速度(控制氧气的量)(2分)
②将胶头滴管中的水挤压进烧瓶,然后打开止水夹,可以看到烧杯中的水进入烧瓶形成喷泉(2分)
③4:1(2分)0.036(2分)
28.(10分)
(1)(2分)
(2)-746(2分)
(3)③④(2分)
(4)②③(2分)
(5)0.05(2分)
29.(除特殊说明外每空2分,共16分)
(1)下降 上升 细胞代射(氨基酸分解)
(2)细胞膜、内质网、高尔基体、核糖体、中心体、染色体、核糖、溶酶体、细胞骨架(液泡不对,其他结构合理给分,每空1分) 有氧呼吸
(3)肝细胞受损,细胞膜的通透性增加
(4)选择透过(性)
30.(每空2分,共16分)
(1)两 4 AaBB、AABb、AaBb、AABB
(2)AaBB×AaBB AaBB×AaBb
(3)青色、花斑色、灰白色 9:3
(4)酶的合成
31.(除特殊说明外每空2分,共18分)
(1)氮源(碳源)、碳源(按顺序答对1个给1分) 高压蒸汽灭菌
平板划线 选择培养基
(2)(运)载体 植物组织培养 生长素和细胞分裂素(答对1个给1分)
目的基因未表达(或:基因选择性表达)
(3)耐盐、抗氧苄青霉素(答对1个给1分)
版权所有:高考资源网(www.ks5u.com)
版权所有:高考资源网(www.ks5u.com)