- 326.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
金属晶体
【本讲教育信息】
一. 教学内容:
金属晶体
二、教学目标
理解金属键的概念和电子气理论,学会用电子气理论解释金属的物理性质;
了解金属晶体内原子的几种常见排列方式
三、教学重点、难点
金属键和电子气理论;金属晶体内原子的空间排列方式
四、教学过程:
(一)金属键及电子气理论对金属键的解释:
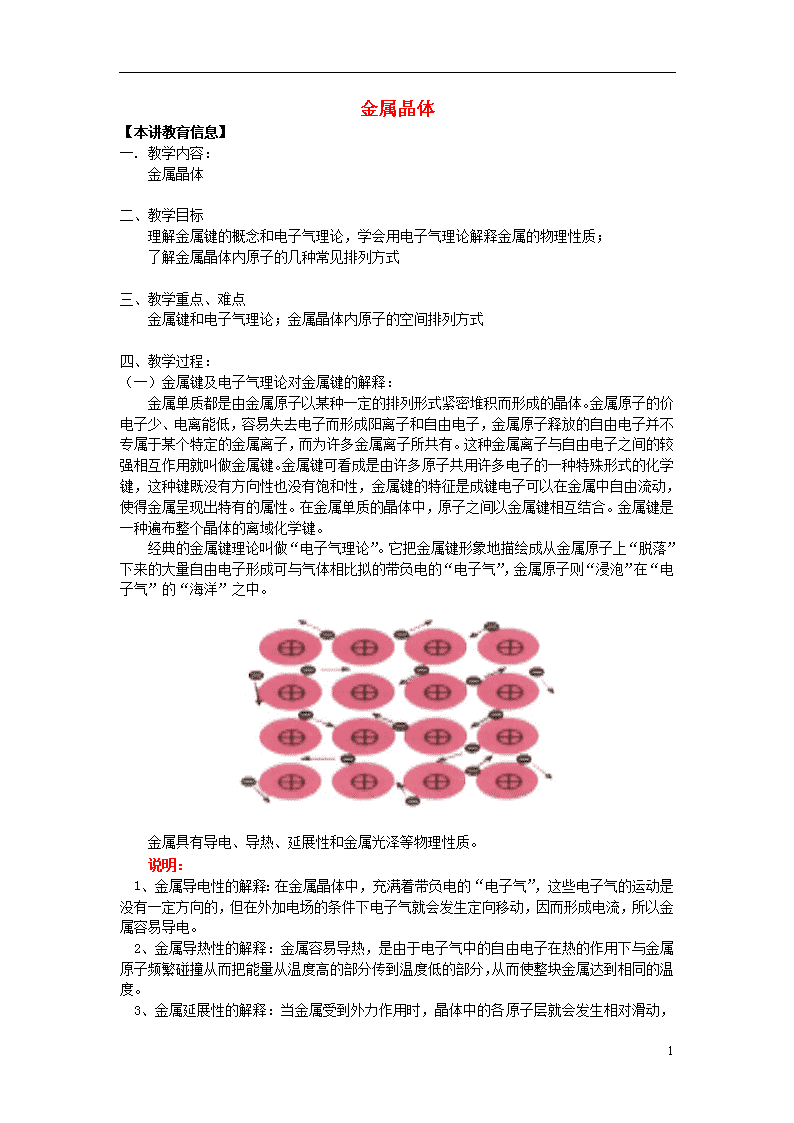
金属单质都是由金属原子以某种一定的排列形式紧密堆积而形成的晶体。金属原子的价电子少、电离能低,容易失去电子而形成阳离子和自由电子,金属原子释放的自由电子并不专属于某个特定的金属离子,而为许多金属离子所共有。这种金属离子与自由电子之间的较强相互作用就叫做金属键。金属键可看成是由许多原子共用许多电子的一种特殊形式的化学键,这种键既没有方向性也没有饱和性,金属键的特征是成键电子可以在金属中自由流动,使得金属呈现出特有的属性。在金属单质的晶体中,原子之间以金属键相互结合。金属键是一种遍布整个晶体的离域化学键。
经典的金属键理论叫做“电子气理论”。它把金属键形象地描绘成从金属原子上“脱落”下来的大量自由电子形成可与气体相比拟的带负电的“电子气”,金属原子则“浸泡”在“电子气”的“海洋”之中。
金属具有导电、导热、延展性和金属光泽等物理性质。
说明:
1、金属导电性的解释:在金属晶体中,充满着带负电的“电子气”,这些电子气的运动是没有一定方向的,但在外加电场的条件下电子气就会发生定向移动,因而形成电流,所以金属容易导电。
2、金属导热性的解释:金属容易导热,是由于电子气中的自由电子在热的作用下与金属原子频繁碰撞从而把能量从温度高的部分传到温度低的部分,从而使整块金属达到相同的温度。
5
3、金属延展性的解释:当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以在各原子层之间发生相对滑动以后,仍可保持这种相互作用,因而即使在外力作用下,发生形变也不易断裂。因此,金属都有良好的延展性,但金属的延展性也是有限度的。
4、金属的物理性质:由于金属晶体中存在大量的自由电子和金属离子(或原子)排列很紧密,使金属具有很多共同的性质。
(1)状态:通常情况下,除Hg外都是固体。
(2)金属光泽:多数金属具有光泽。但除Mg、Al、 Cu、Au在粉末状态有光泽外,其他金属在块状时才表现出来。
(3)易导电、导热:由于金属晶体中自由电子的运动,使金属易导电、导热。
(4)延展性
(5)熔点及硬度:由金属晶体中金属离子跟自由电子间的作用强弱决定。
5、金属除有共同的物理性质外,还具有各自的特性。
①颜色:绝大多数金属都是银白色,有少数金属具有颜色。如Au金黄色Cu紫红色Cs银白略带金色。
②密度:与原子半径、原子相对质量、晶体质点排列的紧密程度有关。最重的为锇(Os)铂(Pt)最轻的为锂(Li)
③熔点:最高的为钨(W),最低的为汞(Hg),铯(Cs),为28.4℃,钙(Ca)为30℃
④硬度:最硬的金属为铬(Cr),最软的金属为钾 (K),钠(Na),铯(Cs)等,可用小刀切割。
⑤导电性:导电性能强的为银(Ag),金(Au),铜 (Cu)等。导电性能差的为汞(Hg)
⑥延展性:延展性最好的为金(Au),铝(Al)等
6、金属键强弱的比较:
①金属键的强弱可以用金属的原子化热(升华热)来衡量,金属的原子化热是指1mol金属晶体完全气化时吸收的能量,金属的原子化热越大,金属键越强。
②金属键的强度主要决定于金属元素的原子半径和价电子数,原子半径越大,价电子数越少,金属键越弱,金属晶体的熔沸点越低;原子半径越小,价电子数越多,金属键越强,金属晶体的熔沸点越高。
7、合金:两种和两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质,叫做合金,合金属于混合物,对应的固体为金属晶体。合金的特点:
①仍保留金属的化学性质,但物理性质改变很大;
②熔点比各成分金属的熔点都低;
③强度、硬度比各成分金属的大;
④部分合金有强的抗腐蚀能力;
⑤导电性比成分金属差。
8、金属晶体的导电是由于自由电子在外加电场作用下的定向移动形成电流。而电解质溶液的导电,则是电离产生的阴、阳离子在外加电场的作用下的定向移动,此时,溶液中的离子或电极材料在电极上发生氧化还原反应生成新的物质,所以说电解质溶液的导电过程实质上就是电解过程。
(二)金属晶体:
金属阳离子和自由电子间通过金属键相互作用所形成的晶体称为金属晶体,构成金属晶体的微粒是金属阳离子和自由电子,相互作用力是金属键。
5
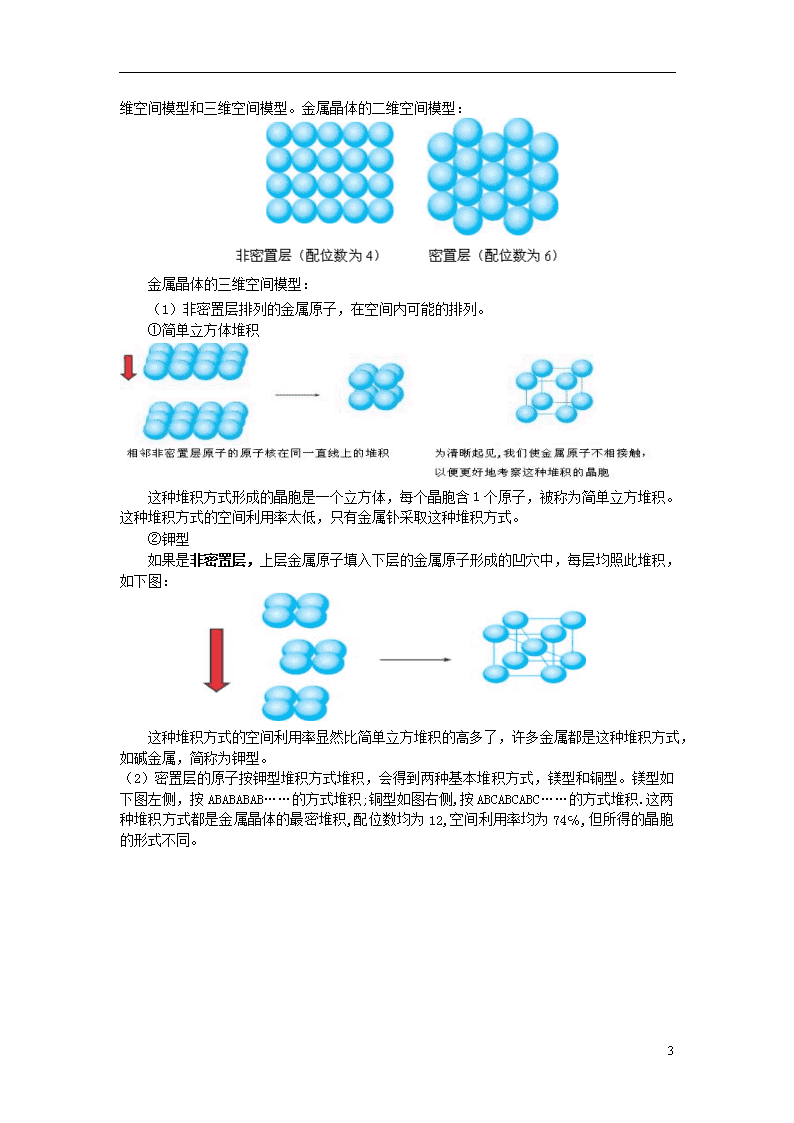
在金属晶体中,金属键使金属原子有序排列。金属晶体的原子堆积模型有两种情况:二维空间模型和三维空间模型。金属晶体的二维空间模型:
金属晶体的三维空间模型:
(1)非密置层排列的金属原子,在空间内可能的排列。
①简单立方体堆积
这种堆积方式形成的晶胞是一个立方体,每个晶胞含1个原子,被称为简单立方堆积。这种堆积方式的空间利用率太低,只有金属钋采取这种堆积方式。
②钾型
如果是非密置层,上层金属原子填入下层的金属原子形成的凹穴中,每层均照此堆积,如下图:
这种堆积方式的空间利用率显然比简单立方堆积的高多了,许多金属都是这种堆积方式,如碱金属,简称为钾型。
(2)密置层的原子按钾型堆积方式堆积,会得到两种基本堆积方式,镁型和铜型。镁型如下图左侧,按ABABABAB……的方式堆积;铜型如图右侧,按ABCABCABC……的方式堆积.这两种堆积方式都是金属晶体的最密堆积,配位数均为12,空间利用率均为74℅,但所得的晶胞的形式不同。
5
说明:
1、在晶体中,有阳离子的物质不一定有阴离子,如金属晶体;但有阴离子的物质中肯定有阳离子。
2、金属晶体的三维空间排列是在二维空间排列的基础上排列的。对于非密置型排列有两种排列方式:简单立方和钾型(晶胞为体心立方);对于密置型排列也有两种常见的排列方式:镁型(AB型)(晶胞为六棱柱状)和铜型(ABC型)(晶胞为面心立方)。
3、几种常见晶体的结构与堆积方式:
4、金属晶体的空间利用率越高,结构越稳定。
5、金属晶体的熔沸点差异很大,主要与金属键的相对强弱有关,一般情况下,金属原子半径越小,电荷越大,金属键越强,金属晶体的熔沸点越高,反之越低。
【典型例题】
例1. 关于晶体的下列说法正确的是
A、在晶体中只要有阴离子就一定有阳离子
B、在晶体中只要有阳离子就一定有阴离子
C、原子晶体的熔点一定比金属晶体的高
D、分子晶体的熔点一定比金属晶体的低
解析:只有认识四类晶体物理性质差异的本质原因才能对此题进行正确判断。在四类晶体中,金属晶体的结构及物理性质最特殊,应予以重视。金属晶体中,构成晶体的微粒既有金属原子,又有金属阳离子,且二者不断转换,晶体中自由电子与金属离子间的电性作用形成了金属键。因此晶体中有阳离子,不一定有阴离子,如金属晶体。金属键强弱相差很大(主要由阳离子半径大小决定),因此金属晶体的熔沸点、硬度等物理性质相差极大,它与其他类晶体相比很特殊,有的晶体熔沸点很低,甚至小于分子晶体如金属汞、碱金属等;有的金属熔沸点很高,甚至高于原子晶体如金属钨。
答案:A
例2.
5
物质结构理论推出:金属晶体中金属离子与自由电子之间的强烈相互作用,叫金属键。金属键越强,其金属的硬度越大,熔沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强。由此判断下列说法错误的是
A、镁的硬度大于铝 B、镁的熔沸点低于钙
C、镁的硬度大于钾 D、钙的熔沸点高于钾
解析:金属晶体的熔沸点差异很大,主要与金属键的相对强弱有关,一般情况下,金属原子半径越小,电荷越大,金属键越强,金属晶体的熔沸点越高,反之越低。价电子数Al>Mg,原子半径Al<Mg,所以Al的金属键更强,所以A的说法错误。Mg和Ca的价电子数相同,而原子半径Mg<Ca,所以金属键的强弱Mg>Ca,所以B的说法也错误。价电子数Mg>K,原子半径Mg<K,所以C的说法正确。价电子数Ca>K,原子半径Ca<K,所以D的说法也正确。
答案:AB
例3. 下列有关金属元素特征的叙述正确的是
A、金属元素的原子只有还原性,离子只有氧化性
B、金属元素在一般化合物中只显正价
C、金属元素在不同的化合物中的化合价均不同
D、金属元素的单质在常温下均为金属晶体
解析:A、对于变价金属中,中间价态的金属离子既有氧化性,又有还原性,如Fe2+。B、金属元素的原子只具有还原性,故在化合物中只显正价。C、金属元素有的有变价,有的无变价,如Na+。D、金属晶体的熔沸点差异较大,绝大多数金属常温下均为晶体,但金属汞常温下为液体。
答案:B
例4. 晶胞是晶体中最小的重复单元.已知铁为面心立方晶体,其结构如下图甲所示,面心立方的结构特征如下图乙所示.若铁原子的半径为,试求铁金属晶体中的晶胞长度,即下图丙中AB的长度为______________m.
解析:本题为信息题,面心立方晶体可通过观察图甲和图乙得出其结构特征是:在一个立方体的八个顶点各有一个原子,且在六个面的面心上各有一个原子。图丙是一个平面图,则有:AB2+BC2=AC2,即2AB2=(4×)2,则:AB=。
答案:AB=
5