- 100.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第一章 第一节 第二课时
一、选择题
1.(2009·罗定模拟)下列物质提纯的方法可能属于化学变化的是 ( )
A.蒸馏 B.过滤 C.分液 D.洗气
答案:D
2.(2008·广东理基)用石灰水、小苏打、淀粉和食醋等不能完成的实验是 ( )
A.碘盐中碘的检验 B.暖瓶中水垢的除去
C.食盐和纯碱的鉴别 D.鸡蛋壳主要成分的检验
答案:A
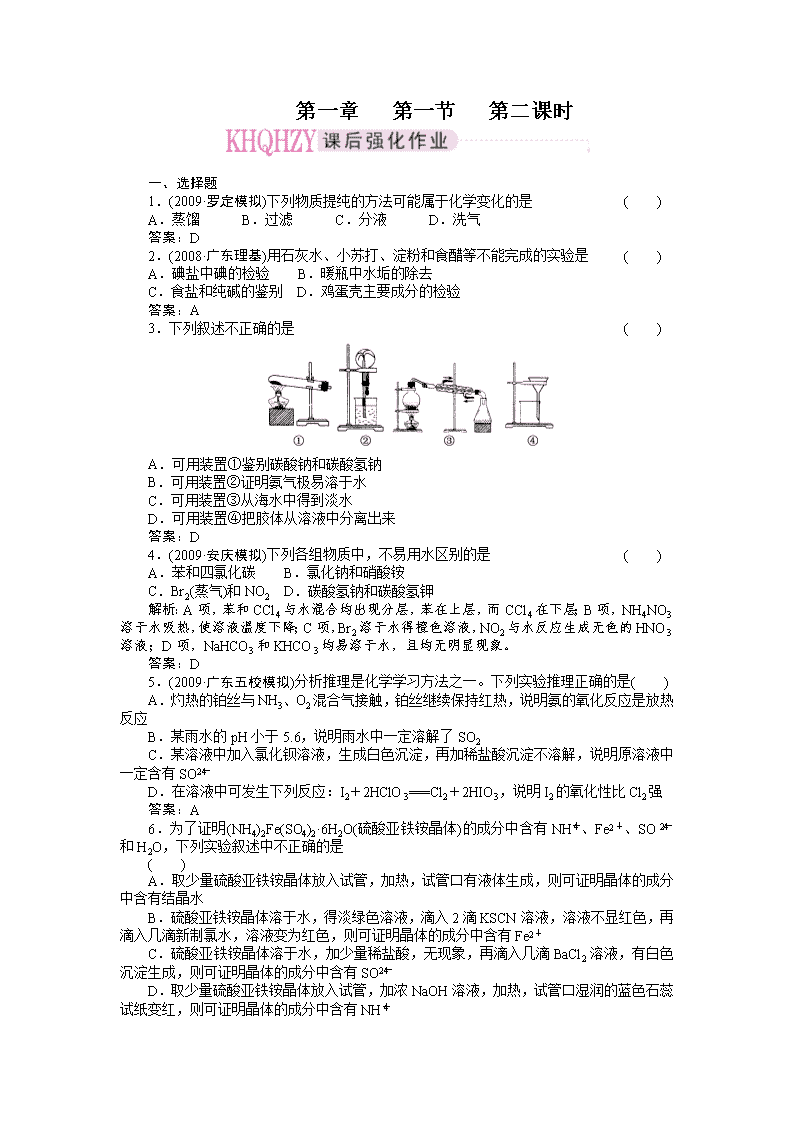
3.下列叙述不正确的是 ( )
A.可用装置①鉴别碳酸钠和碳酸氢钠
B.可用装置②证明氨气极易溶于水
C.可用装置③从海水中得到淡水
D.可用装置④把胶体从溶液中分离出来
答案:D
4.(2009·安庆模拟)下列各组物质中,不易用水区别的是 ( )
A.苯和四氯化碳 B.氯化钠和硝酸铵
C.Br2(蒸气)和 NO2 D.碳酸氢钠和碳酸氢钾
解析:A 项,苯和 CCl4 与水混合均出现分层,苯在上层,而 CCl4 在下层;B 项,NH4NO3
溶于水吸热,使溶液温度下降;C 项,Br2 溶于水得橙色溶液,NO2 与水反应生成无色的 HNO3
溶液;D 项,NaHCO3 和 KHCO3 均易溶于水,且均无明显现象。
答案:D
5.(2009·广东五校模拟)分析推理是化学学习方法之一。下列实验推理正确的是( )
A.灼热的铂丝与 NH3、O2 混合气接触,铂丝继续保持红热,说明氨的氧化反应是放热
反应
B.某雨水的 pH 小于 5.6,说明雨水中一定溶解了 SO2
C.某溶液中加入氯化钡溶液,生成白色沉淀,再加稀盐酸沉淀不溶解,说明原溶液中
一定含有 SO2-
4
D.在溶液中可发生下列反应:I2+2HClO3===Cl2+2HIO3,说明 I2 的氧化性比 Cl2 强
答案:A
6.为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有 NH+
4 、Fe2+、SO 2-
4 和
H2O,下列实验叙述中不正确的是 ( )
A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分
中含有结晶水
B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入 2 滴 KSCN 溶液,溶液不显红色,再
滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有 Fe2+
C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴 BaCl2 溶液,有白色
沉淀生成,则可证明晶体的成分中含有 SO2-
4
D.取少量硫酸亚铁铵晶体放入试管,加浓 NaOH 溶液,加热,试管口湿润的蓝色石蕊
试纸变红,则可证明晶体的成分中含有 NH+
4
答案:D
7.(2009·宿州模拟)仅用一种试剂鉴别如下物质:苯、CCl4、NaCl 溶液、Na2SO3 溶液,
下列试剂中不能选用的是 ( )
A.溴水 B.FeCl3 溶液
C.酸性 KMnO4 溶液 D.AgNO3 溶液
答案:D
8.有 a、b、c、d、e 五种无色气体,进行下列实验:
实验步骤 实验现象
①a 和 b 相混合 气体变为红棕色
②c 和 d 相混合 产生白烟
③c、e 分别通入少量溴水中 都变成无色透明的溶液
④b、e 分别通入氢硫酸中 都产生淡黄色的浑浊
a、b、c、d、e 依次可能是 ( )
A.O2、NO、HCl、NH3、CO2
B.O2、NO、NH3、HCl、SO2
C.NO、O2、NH3、HCl、SO2
D.HBr、Cl2、NH3、H2S、C2H4
答案:C
9.(2009·滁州模拟)根据下列事实得出的结论正确的是 ( )
A.Na2SO3 试样――→溶解 ――→硝酸钡溶液白色沉淀――→稀硝酸沉淀不溶解
结论:此 Na2SO3 试样已变质
B.稀硫酸――→纯锌粒产生气泡的速率较慢 ――→滴入 CuSO4 溶液产生气泡的速率明显加快
结论:CuSO4 对此反应有催化作用
C.某溶液 ――→打开瓶盖瓶口产生白雾
――→用蘸有浓氨水的玻璃棒靠近瓶口瓶口产生白烟
结论:此溶液一定为浓盐酸
D.无色试液 ――→足量盐酸产生无色无味气体
――→将气体通入澄清石灰水石灰水变浑浊
结论:原无色试液中可能含有 CO2-
3
答案:D
10.某含有 Na+的澄清溶液中,可能还存在 NH+
4 、Fe2+、I-、Br-、CO2-
3 、SO 2-
3 六种离
子中的几种。将该溶液进行如下实验:(1)滴加足量的新制氯水,有气泡生成,溶液变黄色;
(2)向(1)所得溶液中加入 BaCl2 溶液,无沉淀生成;(3)向(1)所得溶液中加入淀粉溶液,不显
蓝色。依据上述实验事实推断该溶液 ( )
①一定存在 Fe2+、Br-、CO2-
3 ②一定呈碱性 ③一定不存在 I-、SO2-
3 ④可能存在
NH+
4
A.①②③ B.③④
C.②③④ D.①④
答案:B
11.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
( )
被提纯的物质 除杂试剂 分离方法
A 溴化钠溶液(NaI) 溴水 蒸馏
B 氯化铵溶液(FeCl3) 氢氧化钠溶液 过滤
C 二氧化碳(CO) O2 点燃
D 淀粉(KCl) H2O 置于半透膜
袋中漂洗
答案:D
12.(2009·南昌一中,十中,新建二中三校联考)有一瓶无色气体,可能含有 H2S、CO2、
HCl、HBr、SO2 中的一种或几种,将其通入氯水中,得无色透明溶液,将这种溶液分为两
份,向一份中加入用盐酸酸化的 BaCl2 溶液,出现了白色沉淀;向另一份中加入用硝酸酸化
的 AgNO3 溶液,也产生了白色沉淀,与此有关的下列结论中,正确的是 ( )
A.肯定有 HCl、SO2
B.可能含有 HBr、CO2
C.肯定没有 CO2、H2S、HBr
D.以上结论均不正确
答案:D
13.(2009·四川)下列有关物质检验的实验结论正确的是 ( )
选项 实验操作及现象 实验结论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀
生成 该溶液中一定含有 SO2-
4
B
向某溶液中加入 2 滴 KSCN 溶液,溶液不显红色。再
向溶液中加入几滴新制的氯水,溶液变为红色 该溶液中一定含有 Fe2+
C 将某气体通入品红溶液中,品红溶液褪色 该气体一定是 SO2
D
将少量某物质的溶液滴加到新制的银氨溶液中,水浴
加热后有银镜生成 该物质一定属于醛类
解析:A 中无法排除 Ag+为干扰;C 使品红褪色的物质可以是 SO2,还可以是其他具有
漂白性的物质,如:Cl2 溶于水可生成具有漂白性的 HClO。D 只能证明该有机物中含有醛基,
但不一定是醛类,比如说甲酸、甲酸酯,甲酸盐,都能发生银镜反应。
答案:B
14.(2009·江苏)下列化学实验事实及其解释都正确的是 ( )
A.向碘水中滴加 CCl4,振荡静置后分层,CCl4 层呈紫红色,说明可用 CCl4 从碘水中
萃取碘
B.向 SO2 水溶液中滴加盐酸酸化的 BaCl2 溶液,有白色沉淀生成,说明 BaSO3 难溶于
盐酸
C.向 0.1 mol·L-1 FeSO4 溶液中滴加少量酸性 KMnO4 溶液,KMnO4 溶液褪色,说明 Fe2
+具有氧化性
D.向 2.0 mL 浓度均为 0.1 mol·L-1 的 KCl、KI 混合溶液中滴加 1 滴~2 滴 0.01 mol·L-
1 AgNO3 溶液,振荡,沉淀呈黄色,说明 AgCl 的 Ksp 比 AgI 的 Ksp 大
解析:B 项中 HCl 酸性强于 H2SO3,且 BaSO3 可溶于盐酸,故 SO2 不可能与 BaCl2 溶液
反应;C 项中 KMnO4 溶液褪色是因为被 Fe2+还原,Fe2+具有还原性。
答案:AD
二、非选择题
15.(2009·济宁质量检测)某一无色溶液,可能含有 Na+、Cu2+、NH+
4 、Fe3+、Al3+、Mg2
+、CO2-
3 、SO2-
4 、K+等离子中的一种或几种,为确定其组成,做如下实验:
①取少量待测溶液,向其中滴入盐酸酸化的氯化钡溶液,生成白色沉淀;
②另取少量待测溶液,向其中加入过氧化钠,产生无色无味气体,并生成白色沉淀;加
入过量过氧化钠时,沉淀部分溶解。
试判断:溶液中一定存在的离子有________;一定不存在的离子有________。不确定的
是________,为验证此离子的存在,还应进行________实验。
答案:Al3+、Mg2+、SO2-
4 NH+
4 、Cu2+、Fe3+、CO2-
3 K+、Na+ 焰色反应
16.(2008·河北唐山联考)某无色溶液 X,由 Na+、Ag+、Ba2+、Al3+、AlO-
2 、MnO-
4 、
CO2-
3 、SO 2-
4 中的若干种离子组成,取溶液进行如下连续实验:
(1)气体 A 的成分是(填化学式,下同)________,气体 B 的成分是________。
(2)X 溶液中一定存在的离子是__________________。
(3)写出步骤①发生反应的所有离子方程式__________________________________。
(4)写出步骤②形成白色沉淀甲的离子方程式__________________________________。
(5)通过上述实验,溶液 X 中还有未完全确定的离子是________;只要设计一个简单的
后续实验就可以确定该离子是否存在,该方法是_________________________________(简述
所加试剂及理由)。
解析:由于溶液是无色的,所以排除 MnO -
4 的存在;溶液 X 中加入 HCl 有气体生成,
说明有 CO 2-
3 的存在,生成气体 A 为 CO2;CO 2-
3 的存在排除了 Ag+、Ba2+、Al3+的存在;
第②步继续向反应后的溶液中加入 NH+
4 ,反应既生成气体,又生成沉淀,所以证明原溶液
含有 AlO-
2 ,AlO -
2 在第一步加入 HCl 时发生反应 AlO-
2 +4H+===Al3++2H2O,生成的 Al3+
和 HCO -
3 发生相互促进水解反应;Al3++3HCO-
3 ===Al(OH)3↓+3CO2↑;第③步继续加入
Ba(OH)2,生成白色沉淀,可能含有 BaCO3 或 BaSO4 中的一种或两种,用盐酸检验。
答案:(1)CO2 NH3
(2)CO2-
3 、AlO-
2 、Na+
(3)CO2-
3 +2H+===H2O+CO2↓ AlO-
2 +4H+===Al3++2H2O
(4)Al3++3HCO-
3 ===Al(OH)3↓+3CO2↑
(5)SO2-
4 在沉淀乙中加稀盐酸,若白色沉淀能完全溶解,则 X 中不存在 SO2-
4 ;若不能
完全溶解,则存在 SO2-
4
17.(2008·四川理综,26)某固体混合物可能含有 MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、
AgNO3 和 CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物
质在相应位置写化学式,暂不能确定的物质在相应位置填“无”)。
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
肯定存在
的物质
肯定不存
在的物质
理由
(2)取溶液进行焰色反应,火焰呈黄色。
肯定存在
的物质
肯定不存
在的物质
理由
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
肯定存在
的物质
肯定不存
在的物质
理由
(4)通过上述实验仍无法确定的物质是__________。
解析:混合物溶于水得到无色溶液,说明混合物中没有 CuSO4;焰色反应呈黄色,说明
含有 Na2SO4;白色沉淀加入稀盐酸,沉淀完全溶解,并放出气体说明不溶于 HCl 的白色沉
淀 BaSO4 和 AgCl,则白色沉淀是 MgCO3,原溶液中没有 Ba(NO3)2 和 AgNO3。
答案:(1)
无 CuSO4 溶液无色,而 CuSO4 溶液为蓝色
(2)
Na2SO4 无 钠的焰色反应呈黄色
(3)
MgCO3 Ba(NO3)2
、AgNO3
MgCO3 沉淀溶于稀盐酸,有气体放出;如有 Ba(NO3)2,生
成的 BaSO4 沉淀不溶于盐酸;如有 AgNO3,生成的沉淀在
盐酸中不消失
(4)Al2(SO4)3
18.(2009·江苏)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含
有少量 Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O 的质量分数为 97.0%~
103.0%)的主要流程如下:
盐酸 氢氧化钙 盐酸
工业 CaCO3→ 溶解 → 除杂 → 过滤 → 酸化 → 蒸发结晶(160℃)
滤渣 CaCl2·2H2O
(1)除杂操作是加入氢氧化钙,调节溶液的 PH 为 8.0~8.5,以除去溶液中的少量 Al3+、
Fe3+。检验 Fe(OH)3 是否沉淀完全的实验操作是______________________________________。
(2)酸化操作是加入盐酸,调节溶液的 pH 约为 4.0,其目的有:①将溶液中的少量 Ca(OH)2
转化为 CaCl2;②防止 Ca2+在蒸发时水解;③_____________________________________。
(3)测定样品中 Cl-含量的方法是:a.称取 0.7500 g 样品,溶解,在 250 mL 容量瓶中定
容;b.量取 25.00 mL 待测溶液于锥形瓶中;c.用 0.05000 mol·L-1 AgNO3 溶液滴定至终点,
消耗 AgNO3 溶液体积的平均值为 20.39 mL。
①上述测定过程中需用溶液润洗的仪器有__________________________________。
②计算上述样品中 CaCl2·2H2O 的质量分数为______________________________。
③若用上述方法测定的样品中 CaCl2·2H2O 的质量分数的质量分数偏高(测定过程中产
生的误差可忽略),其可能原因有______________________________________________;
________________________________________________________________________。
解析:第(1)问中若 Fe(OH)3 未沉淀完全则溶液中应含有 Fe3+,但浓度很小所以通常选
用 KSCN 而不用 OH-检测;第(2)问中调节 pH 使之显弱酸性主要是为了防止 Ca2+形成溶解
度较小的 Ca(OH)2、CaCO3;由 Ag + ~Cl - 可知滴定溶液中,n(CaCl2·2H2O)=1
2n(Cl - )=
1
2
×0.05000 mol·L-1×20.39×10-3 L,
所以 w(CaCl2·2H2O)=
1
2
×0.05000 mol·L-1×20.39×10-3 L×147 g·mol-1
0.7500 g×25.00 mL
250 mL
×100%=99.9%。
答案:(1)取少量上层清液,滴加 KSCN 溶液,若不出现血红色,说明 Fe(OH)3 沉淀完
全
(2)防止溶液吸收空气中的 CO2
(3)①酸式滴定管 ②99.9% ③样品中有少量的 NaCl;少量 CaCl2·2H2O 失水