- 1.50 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2014 年普通高等学校招生全国统一考试化学试题分类汇编
专题十四 无机综合与推断(包括化学工艺流程)
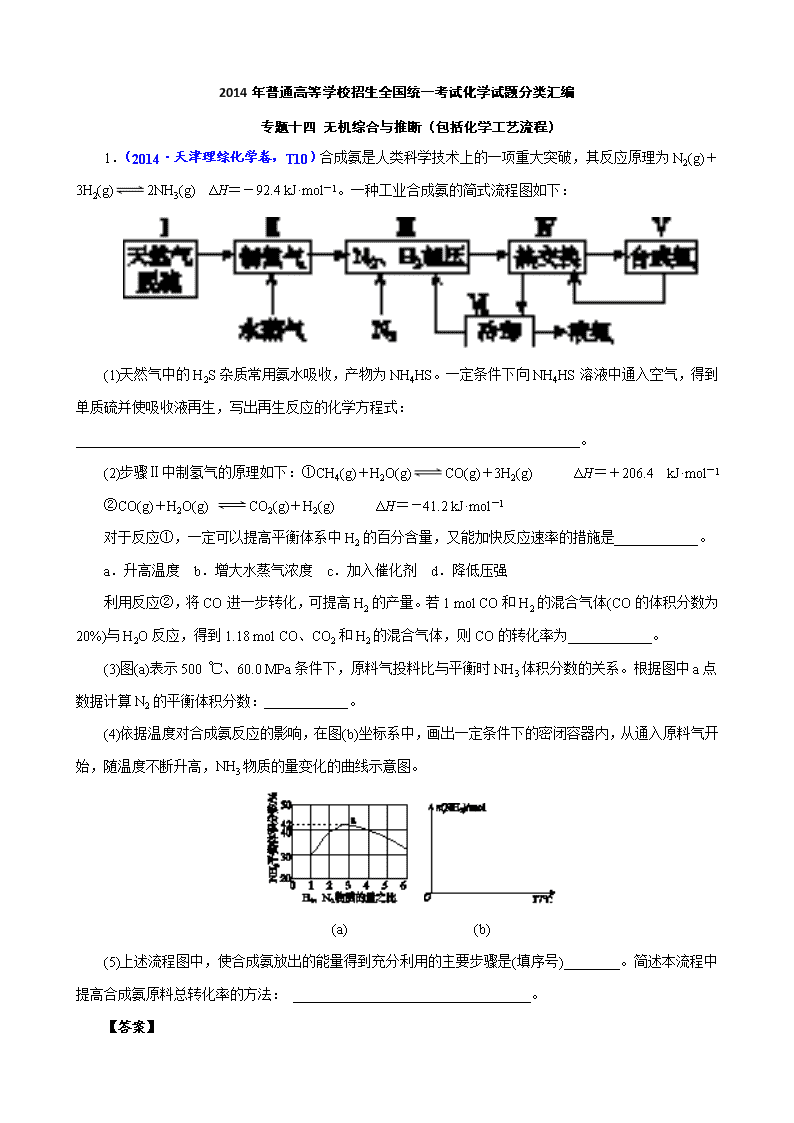
1.(2014·天津理综化学卷,T10)合成氨是人类科学技术上的一项重大突破,其反应原理为 N2(g)
+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
(1)天然气中的 H2S 杂质常用氨水吸收,产物为 NH4HS。一定条件下向 NH4HS 溶液中通入空气,得到
单质硫并使吸收液再生,写出再生反应的化学方程式:
________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中 H2 的百分含量,又能加快反应速率的措施是____________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将 CO 进一步转化,可提高 H2 的产量。若 1 mol CO 和 H2 的混合气体(CO 的体积分数为
20%)与 H2O 反应,得到 1.18 mol CO、CO2 和 H2 的混合气体,则 CO 的转化率为____________。
(3)图(a)表示 500 ℃、60.0 MPa 条件下,原料气投料比与平衡时 NH3 体积分数的关系。根据图中 a 点
数据计算 N2 的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开
始,随温度不断升高,NH3 物质的量变化的曲线示意图。
(a) (b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中
提高合成氨原料总转化率的方法: __________________________________。
【答案】
(1)2NH4HS+O2 =====
一定条件
2NH3·H2O+2S↓
(2)a 90%
(3)14.5%
(4)
(5)Ⅳ 对原料气加压;分离液氨后,未反应的 N2、H2 循环使用
【解析】(1)由题意可知为空气中的 O2 将负二价硫氧化为硫单质,根据电子守恒将方程式配平即可。
(2)反应①为气体物质的量增大的吸热反应,降低压强使平衡右移,但反应速率减小,d 错;催化剂不能改
变反应限度,即不能改变 H2 的百分含量,c 错;增大水蒸气浓度虽可使反应速率增大以及平衡右移,但产
物 H2 的百分含量却减小,b 错;升高温度反应速率增大,且平衡正向移动,H2 的百分含量增大,a 对。
CO 与 H2 的混合气体与水蒸气的反应中,反应体系中的气体的物质的量不变,而 1 molCO 与 H2 的混合气
体参加反应生成 1.18 mol 混合气,说明有 0.18 mol 水蒸气参加反应,则根据方程式②可知参加反应的 CO
也为 0.18 mol,则其转化率为 0.18 mol
1 mol×20%×100%=90%。
(3)由图中看出当 N2 与 H2 物质的量比为 1∶3时,NH3 的平衡体积分数最大,为 42%。设平衡时转化
的 N2 的物质的量为 x mol,由三段式:
N2+3H2 2NH3
起始(mol): 1 3 0
转化(mol): x 3x 2x
平衡(mol): 1-x 3- 3x 2x
2x
(1-x)+(3-3x)+2x×100%=42%,则 x=0.59
则平衡时 N2 的体积分数为 (1-x)
(1-x)+(3-3x)+2x
×100%=14.5%。(4)作图时要注意开始时 NH3
物质的量不断增多,是因为反应正向进行(反应未达平衡),达到一定程度后反应达到平衡而此时温度继续
升高,平衡逆向移动,NH3 的物质的量减小。(5)热交换器可以使需要加热的物质得到加热,还可以使需要
冷却的物质得到冷却,能充分利用能量。合成氨反应为气体物质的量减小的反应,加压利于反应正向进行;
此外,循环利用可反复利用原料,提高原料利用率。
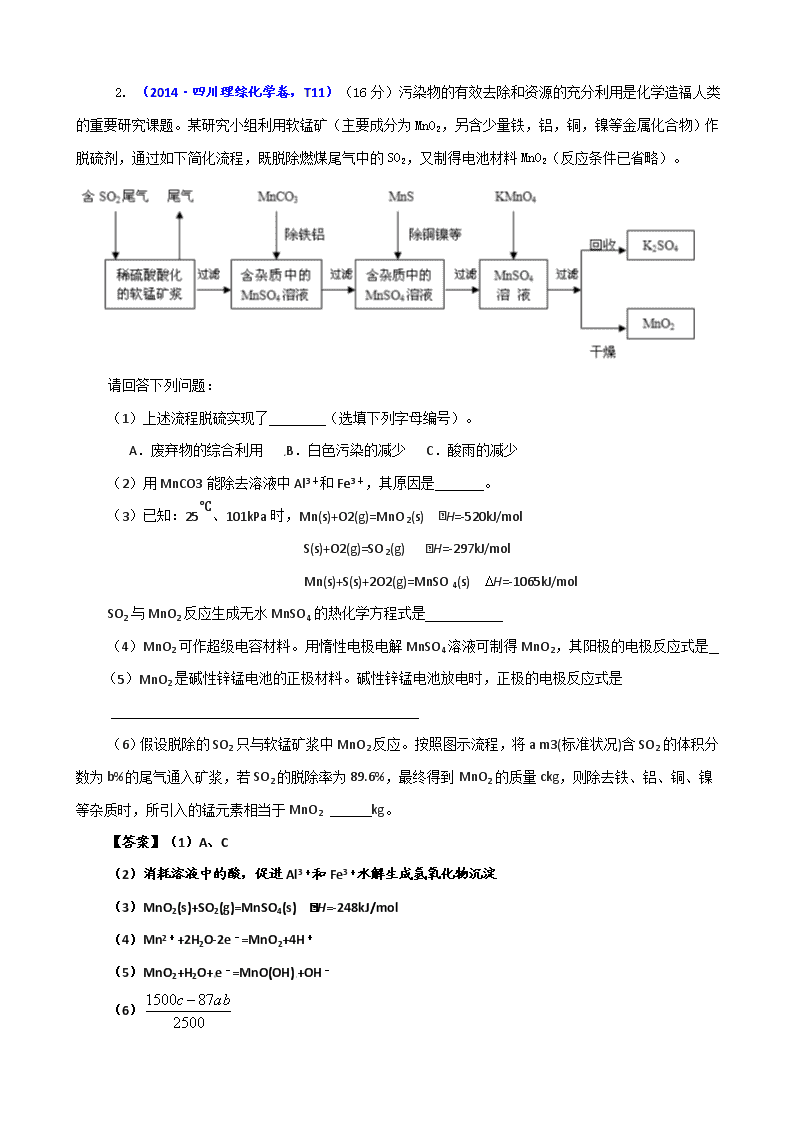
2. (2014·四川理综化学卷,T11)(16 分)污染物的有效去除和资源的充分利用是化学造福人类
的重要研究课题。某研究小组利用软锰矿(主要成分为 MnO2,另含少量铁,铝,铜,镍等金属化合物)作
脱硫剂,通过如下简化流程,既脱除燃煤尾气中的 SO2,又制得电池材料 MnO2(反应条件已省略)。
请回答下列问题:
(1)上述流程脱硫实现了 (选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用 MnCO3 能除去溶液中 Al3+和 Fe3+,其原因是 。
(3)已知:25℃、101kPa 时,Mn(s)+O2(g)=MnO2(s) H=-520kJ/mol
S(s)+O2(g)=SO2(g) H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) H=-1065kJ/mol
SO2 与 MnO2 反应生成无水 MnSO4 的热化学方程式是
(4)MnO2 可作超级电容材料。用惰性电极电解 MnSO4 溶液可制得 MnO2,其阳极的电极反应式是
(5)MnO2 是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是
(6)假设脱除的 SO2 只与软锰矿浆中 MnO2 反应。按照图示流程,将 a m3(标准状况)含 SO2 的体积分
数为 b%的尾气通入矿浆,若 SO2 的脱除率为 89.6%,最终得到 MnO2 的质量 ckg,则除去铁、铝、铜、镍
等杂质时,所引入的锰元素相当于 MnO2 kg。
【答案】(1)A、C
(2)消耗溶液中的酸,促进 Al3+和 Fe3+水解生成氢氧化物沉淀
(3)MnO2(s)+SO2(g)=MnSO4(s) H=-248kJ/mol
(4)Mn2++2H2O-2e-=MnO2+4H+
(5)MnO2+H2O+e-=MnO(OH)+OH-
(6)1500 87
2500
c ab
【解析】(1)根据题意,既脱除燃煤尾气中的 SO2,又制得电池材料 MnO2,上述流程脱硫能够实
现废弃物的综合利用,二氧化硫的减少可以减少酸雨。
(2)用 MnCO3 能除去溶液中 Al3+和 Fe3+的原因是 MnCO3 本身难溶于水,消耗溶液中的酸,促进 Al3
+和 Fe3+水解生成氢氧化物沉淀。
(3) Mn(s)+O2(g)=MnO2(s) H=-520kJ/mol ①
S(s)+O2(g)=SO2(g) H=-297kJ/mol ②
Mn(s)+S(s)+2O2(g)=MnSO4(s) H=-1065kJ/mol ③
根据盖斯定律: ③-①-②得: H=-248kJ/mol,则 SO2 与 MnO2 反应生成无水 MnSO4 的热化学方程
式是 MnO2(s)+SO2(g)=MnSO4(s) H=-248kJ/mol
(4)用惰性电极电解 MnSO4 溶液,正极的反应式为 Mn2++2H2O-2e-=MnO2+4H+
(5)MnO2 是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式 MnO2+H2O+e-
=MnO(OH)+OH-
(6)最终得到 MnO2 的质量 ckg,减去和二氧化硫反应的二氧化锰的质量,即为除去铁、铝、铜、镍
等杂质时,所引入的 MnO2 的质量。m=c-[a×103×b%×89.6%×87/(22.4×1000)]= 1500 87
2500
c ab
3.(2014·全国理综 I 化学卷,T36)[化学——选修 2:化学与技术](15 分)磷矿石主要以磷酸钙
[Ca3(PO4)2 H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在。图(a)为目前国际上磷矿石利用的大致
情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生成过程中由磷灰石制单
质磷的流程。
图(a)
图(b)
部分物质的相关性质如下:
熔点/℃ 沸点/℃ 备注
白磷 44 280.5
PH3 -133.8 -87.8 难溶于水,具有还原性
SiF4[来源:学§
科§网]
-90 -86 易水解
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中 Ca3F(PO4)3 反应的化学方程式为: 。
现有 1 吨折合含有五氧化二磷约 30%的磷灰石,最多可制得 85℅的商品磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白
磷。炉渣的主要成分是: (填化学式)冷凝塔 1 的主要沉积物是: 冷凝塔 2 的主要沉积物是:
(4)尾气中主要含有 ,还含有少量 PH3、H2S 和 HF 等,将尾气先通入纯碱溶液,可除
去 ;再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是: 。
【答案】(1)69%
(2)Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑ 0.49t
(3)CaSiO3,,液体白磷;固体白磷。
(4)CO、SiF4;H2S、HF、SiF4,PH3。
(5)产品纯度高或产品浓度大
【解析】(1)含磷的肥料有两种:磷矿粉肥和最终制得的磷肥,共 4%+96%×85%×80%=69%
(2)湿法生产磷酸属于复分解反应,符合强酸制取弱酸的反应, Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4
+HF
根据 P 原子守恒:P2O5→2 H3PO4
142 196
0.3t 85%x
则:85%x×142=196×0.3t,x=0.49t
(3)炉渣主要成分是硅酸钙(CaSiO3),冷凝塔 1 的温度为 70℃,白磷蒸汽冷凝为液体;冷凝塔 2
的温度为 18℃,白磷液体固化变为固体。
(4)因为使用了过量的焦炭,所以尾气中中有大量的 CO 气体,还含有 SiF4;通过碱性溶液,酸性的
H2S、HF 以及易水解的 SiF4 被吸收,再通过氧化性的次氯酸钠溶液,还原性的 PH3 被吸收。
(5)用白磷制取磷酸可以制得高纯度的磷酸
4、(2014·江苏单科化学卷,T16)(12 分)烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰
(主要含 Al2O3、SiO2 等)制备碱式硫酸铝[Al2(SO4)x(OH)6—2x]溶液,并用于烟气脱硫研究。
(1)酸浸
时反应的化学方程式为 ;滤渣Ⅰ的主要成分为 (填化学式)。
(2)加 CaCO3 调节溶液的 pH 至 3.6,其目的是中和溶液中的酸,并使 Al2(SO4)3 转化为 Al2(SO4)x(OH)6—2x。
滤渣Ⅱ的主要成分为 (填化学式);若溶液的 pH 偏高,将会导致溶液中铝元素的含量降低,其原
因是 (用离子方程式表示)。
(3)上述流程中经完全热分解放出的 SO2 量总是小于吸收的 SO2 量,其主要原因是 ;与吸收 SO2
前的溶液相比,热分解后循环利用的溶液的 pH 将 (填“增大”、“减小”或“不变”)。
【答案】(12分)
(1)Al2O3+3H2SO4=Al2(so4)3+3H2O SiO2
(2)CaSO4 3CaCO3+2Al3++3SO42-+3H2O=2Al(OH)3+3CaSO4+3CO2
(3)溶液中的部分亚硫酸根被氧化成硫酸根,减小
【解析】(1)粉镁灰中含有氧化铝和二氧化硅,加入硫酸,氧化铝与硫酸反应,二氧化硅不和硫酸
反应,化学方程式为:Al2O3+3H2SO4=Al2(so4)3+3H2O,滤渣的成分为二氧化硅。
(2)加入碳酸钙调节溶液的 pH,溶液中的硫酸根与钙离子结合生成滤渣,滤渣 II 的主要成分是硫酸
钙;若溶液的 pH 值偏高则部分硫酸铝转化成氢氧化铝沉淀,导致溶液中的铝离子含量降低,离子方程式
为3CaCO3+2Al3++3SO42-+3H2O=2Al(OH)3+3CaSO4+3CO2
(3)流程中完全分解产生的二氧化硫小于被吸收的二氧化硫的总量,主要是因为有部分亚硫酸根被
氧化成硫酸根;二氧化硫被吸收后生成盐,被循环利用的溶液的 pH 值减小。
5.(2014·安徽理综化学卷,T27)(14 分)LiPF6 是锂离子电池中广泛应用的电解质。某工厂用 LiF、
PCl5 为原料,低温反应制备 LiPF6,其流程如下:
已知:HCl 的沸点是-85.0 ℃,HF 的沸点是 19.5 ℃。
(1)第①步反应中无水 HF 的作用是 、 。反应设备不能用
玻璃材质的原因是 (用化学方程式表示)。无水 HF 有腐蚀性和毒性,工厂安全手册提示:
如果不小心将 HF 沾到皮肤上,可立即用 2%的 溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中 PF5 极易水解,其产物为两种酸,写出 PF5 水解的化
学方程式: 。
(3)第④步分离采用的方法是 ;第⑤步分离尾气中 HF、HCl
采用的方法是 。
(4)LiPF6 产品中通常混有少量 LiF。取样品 wg。测得 Li 的物质的量为 nmol,则该样品中 LiPF6 的物质
的量为 mol(用含有 w、n 的代数式表示)。
【答案】(14 分)
(1)反应物 溶剂 SiO2+4HF=SiF4↑+2H2O NaHCO3
(2)PF5+4H2O=H3PO4+5HF
(3)过滤 冷凝
(4) 26
126
w n
(本题部分小题属于开放试题,合理答案均给分)
【解析】(1)根据题目中的流程可以看出,固体+液体反应 新物质+饱和溶液,所以无水 HF 的
作用是反应物和溶剂;玻璃的主要成分中含有二氧化硅,能和 HF 发生反应,反应的方程式为
SiO2+4HF=SiF4↑+2H2O;HF 属于弱酸,必须用弱碱性溶液来除去(比如 2%的 NaHCO3 溶液);
(2)根据题目中的信息“PF5 极易水解,其产物为两种酸”,则根据元素组成可知,两种酸分别是 H3PO4
和 HF,所以反应的方程式为 PF5+4H2O=H3PO4+5HF;
(3)第④步分离的是固体(LiPF4(s))和液体(HF(l)),所以采用过滤的方法;分离尾气中 HF、HCl,
可以利用二者沸点的差异(HF 分子之间存在氢键)进行分离,所以采用冷凝法;
(4)根据守恒可以得到;设 LiPF6 为xmol,LiF 为 ymol;根据 Li 守恒,有 x+y=n,根据质量守恒有
152x+26y=w,解得 x= 26
126
w n mol。
6.(2014·福建理综化学卷,T23)(15 分)元素周期表中第 VIIA 族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2 的熔点 b. Cl2、Br2、I2 的氧化性
c.HCl、HBr、HI 的热稳定性 d. HCl、HBr、HI 的酸性
(3)工业上,通过如下转化可制得 KClO3 晶体:
NaCl 溶液 NaClO3 溶液 KClO3 晶体[来源:学科网]
①完成 I 中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②II 中转化的基本反应类型是 ,该反应过程能析出 KClO3 晶体而无其它晶体
析出的原因是 。
(4)一定条件,在水溶液中 1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。
①D 是 (填离子符号)。
②B→A+C 反应的热化学方程式为 (用离子符号表示)。
【答案】(15分)
(1)
(2)b、c
(3)① 1 NaCl+ 3 H2O== 1 NaClO3+ 3 H2↑
②复分解反应 室温下,氯酸钾在水中的溶解度明显小于其他晶体
(4)①ClO4—[来源:Z。xx。k.Com]
②3 ClO—( aq )==ClO3—( aq )+2Cl—( aq ) △H= 117KJ·mol—1
【解析】(1)与氯元素同主族的短周期元素位 F,原子结构示意图为:
(2)能作为非金属性判断的依据是单质之间的氧化性顺序,b 正确,气态氢化物的热稳定性顺序,c
正确;单质的熔沸点和氢化物的酸性不是判断依据。
(3)根据氧化还原反应得失电子守恒,1 NaCl+ 3 H2O== 1 NaClO3+ 3 H2↑;氯酸钠与氯化钾反应
生成氯酸钾,反应类型为复分解反应,能析出晶体的原因是氯酸钾的溶解度小于其他晶体。
(4)根 据 图 像 , D 物 质 中 化 合 价 为 +7 , 则 D 是 ClO4— 则 根 据 化 合 价 可 得 反 应 方 程 式 为 : 3
ClO—( aq )==ClO3—( aq )+2Cl—( aq ) △H=63+0-3×60=-117 KJ·mol—1。
7.(2014·福建理综化学卷,T24)(15 分)铁及其化合物与生产、生活关
系密切。
(1)右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为 。
②图中 A、B、C、D 四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
①步骤 I 若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤 II 中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的 HNO3 又将废
铁皮中的铁转化为 Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知 t℃时,反应 FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数 K=0.25。
①t℃时,反应达到平衡时 n(CO):n(CO2)= 。
②若在 1 L 密闭容器中加入 0.02 mol FeO(s),并通入 xmolCO,t℃时反应达到平衡。此时 FeO(s)转化率
为 50%,则 x= 。
【答案】(15 分)
(1)①吸氧腐蚀 ②B
(2)①4HNO3 4NO2↑+O2↑+2H2O ②4Fe+10HNO3=4Fe(NO3)3+NH4NO3+3H2O
③氮氧化物排放少(或其他合理答案)
(3)① 4:1 ②0.05
【解析】(1)由图看出,在海水中,该电化腐蚀属于吸氧腐蚀,在 ABCD 四个区域中,生成铁锈最
多是 B 区,能接触到氧气。(2)浓硝酸分解的化学方程式为 4HNO3 4NO2↑+O2↑+2H2O,硝酸氧化 废
铁皮中铁的化学方程式为 4Fe+10HNO3=4Fe(NO3)3+NH4NO3+3H2O,生产过程中体现绿色思想的是整个过程
中氮氧化物排放减少。
根据反应 FeO(s)+CO(g) Fe(s)+CO2(g),平衡常数 K 为 0.25,因为固体的浓度为 1,则反应达到平
衡时 n(CO):n(CO2)=4:1,若在 1 L 密闭容器中加入 0.02 mol FeO(s),并通入 xmolCO,t℃时反应达到平衡。
此时 FeO(s)转化率为率为 50%,
FeO(s)+CO(g) Fe(s)+CO2(g)
起始 0.02 x 0 0
变化 0.01 0.01 0.01 0.01
平衡时 0.01 x-0.01 0.01 0.01
根据平衡常数 K=0.25 得: . 0.25.
0 01
x 0 01
,解得 x=0.05。
8.(2014·广东理综化学卷,T31)(16 分)用 CaSO4 代替 O2 与燃料 CO 反应,既可提高燃烧效率,
又能得到高纯 CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
① 1
4 CaSO4(s)+CO(g) 1
4 CaS(s)+CO2(g) ∆H1= —47.3kJ∙mol-1
② CaSO4(s)+CO(g) CaO(s)+CO2(g) +SO2(g) ∆H2= +210.5kJ∙mol-1
③ CO(g) 1
2 C(s)+ 1
2 CO2(g) ∆H3= —86.2kJ∙mol-1
(1)反应 2CaSO4(s)+7CO(g) CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)的∆H=___________(用∆H1、∆H2 和
∆H3 表示)
(2)反应①-③的平衡常数的对数 lgK 随反应温度 T 的变化
曲线见图 18,结合各反应的∆H,归纳 lgK-T 曲线变化规律:
a)_______________________________;
b)____________________________。
(3)向盛有 CaSO4 的真空恒容密闭容器中充入 CO,反应①
于 900℃达到平衡,c 平衡(CO)=8.0×10-5 mol∙L-1,计算 CO 的转
化率(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的 CO2,可在初始燃料中适
量加入____________。
(5)以反应①中生成的 CaS 为原料,在一定条件下经原子利用率 100%的高温反应,可再生 CaSO4,该反
应的化学方程式为_______________;在一定条件下,CO2 可与对二甲苯反应,在其苯环上引入一个羧基,
产物的结构简式为________________。
【答案】(16 分)
(1)∆H=4∆H1+∆H2+2∆H3(2 分)[来源:Z&xx&k.Com]
(2)a)反应②为吸热反应,温度升高 K 值增大,lgK 也增大(2 分)
b)反应①③为放热反应,温度升高 K 值减小,lgK 也减小(2 分)
(3)99% [来源:学&科&网]
1
4 CaSO4(s)+CO(g) 1
4 CaS(s)+CO2(g)
初始浓度(mol/L) a 0
转化浓度(mol/L) a- c 平衡(CO) a- c 平衡(CO)
平衡浓度(mol/L) c 平衡(CO) a- c 平衡(CO)
依题意,K= 2CO a CO a . 100CO CO .
c c
c c
5
5
8 0 10
8 0 10
平衡 平衡
平衡 平衡
( ) ( )
( ) ( ) ,a=8.08×10—3 mol·L—1
CO 的转化率:
— —
— —
a CO . .100% 100% 99%a .
c
3 1 5 1
3 1
8 08 10 mol L 8 0 10 mol L
8 08 10 mol L
平衡( ) (5 分)
(4)氧气 (2 分)
(5)CaS+2O2 CaSO4 (2 分) (1 分)
【解析】(1)根据盖斯定律,①×4+②+③×2 得:2CaSO4(s)+7CO(g) CaS(s)+ CaO(s)+6CO2(g)+ C(s)
+SO2(g),所以∆H=4∆H1+∆H2+2∆H3;
(2)结合图像及反应的∆H 可知,反应①③为放热反应,温度升高 K 值减小,lgK 也减小,反应②
为吸热反应,温度升高 K 值增大,lgK 也增大。
(3)由图可可知,900℃时 1
4 CaSO4(s)+CO(g) 1
4 CaS(s)+CO2(g)的 lgK=2,即 K=100,K=
100c
c
2CO
CO
,
可知平衡时 c(CO2)= 8.0×10—3 mol·L—1,CO 的转化率为
. 100%. .
3 1
3 1 5 1
8 0 10 mol L
8 0 10 mol L 8 0 10 mol L( ) =99%;
(5)CaS 转化为 CaSO4,从元素守恒角度分析,CaS 与 O2 按照 1:2 反应转化为 CaSO4,才能满足原子
利用率 100%,所以化学方程式为 CaS+2O2 CaSO4;CO2 可与对二甲苯反应,在其苯环上引入一个羧
基,因为对二甲苯的苯环上的氢原子只有 1 种,所以结构简式为 。
9、(2014·海南单科化学卷,T16)(9 分)锂锰电池的体积小,性能优良,是常用的一次电池。该
电池反应原理如图所示,其中电解质 LiClO4 溶于混合有机溶剂中,Li+ 通过电解质迁移入 MnO2 晶格中,生
成 LiMnO2。回答下列问题:
(1)外电路的电流方向是由__________极流向__________极。(填字母)
(2)电池正极反应式为________________________________________。
—CH3CH3—
COOH
—CH3CH3—
COOH
(3)是否可用水代替电池中的混合有机溶剂?__________(填“是”或“否”)原因是_______________。
(4)MnO2 可与 KOH 和 KClO4 在高温条件下反应,生成 K2MnO4,反应的化学方程式为
______________________________________,K2MnO4 在酸性溶液中歧化,生成 KMnO4 和 MnO2 的物质的量
之比为______________。
【答案】(9 分)
(1)b a (每空 1 分,共 2 分)
(2)MnO2+e—+Li+=LiMnO2 (2 分)
(3)否 电极 Li 是活泼金属,能与水反应 (每空 1 分,共 2 分)
(4)3MnO2+KClO3+6KOH 2K2MnO4+KCl+3H2O (2 分)
2:1 (1 分)
【解析】(1)结合所给装置图以及原电池反应原理,可知 Li 作负极材料,MnO2 作正极材料,所以电
子流向是从 a→b,那么电流方向则是 b→a;
(2)根据题目中的信息“电解质 LiClO4 溶于混合有机溶剂中,Li+ 通过电解质迁移入 MnO2 晶格中,生
成 LiMnO2”,所以正极的电极反应式 MnO2+e—+Li+=LiMnO2;
(3)因为负极的电极材料 Li 是活泼的金属,能够与水发生反应,故不能用水代替电池中的混合有机溶
剂;
(4)由题目中的信息“MnO2 可与 KOH 和 KClO4 在高温条件下反应,生成 K2MnO4”,可知该反应属于氧
化还原反应,Mn 元素化合价升高(
4 6
Mn Mn ),则 Cl 元素的化合价降低(
5 1
Cl Cl ),所以方程式
为 3MnO2+KClO3+6KOH 2K2MnO4+KCl+3H2O;根据“K2MnO4 在酸性溶液中歧化,生成 KMnO4
(
6 7
2 4 4K MnO KMnO )和 MnO2(
6 4
2 4 2K MnO MnO )”,根据电子得失守恒,可知生成的 KMnO4
和 MnO2 的物质的量之比为 2:1。
10、(2014·海南单科化学卷,T20-II)(14 分)锌是一种应用广泛的金属,目前工业上主要采用“湿
法”工艺冶炼锌。某含锌矿的主要成分为 ZnS(还含少量 FeS 等其他成分),以其为原料冶炼锌的工艺流程
如图所示:
浸出液浸出
浸出渣 回收利
用
硫化锌精
矿
焙烧
含尘烟气 净化、制酸
焙
滤渣 回收利
用
净化 滤液 电解沉 锌
废电积液
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用 Pb-Ag 合金惰性电极,阳极逸出的气体是____。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又
可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为
____________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:
“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐
取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉甘石的主要成分为碳
酸锌,倭铅是指金属锌)
【答案】(14 分)
(1)ZnO (2 分)
(2)浸出 (2 分)
(3)锌粉 置换出 Fe 等 (每空 2 分,共 4 分)
(4)O2 (2 分)
(5)2ZnS+4H++O2=2Zn2++2S↓+2H2O (2 分)
(6)ZnCO3+2C Zn+3CO↑ (2 分)
【解析】(1)硫化锌精矿的主要成分为 ZnS,在沸腾炉中与氧气发生反应的方程式为
ZnS+O2 ZnO+SO2,故产生焙砂的主要成分的化学式 ZnO;
(2)从流程图可以看出,“浸出”环节需要加入酸,所以用焙烧过程中产生的含尘烟气制取的酸,可
用于后续的浸出操作;
(3)为了保证“浸出”环节焙砂能够全部溶解,所以加入的酸是过量的,此时杂质 Fe3+也存在于“浸出
液”中,所以加入锌粉的目的就是置换出 Fe;
(4)根据题目中的信息“阴极采用铝板,阳极采用 Pb-Ag 合金惰性电极”,则阳极为惰性电极,此时
阳极参加反应的微粒是 OH—,电极反应式 4OH—+4e—=2H2O+O2↑,故阳极逸出的气体是 O2;
(5)根据信息“氧压酸浸”,可知参加反应的物质时 ZnS、O2 和酸提供的 H+,生成物“有工业价值的非
金属单质”即为 S,所以离子方程式为 2ZnS+4H++O2=2Zn2++2S↓+2H2O;
(6)该炼锌工艺参加反应的物质时煤炭饼和炉甘石(碳酸锌),得到的物质是倭铅(金属锌) 和 CO,
ZnCO3+2C Zn+3CO↑。