- 561.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2007年普通高等学校招生全国统一考试(四川卷)
理科综合能力测试
第 I 卷
本卷共 21 小题,每小题 6 分,共 126 分。
可能用到的相对原子质量(原子量):H 1 C 12 N 14 O 16 Fe 56 Cu 64
一、选择题(本题包括 13 小题。每小题只有一个选项符合题意).
1.下列关于人和高等动物机体代谢及调节的相关叙述,正确的是
A.多余的糖可以转化为非必需氨基酸,而多余的氨基酸可以贮存
B.脂肪和蛋白质的分解代谢强度受糖类分解代谢强度的制约
C.肾上腺素的分泌受下丘脑直接控制,与血糖浓度无关
D.胰高血糖素促进肝脏和肌肉细胞的糖原分解为葡萄糖
2.下列关于生物膜的叙述,不正确的是
A.细胞完成分化以后,其细胞膜的通透性稳定不变
B.膜的流动性是细胞生物膜相互转化的基础
C.特异性免疫系统通过细胞膜表面的分子 识别分泌蛋白合成越旺盛的细胞,
D.“自己”和“非己”其高尔基体膜成分的更新速度越快
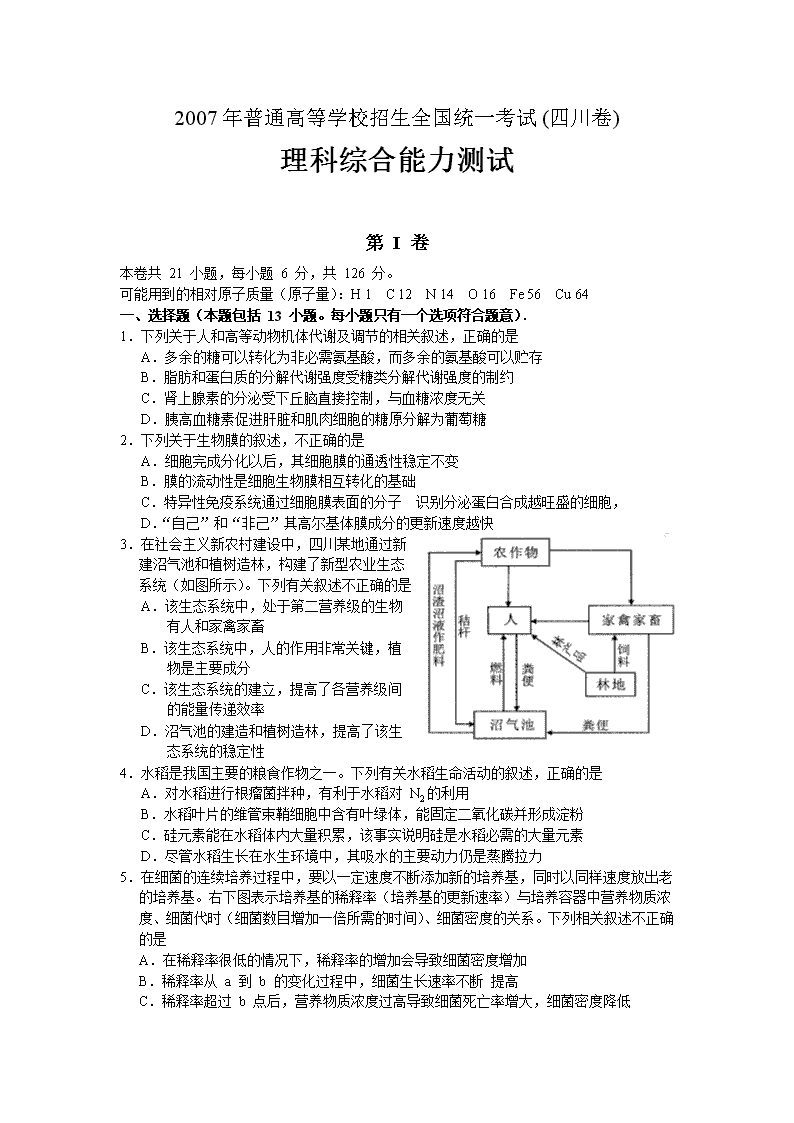
3.在社会主义新农村建设中,四川某地通过新建沼气池和植树造林,构建了新型农业生态系统(如图所示)。下列有关叙述不正确的是
A.该生态系统中,处于第二营养级的生物有人和家禽家畜
B.该生态系统中,人的作用非常关键,植物是主要成分
C.该生态系统的建立,提高了各营养级间 的能量传递效率
D.沼气池的建造和植树造林,提高了该生 态系统的稳定性
4.水稻是我国主要的粮食作物之一。下列有关水稻生命活动的叙述,正确的是
A.对水稻进行根瘤菌拌种,有利于水稻对 N2的利用
B.水稻叶片的维管束鞘细胞中含有叶绿体,能固定二氧化碳并形成淀粉
C.硅元素能在水稻体内大量积累,该事实说明硅是水稻必需的大量元素
D.尽管水稻生长在水生环境中,其吸水的主要动力仍是蒸腾拉力
5.在细菌的连续培养过程中,要以一定速度不断添加新的培养基,同时以同样速度放出老的培养基。右下图表示培养基的稀释率(培养基的更新速率)与培养容器中营养物质浓度、细菌代时(细菌数目增加一倍所需的时间)、细菌密度的关系。下列相关叙述不正确的是
A.在稀释率很低的情况下,稀释率的增加会导致细菌密度增加
B.稀释率从 a 到 b 的变化过程中,细菌生长速率不断 提高
C.稀释率超过 b 点后,营养物质浓度过高导致细菌死亡率增大,细菌密度降低
D.为持续高效地获得发酵产品,应将稀释率控制在 b 点附近
6.下列家庭验中不涉及化学变化的是
A.用熟苹果催熟青香蕉 B.用少量食醋除去水壶中的水垢
C.用糯米、酒曲和水制甜酒酿 D.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐
7.NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4LCHCl3中含有氯原子数目为3NA
B.7gCnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10NA
D.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA
8.下列反应的离子方程式书写正确的是
A.浓烧减溶液中加入铝片:Al + 2OH-=AlO2-+H2↑
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2 +2H+=2Fe3++2H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
9.短周期元家W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族.W 与X 可形成共价化合物WX2.Y原子的内层电子总数是其最外层电子数的2.5 倍· 下列叙述中不正确的是
A.WX2分子中所有原子最外层都为8 电子结构
B.WX2、ZX2的化学键类型和晶体类塑都相同
C.WX2是以极性键结合成的非极性分子
D.原子半径大小顺序为X c (CH3COO-)>c(OH-)>c(H+)
D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
12.咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下所示:关于咖啡鞣酸的下列说法不正确的是
A.分子式为C16H18O9
B.与苯环直接相连的原子都在同一平面上
C.咖啡鞣酸水解时可消耗8molNaOH
催化剂
高温
D.与浓溴水既能发生取代反应又能发生加成反应
13.向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g) CO2 +H2。
当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
A.0.5molCO+2molH2O(g)+1molCO2+1molH2
B.1molCO+1molH2O(g)+1molCO2+1molH2 .
C.0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D.0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
二、选择题(本题包括 8 小题。每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得 6 分,选对但不全的得 3 分,有选错的得 0分)
14.如图所示,厚壁容器的一端通过胶塞插进一支灵敏温度计和一根气针,另一端有个用卡子卡住的可移动胶塞。用打气筒慢慢向容器内打气,使容器内的压强增大到一定程度,这时读出温度计示数。打开卡子,胶塞冲出容器口后
A.温度计示数变大,实验表明气体对外界做功,内能减少
B.温度计示数变大,实验表明外界对气体做功,内能增加
C.温度计示数变小,实验表明气体对外界做功,内能减少
D.温度计示数变小,实验表明外界对气体做功,内能增加
15.如图所示,矩形线圈 abcd 在匀强磁场中可以分别绕垂直于磁场方向的轴
P1和P2以相同的角速度匀速转动,当线圈平面转到与磁场方向平行时
A.线圈绕P1转动时的电流等于绕P2转动时的电流
B.线圈绕P1转动时的电动势小于绕P2转动时的电动势
C.线圈绕P1和P2转动时电流的方向相同,都是 a→b→c→d
D.线圈绕P1转动时 dc边受到的安培力大于绕P2转动时 dc 边受到的安培力
16.关于天然放射现象,下列说法正确的是
A.放射性元素的原子核内的核子有半数发生变化所需的时间就是半衰期
B.放射性物质放出的射线中, a 粒子动能很大,因此贯穿物质的本领很强
C.当放射性元素的原子的核外电子具有较高能量时,将发生β衰变
D.放射性的原子核发生衰变后产生的新核从高能级向低能级跃迁时,辐射出γ射线我
17.我国探月的“嫦娥工程”已启动,在不久的将来,我国宇航员将登上月球。假如宇航员在月球上测得摆长为l的单摆做小振幅振动的周期为 T ,将月球视为密度均匀、半径为r的球体,则月球的密度为
18.如图所示,弹簧的一端固定在竖直墙上,质量为 m 的光滑弧形槽静止在光滑水平面上,底部与水平面平滑连接,一个质量也为 m 的小球从槽高h处开始自由下滑
A.在以后的运动过程中,小球和槽的动量始终守恒
B.在下滑过程中小球和槽之间的相互作用力始终不做功
C.被弹簧反弹后,小球和槽都做速率不变的直线运动
D.被弹簧反弹后,小球和槽的机械能守恒,小球能回到槽高 h 处
19.两种单色光 a 和 b , a 光照射某金属时有光电子逸出, b 光照射该金属时没有光电子逸出,则
A.在真空中, a 光的传播速度较大 B.在水中,a 光的波长较小
C.在真空中,b 光光子的能量较大 D.在水中,b 光的折射率较小
20.图甲为一列简谐横波在某一时刻的波形图,图乙为质点P以此时刻为计时起点的振动图象。从该时刻起
.
A.经过 0.35 s时,质点Q距平衡位置的距离小于质点P距平衡位置的距离
B.经过 0 .25s 时,质点Q 的加速度大于质点P的加速度
C.经过 0.15s,波沿 x 轴的正方向传播了 3m
D.经过 0.1s 时,质点Q的运动方向沿 y 轴正方向
21.如图所示,长方形 abcd 长 ad = 0.6m ,宽 ab = 0.3m , O、e 分别是 ad、bc 的中点,以 ad 为直径的半圆内有垂直纸面向里的匀强磁场(边界上无磁场),磁感应强度 B=0.25T 。一群不计重力、质量 m =3 ×107 kg 、电荷量 q =+2×10-3C 的带电粒子以速度v=5×l02m/s 沿垂直 ad 方向且垂直于磁场射人磁场区域
A.从 Od 边射人的粒子,出射点全部分布在 Oa 边
B.从 aO边射人的粒子,出射点全部分布在 ab 边
C.从Od 边射入的粒子,出射点分布在Oa 边和 ab 边 D.从aO边射人的粒子,出射点分布在ab 边和bc边
第II卷
本卷共 10 题,共 174 分。
22 . ( 17 分)
( l )在做“研究平抛物体的运动”实验时,除了木板、小球、斜槽、铅笔、图钉之外,下列器材中还需要的是________________.
A.游标卡尺 B.秒表 C.坐标纸 D.天平 E.弹簧秤 F.重垂线
实验中,下列说法正确的是_______________
A.应使小球每次从斜槽上相同的位置自由滑下
B.斜槽轨道必须光滑
C.斜槽轨道末端可以不水平
D.要使描出的轨迹更好地反映真实运动,记录的点应适当多一些
E.为了比较准确地描出小球运动的轨迹,应该用一条曲线把所有的点连接起来
(2)甲同学设计了如图所示的电路测电源电动势 E 及电阻R1和 R2阻值。实验器材有:待测电源 E (不计内阻),待测电阻 R1 ,待测电阻 R2, 电压表V(量程为 1.5V ,内阻很大),电阻箱 R (0一99.99Ω ) 单刀单掷开关 S1 ,单刀双掷开关S2,导线若干。
① 先测电阻 R1的阻值。请将甲同学的操作补充完整:闭合S1,将S2切换到 a ,调节电阻箱,读出其示数 r 和对应的电压表示数 Ul , 保持电阻箱示数不变,读出电压表的示数。则电阻 R1的表达式为
R1=_____________________________。
② 甲同学已经测得电阻 Rl = 4.8Ω ,继续测电源电动势 E 和电阻R2 的阻值。该同学的做法是:闭合S1,将S2切换到 a,多次调节电阻箱,读出多组电阻箱示数 R 和对应的电压表示数 U,由测得的数据,绘出了如图所示的
- 图线,则电源电动势E=___________________V ,电阻 R2 = _________Ω。
③ 利用甲同学设计的电路和测得的电阻 Rl ,乙同学测电源电动势 E 和电阻 R2的阻值的做法是:闭合 S 1,将S2 切换到 b ,多次调节电阻箱,读出多组电阻箱示数 R 和对应的电压表示数U ,由测得的数据,绘出于相应的- 图线,根据图线得到电源电动势 E 和电阻 R2 。这种做法与甲同学的做法比较,由于电压表测得的数据范围___________(选填“较大”、“较小”或“相同” ) ,所以___________同学的做法更恰当些。
23.(16分)
如图所示,P、Q为水平面内平行放置的光滑金属长直导轨,间距为L1,处在竖直向下、磁感应强度大小为B1的匀强磁场中。一导体杆ef垂直于P、Q 放在导轨上,在外力作用下向左做匀速直线运动。质量为 m、每边电阻均为r、边长为L2的正方形金属框 abcd 置于竖直平面内,两顶点 a、b通过细导线与导轨相连,磁感应强度大小为 B2的匀强磁场垂直金属框向里,金属框恰好处于静止状态。
不计其余电阻和细导线对 a、b 点的作用力。
( 1 )通过 ab 边的电流Iab是多大?
( 2 )导体杆 ef 的运动速度v是多大?
24.( 19 分)如图所示,一根长 L = 1.5m 的光滑绝缘细直杆MN ,竖直固定在场强为 E ==1.0 ×105N / C 、与水平方向成θ=300角的倾斜向上的匀强电场中。杆的下端M固定一个带电小球 A ,电荷量Q=+4.5×10-6C;另一带电小球 B 穿在杆上可自由滑动, 电荷量q=+1.0 ×10一6 C,质量m=1.0×10一2 kg 。现将小球B从杆的上端N静止释放,小球B开始运动。(静电力常量k=9.0×10 9N·m2/C2,取 g =l0m / s2)
( l )小球B开始运动时的加速度为多大?
( 2 )小球B 的速度最大时,距 M 端的高度 h1为多大?
( 3 )小球 B 从 N 端运动到距 M 端的高度 h2=0.6l m 时,速度为v=1.0m / s ,求此过程中小球 B 的电势能改变了多少?
25.( 20 分)
目前,滑板运动受到青少年的追捧。如图是某滑板运动员在一次表演时的一部分赛道在竖直平面内的示意图,赛道光滑,FGI 为圆弧赛道,半径 R =6 .5m , G为最低点并与水平赛道 BC 位于同一水平面, KA、DE 平台的高度都为 h = 18m 。B、C、F处平滑连接。滑板 a 和 b 的质量均为m, m= 5kg ,运动员质量为 M , M= 45kg 。
表演开始,运动员站在滑板 b 上,先让滑板 a 从 A 点静止下滑,t1=0.1s后再与 b 板一起从 A 点静止下滑。滑上 BC 赛道后,运动员从 b 板跳到同方向运动的 a 板上,在空中运动的时间 t2=0.6s。(水平方向是匀速运动)。运动员与 a 板一起沿CD 赛道上滑后冲出赛道,落在EF赛道的P点,沿赛道滑行,经过G点时,运动员受到的支持力 N = 742.5N。(滑板和运动员的所有运动都在同一竖直平面内,计算时滑板和运动员都看作质点,取 g= 10m/s)
( 1 )滑到G点时,运动员的速度是多大?
( 2 )运动员跳上滑板 a 后,在 BC 赛道上与滑板 a 共同运动的速度是多大?
( 3 )从表演开始到运动员滑至 I 的过程中,系统的机械能改变了多少?
26.(18分)
在实验室堕可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ① 为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
( l )制取氯气时,在烧瓶里加人一定量的二氧化锰.通过_______________________
(坡写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在① 与② 之间安装盛有_____________________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
( 2 )比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
______________________________________________________
反应完毕经冷却后,② 的试管中有大量晶体析出。右图中符合该
晶体溶解度曲线的是_____________________(填写编号字母);从②的试管中分离出该晶体的方法是____________________(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是:
___________________________________________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象
原因
溶液最初从紫色逐渐变为____色
氯气与水反应生成的H+使石蕊变色
随后溶液逐渐变为无色
_______________________________________________
然后溶液从无色逐渐变为____色
_______________________________________________
27.( 15 分)
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________
(填写序号)。
(4)反应④ 的离子方程式是:_______________________________________
( 5 )将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是:
_____________________________________________________________________。
28.( 12 分)
有机化合物A的分子式是C13 H20O8(相对分子质量为304), 1molA 在酸性条件下水解得到4 molCH3COOH 和1molB。B 分子结构中每一个连有经基的碳原子上还连有两个氢原子。
请回答下列问题:
( l ) A 与B 的相对分子质量之差是__________________________。
(2 ) B 的结构简式是:_____________________________________。
( 3 ) B 不能发生的反应是________________________(填写序号)
① 氧化反应 ②取代反应 ③ 消去反应 ④加聚反应
( 4 )己知:
以两种一元醛(其物质的量之比为1:4)和必要的无机试剂为原料合成B,写出合成B的各步反应的化学方程式。
29.( 15 分)
二甲醚(CH3OCH3
)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能。四川是利用天然气生产二甲醚的重要基地之一。
请填写下列空白:
(l)与二甲醚相对分子质量相等且元素种类相同的有机物的结构简式是:
________________________________________________。
( 2 )二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:
________________________________________________。
( 3 )以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池。该电池中负极上的电极反应式是:______________________________________________________。
( 4 )制备二甲醚的合成气可由甲烷与水燕气或二氧化碳经高温催化反应制得。合成气除制二甲醚外,还可用于冶炼金属,用它冶炼铁的生产过程可示意如下:
① 在催化反应室中进行的反应均为可逆反应.增大体系的压强对甲烷转化率的影响是 ___________________________(填“增大”、“减小”或“不变”)。
② 在上述炼铁过程的某时间段内,若有x m3(标准状况)的甲烷进入燃烧室中充分燃烧,还原反应室有5 y kg(y/11.2×103mol)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进人催化反应室,则这些高温尾气在理论上可产生合成气_______________m3(标准状况)。
30.( 20 分)
( 1 )萝卜的生长发育过程受多种激素的共同调节,其中细胞分裂素起着重要作用。
① 细胞分裂素主要存在于________________________________________的部位,其主要生理功能是促进________________________________和____________________________。
② 研究还发现,氨基酸等营养物质可以向细胞分裂素浓度高的部位移动。为验证这一结论,有人设计了下列实验方案。请根据提供的实验材料和用具,写出第二步及以后的实验步骤并预测实验结果。
材料用具:生长状况相同的萝卜成熟叶片若干,适宜浓度的细胞分裂素溶液,含14C 标记氨基酸的溶液(氨基酸可被叶片吸收并在叶片内移动),蒸馏水,棉签,检测放射性强度的设备等。
实验步骤:
第一步:取生长状况相同的萝卜成熟叶片若干,在叶片左半叶某一部位涂抹含14C 标记氨基酸的溶液(如图所示)。
第二步:
实验结果:
( 2 )萝卜是 C3 植物,图 1 为萝卜光合作用的部分过程图解。
① 该过程发生的场所是__________________________________,在该过程中能使光能转换为电能的色素是_________________________________________。
② 进行正常光合作用的叶片,如果在叶绿体中的 NA DPH 与 NADP+含量相等的情况下,突然分停止供给 CO2 ,请在图 2 中绘出叶绿体中 NADPH 含量的变化曲线。
31.( 22分)
( l )下面是某基因的部分碱基序列,序列I为内含子的一部分,序列II为外显子的一部分。
上列片段所编码蛋白质的氨基酸序列为“…甲硫氨酸一精氨酸一谷氨酸一丙氨酸一天冬氨酸一撷氨酸 … ”(甲硫氨酸的密码子是 AUG )。
① 该基因表达过程中, RNA 的合成在________________中完成,此过程称为_______。
② 请写出编码上述氨基酸序列的 mRNA 序列__________________________________。
③ 如果序列 I 中箭头所指碱基对 被替换为 ,该基因上列片段编码的氨基酸序列为:
______________________________________________________________________________。
④如果序列II中箭头所指碱基对 缺失,该基因上列片段编码的氨基酸序列为:
______________________________________________________________________________。
( 2 )人的耳垢有油性和干性两种,是受单基因(A、a)控制的。有人对某一社区的家庭进行了调查,结果如下表: (单位:个)
① 控制该相对性状的基因位于_______________染色体上,判断的依据是___________。
② 一对油耳夫妇生了一个干耳儿子,推测母亲的基因型是______________这对夫妇生一个油耳女儿的概率是______________。
③ 从组合一的数据看,子代性状没有呈典型的孟德尔分离比( 3 : 1 ) ,其原因是____
_____________________________________________________________________________。
④ 若一对干耳夫妇生了一个左耳是干性的、右耳是油性的男孩,出现这种情况的原因可能是________________________________________________________________________。
2007年普通高等学校招生全国统一考试(四川卷)
理科综合能力测试答案
第 I 卷包括 21 小题,每小题 6 分,共 126 分。
一、选择题
1 . B 2 . A 3 . C 4 . D 5 . C 6 . D 7 . B 8 . C 9 . D 1 0 . A 1 1 . D 1 2 . C 13 . B
二、选择题:
14 . C 15 . A 16 . D 17 . B . 18 . C 19 . BD . 20 . AC 21 . D
第II卷包括 10 小题,共 174 分。
22 . ( 17 分)
( 1 ) CF ; AD 。
26.( 18 分)
( l )分液漏斗 B
( 2 )碱溶液(或反应物)的浓度不同,反应温度不同
M 过滤
( 3 ) Cl2 + 2OH-=ClO- + Cl一+H2O
( 4 )
红
氯气与水反应生成的HClO将石蕊氧化为无色物质
黄绿
继续通入的氯气溶于水使溶液呈黄绿色
27.( 15 分)
( l )四(或4 ) VIII
( 2 ) l :2
( 3 )③
( 4 ) 3Fe2+ + NO3- + 4H+ + = 3Fe3+ + NO↑+2H2O
( 5 ) Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O
28 . ( l2 分)
( l ) 168
(2)C(CH2OH)4
( 3 )③④
( 4 ) CH 3CHO+3HCHO(CH2OH )3CCHO
(CH2OH )3CCHO+ HCHO + NaOH(浓)C(CH2OH)4
29.(15分)
(1)CH3CH2OH、HCOOH
(2)3CO+3H2=CH3OCH3 或2CO+4H2=CH3OCH3+H2O
(3)CH3OCH3+16OH—-12e-=2CO32-+11H2O
(4)①减小
②12(x + y)